牦牛卵泡发育过程中卵丘卵母细胞复合体的转录组分析
何向东 字向东 夏 忆 陈 莹
(西南民族大学 动物科学国家民委重点实验室,成都 610041)
雌性动物在出生前后,卵巢上形成大量由卵母细胞和周围包裹一层扁平状的颗粒细胞前体细胞构成的原始卵泡。到初情期以后,这些原始卵泡会分期分批有规律地发育依次形成初级卵泡、次级卵泡、三级卵泡和成熟卵泡。随着卵泡的发育,颗粒细胞不断增殖,当发育到次级卵泡后开始出现膜细胞的发育,三级卵泡以后现颗粒细胞之间的分离,形成许多不规则的腔隙,充满卵泡液,各个小腔隙逐渐合并形成卵泡腔,进入有腔卵泡发育阶段。随着卵泡液增多,卵泡腔也逐渐扩大,卵母细胞被挤向一边,并被包裹在一团颗粒细胞中,该结构即为卵丘卵母细胞复合体(Cumulus oocyte complexes, COCs)。COCs中卵丘细胞与卵母细胞的互作对卵泡发育和卵母细胞成熟起至关重要的作用。绝大多数卵泡在不同发育阶段闭锁,只有极少数发育到最后成熟排卵。遗传、营养和内分泌等一系列因素作用于下丘脑-垂体-性腺轴,直接或间接调节COCs中一系列基因和蛋白按特定的时空顺序表达决定卵泡发育的命运。
牦牛(Bos
grunniens
)是分布在海拔2 500~5 000 m 的青藏高原及其毗邻高山、亚高山地区的重要牛种。目前,全世界有约1 500余万头牦牛,其中,我国的牦牛数量占世界95%以上。牦牛是我国青藏高原人民赖以生存的生产和生活资料,对高寒低氧的生态环境的独特适应能力决定了该畜种在青藏高原畜牧业中占据不可替代的特殊地位。但是,牦牛是季节性繁殖的单胎动物,其繁殖季节主要集中在每年的7~9月份,繁殖率低(40%~60%),因此,探明牦牛卵泡发育调控机制对提高牦牛繁殖力具有重要意义。自2012 年牦牛全基因组序列测定发布后,以基因组学、转录组学为代表的“组学”相关技术和方法逐步被应用到牦牛科学上,有关牦牛基因组和转录组研究的成果相继涌现,并取得了诸多突破性的研究成果。据报道,牦牛体外成熟卵母细胞与未成熟卵母细胞有4 767个差异表达基因(Differentially expressed genes, DEGs),凋亡通路、内吞通路及代谢通路是上调的关键调控通路, 而代谢通路、丙酮酸代谢、黏着斑及氧化磷酸化是下调的关键调控通路。母牦牛的卵巢在冷季(非繁殖季节)和暖季(繁殖季节)存在320个DEGs,主要包括FST
、CYP1A1
、PIK3R1
和PIK3R2
等与雌激素的分泌与代谢信号通路相关的基因。牦牛的这些基因组和转录组在卵泡发育机制的相关研究主要集中在对整个卵巢或卵母细胞的研究。但是,有关牦牛COCs发育转录组学尚未见报道,因此,本研究旨在探讨牦牛有腔卵泡发育过程中COCs转录组变化,为解析牦牛卵泡发育与成熟调控机制提供理论依据。1 材料与方法
1.1 样品收集及RNA提取
2019年11月,在四川省成都市青白江区屠宰场采集牦牛卵巢,母牦牛均为健康未孕。目前,用于体外受精(In
vitro
fertilization, IVF)的牦牛与普通牛COCs通常都是在卵巢表面直径为2~8 mm的卵泡中收集,而在普通牛的研究表明,直径2~3 mm与6~8 mm的卵泡中获得的COCs的发育能力有显著差异,因此,本研究将直径2~3 mm、4~5 mm和6~8 mm的牦牛卵泡分别确定为小卵泡、中卵泡和大卵泡。用带18针头的注射器从卵泡中分别抽取COCs,每种卵泡中收集20枚COCs,采用Trizol试剂(Invitrogen, 美国)提取总RNA用于构建测序文库。1.2 RNA-seq 文库构建
RNA的质量和含量通过使用NanoDrop 2000分析仪(Thermo,美国)检测吸光度260 nm/280 nm比值进行测定, 完整性通过Agilent 2100生物分析仪(Agilent Technologies,美国)进行检测。每种卵子取1 μg质量合格的RNA混合样,按NEBNextUItraRNA Library Prep Kit for Illumina(NEB,美国)建库试剂盒的说明书进行建库。
主要包括以下步骤:利用Oligo(dT)磁珠富集每种卵子带有polyA尾的mRNA,加入NEB片段化缓冲液(5×)将mRNA随机打断成短片段。以片段化的mRNA为模版,随机寡核苷酸为引物,在M-MuLV逆转录酶体系中合成第一链cDNA。随后用DNA polymerase I和RNase H合成第二链cDNA。纯化后的双链cDNA经过末端修复、加A尾并连接测序接头后,用AMPure XP beads(Beckman Coulter, 美国)筛选大小在250~300 bp的cDNA片段进行PCR扩增,然后再次使用AaMPure XP beads纯化PCR产物,最终获得双末端(Paired-end, PE)测序文库。文库经Qubit 2.0荧光定量仪(Life Technologies,美国)和Agilen1 2100生物分析仪质检合格后在 Illumina cBot 上进行簇的生成,最后用 Illumina HiSeq2500 进行双末端测序(天津诺禾致源科技有限公司)。
1.3 序列分析
测序得到的原始数据首先用SOAPnuke(https:∥github.com/BGI-flexlab/SOAPnuke, v1.5.2)进行过滤得到clean reads用于后续分析。采用HiSat软件(http:∥www.ccb.jhu.edu/software/hisat, v2.0.4)将过滤后的数据比对到牦牛参考基因组(https:∥www.ncbi.nlm.nih.gov/genome/?term=yak)。用RSEM(http:∥deweylab. biostat.wisc.edu/ RSEM, v1.2.12)计算基因表达水平。
1.4 数据分析
使用edgeR(v3.28.0)软件进行差异表达基因(Differentially expressed genes, DEGs)检测,以|logFold Change|>1且P
<0.05为筛选标准筛选DEGs。将获得的DEGs向GO数据库(http:∥www.geneontology.org/)各个条目进行映射,计算其数目,用Benjamini 法对P
值进行校正后,Q<0.05的GO条目即为在DEGs中显著富集的GO条目。通过与KEGG(Kyoto encyclopedia of genes and genomes,京都基因与基因组百科全书)数据库(http:∥wego.genomics.org.cn)进行比对,对基因涉及的信号通路或代谢途径进行分析。2 结果与分析
2.1 测序质量评估及基本数据分析
利用Agilent High Sensitivity DNA Kit试剂盒经Agilent 2100生物分析仪检测,构建的牦牛小卵泡COCs、中卵泡COCs和大卵泡COCs 3个测序文库样本峰图显示在1~2 kb片段长度范围存在明显的目的产物主峰,有部分1 kb以下小片段产物但比例较小,表明原始样本完整性较好,判定合格,符合建库要求。3个样本Q30百分比分别为 93.70%、93.52%和93.68%,说明测序质量和文库构建质量高,测序数据准确可靠,可满足后续分析。对小、中和大卵泡COCs的转录组测序分析,碱基含量分布图显示碱基质量稳定于30%~40%,碱基质量分布图显示A-T、C-G含量均大体对应重合,说明碱基构成稳定且平衡。说明本次转录组测序质量高,符合转录组数据研究要求。
2.2 测序结果比对分析
对HiSeq2500测序所得的原始测序序列进行数据过滤后,得到小卵泡、中卵泡和大卵泡 3个发育阶段的牦牛COCs干净数据序列数(Clean reads)为32 905 166~47 542 818条。采用HiSat软件将获得的Clean reads与参考基因组进行比对分析。结果表明,每个阶段有94.62%~95.51% Clean reads唯一比对(Unique-mapped)上牦牛参考基因,比对到基因组多个位置的序列比例(Multi-map rate)为2.16%~2.22%,符合要求(表1)。
表1 牦牛卵丘卵母细胞复合体转录组测序数据与参考基因组比对分析
Table 1 Comparative analysis of transcriptome of yak COCs and mapping to the reference genome
指标Index小卵泡COCsSmall COCs中卵泡COCsMedium COCs大卵泡COCsLarge COCs原始序列数 Raw reads47 629 88432 982 61644 094 580干净数据序列数 Clean reads43 998 576 (99.78)32 905 166 (99.78)47 542 818 (99.82)唯一比对到基因组的序列数 Unique-mapped42 023 040(95.51)31 250 036(94.97)44 985 014(94.62)比对到基因组多位点的序列数 Multi-mapped reads1 020 767(2.32)710 752(2.16)1 055 451(2.22)未比对到基因组的序列数 Unmapped reads954 769(2.17)944 378(2.87)1 502 353(3.16)
注:括号内的数字表示占原始序列数的百分比。
Note: Data in the brackets represent percentage to raw reads.
2.3 卵泡发育过程中COCs基因表达特征及差异表达基因分析
在小、中、大卵泡3个阶段的COCs中共检测到17 342个基因表达,其中有14 660个基因在3个阶段共表达,有692、315和399个基因分别在小、中、大COCs中特异表达(图1)。
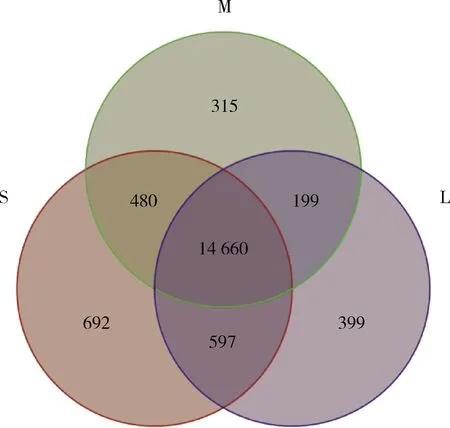
S:小卵泡的卵丘卵母细胞复合体;M:中卵泡的卵丘卵母细胞复合体;L:大卵泡的卵丘卵母细胞复合体 S: COCs from small follicles; M: COCs from medium follicles; L: COCs from large follicles图1 牦牛卵泡发育过程中COCs基因表达韦恩图Fig.1 Venn diagram of gene expression of COCs during follicle development
采用edgeR软件进行DEGs检测的结果显示,小卵泡与中卵泡COCs之间有879个DEGs,其中,S100钙结合蛋白A9(S100 calcium binding protein A9,S100A9
)、可溶性载体族25(Solute carrier family 25 member 47,SLC25A47
)和胞外基质磷酸糖蛋白(Matrix extracellular phosphoglycoprotein,MEPE
)等435个基因上调,胞质tRNA2-硫代化蛋白(Cytoplasmic tRNA 2-thiolation protein 1,TUC1/NCS6
)、非典型趋化因子受体3(Atypical chemokine receptor 3,ACKR3
)和谷氨酸受体代谢型1(Glutamate receptor, metabotropic 1,GRM1
)等444个基因下调。中卵泡与大卵泡COCs之间有1 560个DEGs,其中,神经肽B (Neuropeptide B,NPB
)、丝氨酸/精氨酸相关核基质蛋白2(Serine/arginine repetitive matrix protein 2-like,SRRM2
)和胞质tRNA2-硫代化蛋白1(Cytoplasmic tRNA 2-thiolation protein 1,TUC1/NCS6
)等590个基因上调,锚蛋白重复结构域蛋白1(Ankyrin repeat domain 1,ANKRD1
)、同源异形盒D10(Homeobox D10,HOXD10
)和去整合素金属蛋白酶1(ADAM metallopeptidase with thrombospondin type 1 motif 1,ADAMTS1
)等970个基因下调(图2(a))。两个发育阶段有423个DEGs相同,中卵泡发育到大卵泡COCs的特异DEGs数(1 137个)高于小卵泡发育到中卵泡COCs的特异DEGs数(456)(图2(b))。牦牛小卵泡到中卵泡发育过程中COCs的前10位上调基因包括和下调基因及从中卵泡发育到大卵泡前10位上调基因和下调基因分别见表2和3,2个阶段的前10位上调基因和下调基因存在明显差异。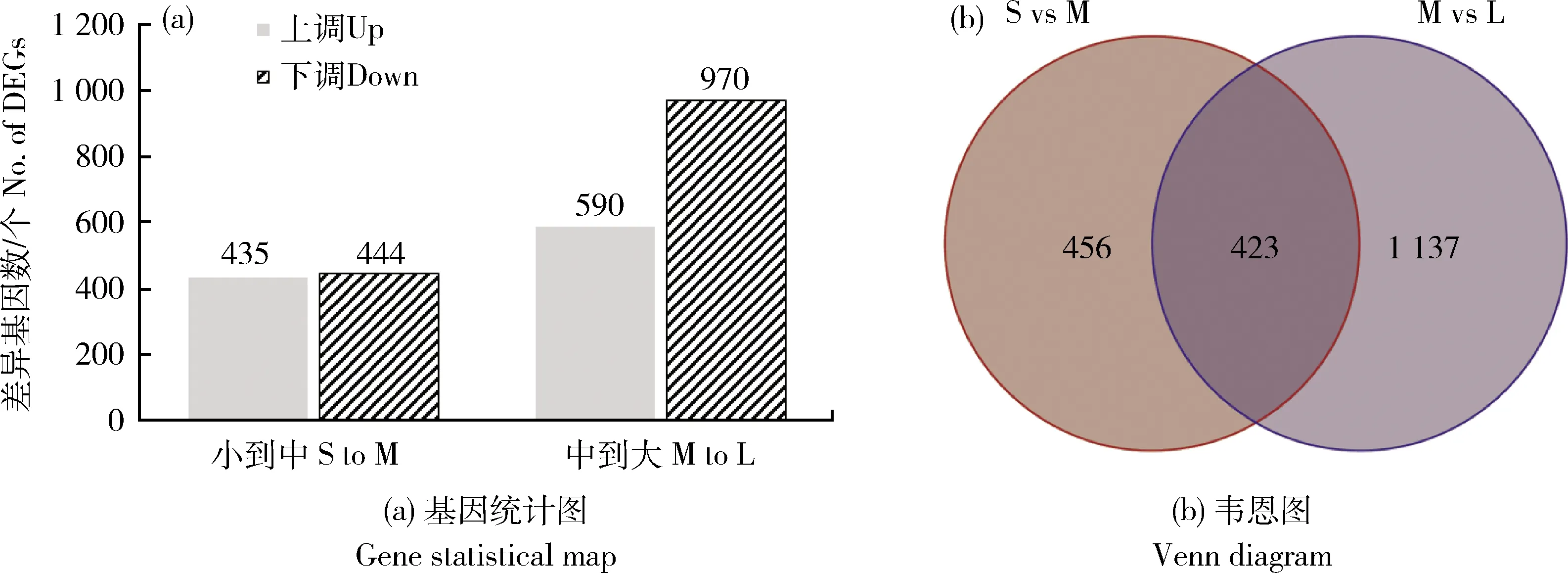
S:小卵泡COCs;M:中卵泡COCs;L:大卵泡COCs。 S: COCs from small follicles; M: COCs from medium follicles; L: COCs from large follicles.图2 牦牛COCs差异表达基因分析Fig.2 DEG analysis of yak COCs
表2 牦牛小卵泡与中卵泡卵丘卵母细胞复合体的前10位上调基因和下调基因
Table 2 Top 10 up- and down-regulated DEGs between yak COCs from small and medium follicles
基因Gene登录号Gene IDlog2倍比log2 FCP值P value基因描述Description上调基因 Up-regulated genes S100A9BmuPB0184597.664 40.000 1S100钙结合蛋白A9 S100 calcium binding protein A9 SLC25A47BmuPB0019597.344 20.000 4可溶性载体族25 Solute carrier family 25 member 47 MEPEBmuPB0205947.344 20.000 4胞外基质磷酸糖蛋白Matrix extracellular phosphoglycoprotein HCRTBmuPB0070587.344 20.000 4下丘泌素神经肽前体Hypocretin neuropeptide precursor AGXT2BmuPB0069427.344 20.000 4丙氨酸乙醛酸氨基转移酶2Alanine-glyoxylate aminotransferase 2 SLC23A1BmuPB0064007.152 90.000 7可溶性载体族23 Solute carrier family 23 member 1 ANKRD62BmuPB0191967.152 90.000 7锚蛋白重复结构域蛋白Ankyrin repeat domain-containing protein 62-like DIRAS3BmuPB0121377.152 90.000 7DIRAS家族 GTP酶3 DIRAS family GTPase 3 MOXD2BmuPB0217987.152 90.000 7DBH 样单加氧酶蛋白2Putative DBH-like monooxygenase protein 2 IFNB2BmuPB0143727.152 90.000 7干扰素β-2 Interferon beta-2下调基因 Down-regulated genes TUC1/NCS6BmuPB021329-8.564 88.76×10-7胞质tRNA2-硫代化蛋白Cytoplasmic tRNA 2-thiolation protein 1 ACKR3BmuPB017683-8.513 41.22×10-6非典型趋化因子受体3 Atypical chemokine receptor 3 GRM1BmuPB007411-8.317 62.94×10-6谷氨酸受体代谢型1 Glutamate receptor, metabotropic 1 ANO2BmuPB013453-8.125 67.72×10-6阿诺菌胺-2 Anoctamin-2 BNIPLBmuPB019114-7.779 14.53×10-5BCL2样相互作用蛋白质 BCL2 interacting protein like DSG2BmuPB002343-7.642 27.45×10-5桥粒芯糖蛋白2 Desmoglein 2 LRRC38BmuPB006751-7.491 00.000 2富含亮氨酸重复蛋白38 Leucine rich repeat containing 38 LDHDBmuPB001552-7.322 10.000 3乳酸脱氢酶D Lactate dehydrogenase D TRIM68BmuPB015987-7.261 10.000 4三结构域蛋白家族 Tripartite motif containing 68 TTFBmuPB012707-7.197 40.000 5T转录因子T brachyury transcription factor
注:logFC倍比表示log中卵泡COCs基因表达量/小卵泡COCs基因表达量。
Note: logFC represents log gene expression of medium COCs to small COCs.
2.4 差异表达基因的GO富集分析.
经GO注释分类分析后发现,牦牛小卵泡与中卵泡COCs之间的DEGs注释到106条GO条目(GO term)上,其中生物过程(Biological process, BP)类别(Category)46条,细胞组成(Cellular component, CC)类别25条,分子功能(Molecular function, MF)类别35条。在BP分类中,信号传导(Signal transduction)、运输(Transport)和生物过程(Biological process)等GO条目最为显著富集;在CC分类中,细胞组分(Cellular component)、蛋白质复合物(Protein complex)和细胞膜(Plasma membrane)等GO 条目最为显著富集;在MF分类中,结构分子活性(Structural molecule activity)、酶调节剂活性(Enzyme regulator activity)和脂质结合(Lipid binding)等GO 条目最为显著富集。每个分类中前20条GO条目见图3。
表3 牦牛中卵泡与大卵泡卵丘卵母细胞复合体的前10位上调基因和下调基因
Table 3 Top 10 up- and down-regulated DEGs between yak COCs from medium and large follicles
基因Gene登录号Gene IDlog2倍比log2FCP值P value基因描述Description上调基因 Up-regulated genes NPBBmuPB0119479.188 62.87×10-8神经肽B Neuropeptide B SRRM2BmuPB0212578.817 32.23×10-7丝氨酸/精氨酸相关核基质蛋白2Serine/arginine repetitive matrix protein 2-like TUC1/NCS6BmuPB0213298.637 26.35×10-7胞质tRNA2-硫代化蛋白1Cytoplasmic tRNA 2-thiolation protein 1 SEZ6LBmuPB0162168.374 92.45×10-6癫痫样相关蛋白6 Seizure related 6 homolog like TRIM68BmuPB0159878.316 23.54×10-6三结构域蛋白家族 Tripartite motif containing 68 MGAM2BmuPB0217968.223 35.19×10-6麦芽糖化酶 Probable maltase-glucoamylase 2 HIST2H3BE-LBmuPB0148268.089 59.48×10-6组蛋白H2BHistone H2B type 3-B-like RHOXF1LBmuPB0193097.980 31.80×10-5Rhox同源框家族成员1样Rhox homeobox family member 1-like LRRIQ4BmuPB0110547.820 53.57×10-5富含亮氨酸重复蛋白Q4Leucine rich repeats and IQ motif containing 4 SPERTBmuPB0025867.777 64.53×10-5精细胞相关蛋白 Spermatid associated下调基因 Down-regulated genes ANKRD1BmuPB006185-9.661 22.07×10-9锚蛋白重复结构域蛋白1 Ankyrin repeat domain 1 HOXD10BmuPB017774-9.040 78.64×10-8同源异形盒D10 Homeobox D10 ADAMTS1BmuPB015735-8.342 03.54×10-6去整合素金属蛋白酶1ADAM metallopeptidase with thrombospondin type 1 motif 1 NR4A2BmuPB000369-8.249 26.32×10-6细胞核受体第4亚科A组成员2Nuclear receptor subfamily 4 group A member 2 S100A12BmuPB018458-8.200 47.72×10-6钙结合蛋白S100A12S100 calcium binding protein A12 KIAA1257BmuPB019629-8.200 47.72×10-6KIAA1257同源基因 KIAA1257 ortholog SGK1BmuPB007356-8.150 09.48×10-6人丝氨酸/苏氨酸蛋白激酶Sgk1Serine/threonine-protein kinase Sgk1 ZNF333BmuPB010215-8.097 71.17×10-5锌指蛋白333 Zinc finger protein 333 TSPYL1BmuPB020407-7.987 12.25×10-5睾丸特异编码蛋白1Testis-specific Y-encoded protein 1-like RRHBmuPB008986-7.928 42.82×10-5视网膜色素上皮衍生的视紫红质同系物Retinal pigment epithelium-derived rhodopsin homolog
注:logFC倍比表示log大卵泡COCs基因表达量/中卵泡COCs基因表达量。
Note: logFC represents log gene expression of large COCs to medium COCs.
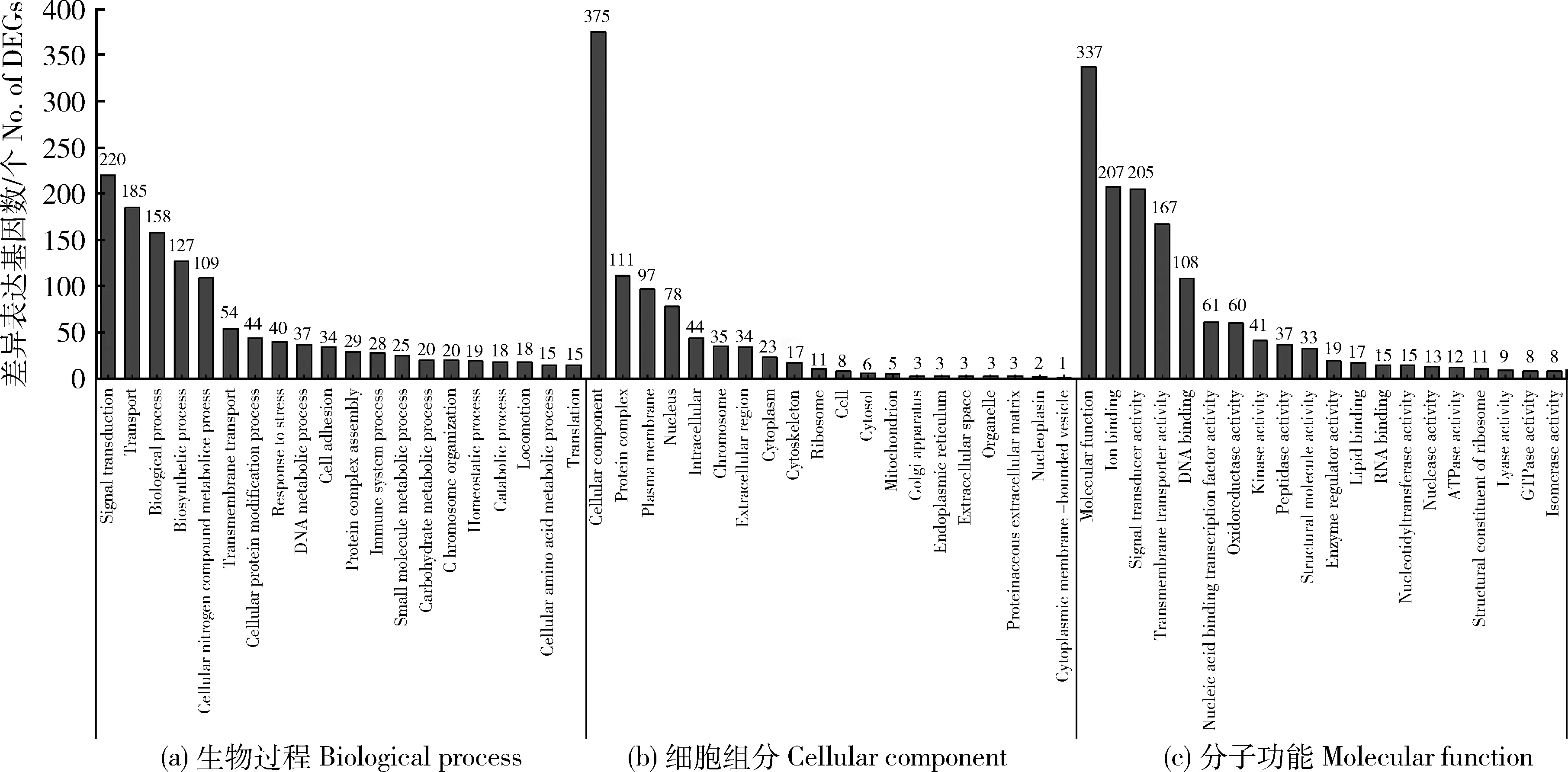
图3 小卵泡与中卵泡卵丘卵母细胞复合体的差异表达基因GO分类注释图Fig.3 Gene ontology classification of DEGs between COCs from small and medium follicles
牦牛中卵泡与大卵泡COCs之间的DEGs注释到114条GO条目上,其中BP 55条、CC 26条和MF 33条。不同发育阶段不仅GO条目上富集的基因数量和二级条目的数量不同,而且二级条目的排列顺序有一定的差异。例如,从小卵泡发育到中卵泡的过程中BP类别中基因富集排列第2和第3的GO条目分别是运输和生物过程,而在中卵泡发育到大卵泡的排列顺序正好相反。在BP类别的前20条GO条目只有第1、4、16、19条在2个发育阶段的排列顺序完全一致;在CC类别的前20条GO条目只有第1、2、9、10条在2个发育阶段的排列顺序完全一致;在MF类别的前20条GO条目只有第1、2、3、4、5、12条在2个发育阶段的排列顺序完全一致(图4)。

图4 中卵泡与大卵泡卵丘卵母细胞复合体的差异表达基因GO分类注释图Fig.4 Gene ontology classification of DEGs between COCs from medium and large follicles
2.5 差异基因KEGG通路分析
牦牛卵泡发育过程中COCs差异表达基因KEGG分析表明,小卵泡与中卵泡COCs的DEGs富集在254条通路,包括:神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction)、细胞因子-细胞因子受体相互作用(Cytokine-cytokine receptor interaction)和细胞粘附分子(Cell adhesion molecules, CAMs)等重要通路。中卵泡与大卵泡COCs的DEGs富集在276条通路,包括:神经活性配体-受体相互作用(Neuroactive ligand-receptor interaction)、钙离子信号通路(Calcium signaling pathway)和cAMP信号通路(cAMP signaling pathway)等重要通路。2个发育阶段P
<0.05且DEGs富集程度最高的前20条通路见图5。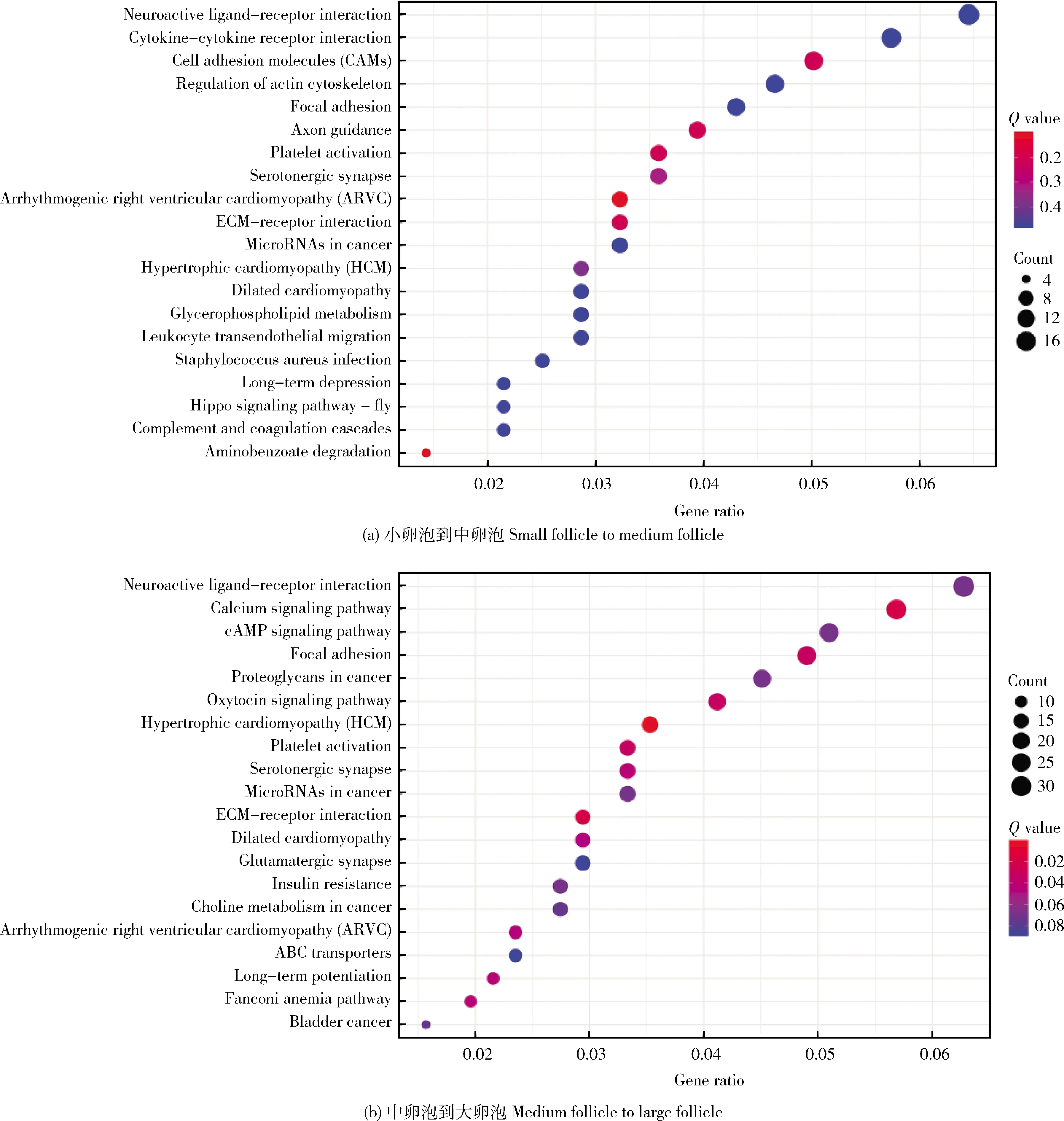
图5 牦牛卵泡发育过程中COCs差异表达基因KEGG富集分析散点图Fig.5 Scatter diagram of KEGG enrichment analysis for DEGs of yak COCs during follicle development
3 讨 论
文库构建和测序质量评估结果显示,本研究文库构建质量和测序质量高,测序数据准确可靠。虽然中卵泡COCs的Clean reads比较低,但在不同组织中的转录组学研究表明,大于 6×10条reads的测序文库就能够检测到组织中大部分表达的基因。因此,认为中卵泡32 905 166条Clean reads的测序深度是足够的,能够客观反映牦牛卵泡发育过程中COCs的基因表达情况。由于本研究用的牦牛COC的RNA量少,不能满足进一步开展q-PCR验证的需求,因此,本研究对测序结果未作进一步的qRT-PCR验证。
本研究通过对基因表达分析,发现小卵泡与中卵泡COCs之间有879个DEGs,其中,435个基因上调,444个基因下调;中卵泡与大卵泡COCs之间有1 560个DEGs,其中,590个基因上调,970个基因下调。2个阶段DEGs中,尤其是中卵泡发育到大卵泡过程中,COCs下调基因数量高于上调基因数量,说明卵巢中COCs的发育能力整体上是逐渐减弱,这与前人关于卵泡发育动态的研究结果一致,即在发情周期的每一个卵泡波中都有几个到几十个卵泡发育,但大多数卵泡在发育的不同阶段闭锁退化,最终只有少数卵泡能发育到最后成熟排卵。相对于未成熟卵母细胞而言,体外成熟的牦牛卵母细胞中下调基因的数量(3 343个)也是高于上调基因(1 418个)的数量,这些研究结果提示,在卵泡发育进程中COCs表达量下调基因数目增加,可能与多数卵泡和卵母细胞发育与成熟能力逐渐减弱、趋向闭锁之间有一定关联性。下丘脑促性腺素释放激素(GnRH)调节脑垂体促卵泡素(FSH)和促黄体素(LH)的合成与释放,FSH和LH对调节有腔卵泡的发育与成熟起至关重要的作用。卵巢的卵泡膜细胞、颗粒细胞、卵丘细胞和卵母细胞中一系列基因和蛋白按特定的时空顺序表达以及卵丘细胞与卵母细胞分泌因子的互作,最终决定卵泡发育的命运是成熟排卵还是在发育的不同阶段闭锁。目前发现的参与形成卵母细胞/颗粒细胞调控环的最重要因子包括GDF-9、BMP-15和KITL等。卵母细胞分泌的GDF-9和BMP-15调节卵丘细胞的分裂和KITL的表达,而卵丘细胞分泌的KITL反过来调节卵母细胞的发育与成熟。但是,本研究发现在牦牛卵泡发育过程中,COCs中差异表达基因排名靠前的不是这些基因,说明这些基因在牦牛卵泡发育的不同阶段可能都发挥重要作用,但不是阶段性特异调控基因。
本研究从基因的差异表达及功能分析发现一些在以前的研究中没有关注到的可能与卵泡发育相关的一些阶段性特异调控基因,例如,S100A9
、SLC25A47
、MEPE
、TUC1/NCS6
、GRM1
、NPB
和HOXD10
等一些在卵泡发育不同阶段差异倍数大的基因。100A9可以提高Bcl
-2的表达,抑制细胞凋亡;SLC25A47是一种跨膜蛋白,能调节糖、氨基酸、核苷酸、无机离子等物质的跨膜转运,维持细胞正常功能;MEPE保护细胞DNA损伤,对细胞具有保护作用。TUC1/NCS6是硫代tRNA细胞库的维持和细胞生长必需的物质;GRM1抑制细胞生长。NPB与卵巢中孕酮和雌二醇的分泌相关;HOXD10抑制细胞增殖、迁移,促进细胞凋亡。因此,这些基因在牦牛不同大小卵泡中表达量的差异可能与牦牛卵泡发育与卵母细胞的成熟有关。本研究采用Illumina平台对COCs进行测序,样本是卵母细胞和卵丘细胞的混合物,虽然结果能反映出牦牛卵泡发育过程中转录组的全局性变化,但获得的数据在一定程度上与卵丘细胞占的比例有关系,因此,为了进一步探明卵母细胞和卵丘细胞在卵泡发育中的分子调控机制,有必要进一步开展卵泡在同一个发育阶段的这两种细胞单独测序分析。在牦牛卵泡发育的2个阶段,DEGs种类和数量不同,GO富集条目和KEGG富集也不同,提示在不同大小的卵泡中收集的COCs的体外成熟(In
vitro
maturation, IVM)要求条件不一样。目前,在牦牛和普通牛的卵母细胞IVM中,从直径2~8 mm大小不等的卵泡中收集的COCs都是在相同的IVM液中共同培养。比利时、丹麦和法国等国的研究表明,在相同体外受精(IVF)系统里,牛小卵泡、中卵泡和大卵泡获得的卵母细胞的卵裂率和囊胚率有显著差异。因此,如果根据卵泡大小的发育特点调整IVM液的成分,对COCs进行分类培养则有望提高牦牛卵母细胞的成熟率和发育能力。本研究KEGG分析发现,DEGs富集程度高的神经活性配体-受体相互作用、细胞因子-细胞因子受体相互作用、细胞粘附分子、钙离子信号等通路是牦牛COCs发育的关键调控通路。在其他物种的研究证明,这些通路在卵泡的发育中发挥重要调控作用。牛属及其他物种卵母细胞发育转录组相关研究表明,MAPK、Wnt及P13K/Akt凋亡通路在卵母细胞成熟中起了关键调控作用。TGF-β信号通路、雌激素信号通路、VEGF信号通路、丙酮酸代谢、ErbB信号通路等都参与卵泡发育调控,本研究发现这些通路在牦牛卵泡发育过程中也发生富集,说明这些通路在牦牛卵泡发育中也发挥重要调控作用。本研究还发现DEGs在血小板活化(Platelet activation)通路富集程度高,与在牦牛卵母细胞IVM液中添加适当浓度的血小板活化因子(PAF)可以提高牦牛卵母细胞成熟率的研究结果相吻合。
4 结 论
本研究运用转录组学系统分析了牦牛不同大小的有腔卵泡发育过程中COC转录组差异,筛选得到小卵泡与中卵泡COCs之间有879个DEGs,中卵泡与大卵泡COCs之间有1 560个DEGs。这些DEGs主要富集在神经活性配体-受体相互作用、细胞因子-细胞因子受体相互作用、细胞黏附分子、钙离子信号通路和cAMP信号通路等重要通路,为揭示牦牛卵泡发育与成熟调控机制及完善牦牛卵母细胞体外成熟技术提供了理论依据。

