异质性万古霉素中介金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌的临床特征及耐药分析
胡远芳 付明霞 李 娜 安新业 王凤霞 王月玲 纪 冰
1 滨州医学院附属医院检验科 山东 滨州 256603;2 滨州市人民医院病理科 山东 滨州 256600;3 山东第一医科大学附属省立医院临床医学检验部 山东 济南 250021
金黄色葡萄球菌,特别是耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)仍然是严重感染的主要原因,并与增加的医疗费用、发病率和死亡率有关[1]。万古霉素一直是治疗MRSA感染的一线药物之一[2]。但是近年来,对万古霉素敏感性降低的金黄色葡萄球菌在各个国家和地区陆续被报道,包括万古霉素中介金黄色葡萄球菌(vancomycin-intermediate S.aureus,VISA)和异质性万古霉素中介金黄色葡萄球菌(heterogeneous vancomycin-intermediate S.aureus,hVISA)。本研究采用回顾性分析方法对263名感染金黄色葡萄球菌患者的临床资料和耐药情况进行分析,以期为临床用药以及预防控制MRSA感染和hVISA感染提供依据。
1 资料与方法
1.1 材料
1.1.1 菌株来源 滨州医学院附属医院检验科2019年6月至2019年12月及2021年7月至2021年8月临床分离的金黄色葡萄球菌 ,剔除同一病人的重复菌株以及临床资料缺失的菌株后共计263株。阴性质控菌株ATCC29213以及甲氧西林敏感株ATCC25923为微生物室所保存,阳性质控hVISA的标准菌株MU3及VISA的标准菌株MU50由戴媛媛老师所赠。甲氧西林耐药株ATCC43300由国家卫生健康委临床检验中心提供。
1.1.2 主要试剂与仪器 万古霉素购自上海麦克林生化科技有限公司,脑心浸液琼脂购自百盈利创生物科技(北京)有限公司,胰蛋白胨大豆肉汤(TSB)购自广州市左克生物科技发展有限公司。药敏纸片购自英国Oxoid公司。VITEK-2 Compact全自动细菌鉴定和药敏分析仪购自法国生物梅里埃公司。
1.2 方法 采用回顾性分析方法,从实验室信息系统(laboratory information system,LIS)提取确认为金黄色葡萄球菌感染的263例患者的相关临床资料,对其临床特征以及常用抗菌药物耐药情况进行调查分析。
1.2.1 细菌鉴定及药敏 金黄色葡萄球菌的分离鉴定严格按《全国临床检验操作规程》(第4 版)进行。采用Matrix-Assisted Laser Desorption Ionization Time-of-Flight Mass Spectrometry对细菌进行鉴定。采用Kirby-Bauer纸片扩散法、VITEK-2 Compact全自动细菌鉴定和药敏分析仪对细菌进行药敏分析。操作方法和结果判断依据美国临床实验室标准化协会( Clinical and Laboratory Stand-ards Institute,CLSI) 当年的标准。MRSA菌株的鉴定根据CLSI规则进行。
1.2.2 hVISA的筛选及确认 用万古霉素脑心浸液琼脂平皿(BHIA2V、BHIA3V和BHIA4V)对263株金黄色葡萄球菌进行筛选,48 h后平皿上有≥1个菌落即为筛选阳性。以ATCC29213为阴性对照,Mu3为hVISA阳性对照,Mu50为VISA阳性对照。对BHIA2V、BHIA3V和BHIA4V上筛选阳性的菌株进行菌群分析-曲线下面积法PAP/AUC确认,目前认为(AUC待测菌株/AUCMu3)<0.9应为万古霉素敏感的金黄色葡萄球菌(VSSA);≥1.3应为VISA;0.9~1.3为hVISA。
1.2.3 统计学方法 采用SPSS 24.0进行统计分析,组间差异采用χ2检验和Fisher′s精确检验,P<0.05为差异有统计学意义。
2 结果
2.1 hVISA和MRSA检出结果 263株金黄色葡萄球菌中共检出22株hVISA和60株MRSA,检出率分别为8.4%和22.8%。
2.2 临床特征 不同性别、年龄和科室,MRSA组与MSSA组差异无统计学意义(P>0.05),hVISA组与VSSA组差异无统计学意义(P>0.05)。不同来源的菌株,MRSA组与MSSA组差异有统计学意义(P<0.05),hVISA组与VSSA组差异有统计学意义(P<0.05)。263例金黄色葡萄球菌感染患者的临床资料见表1。
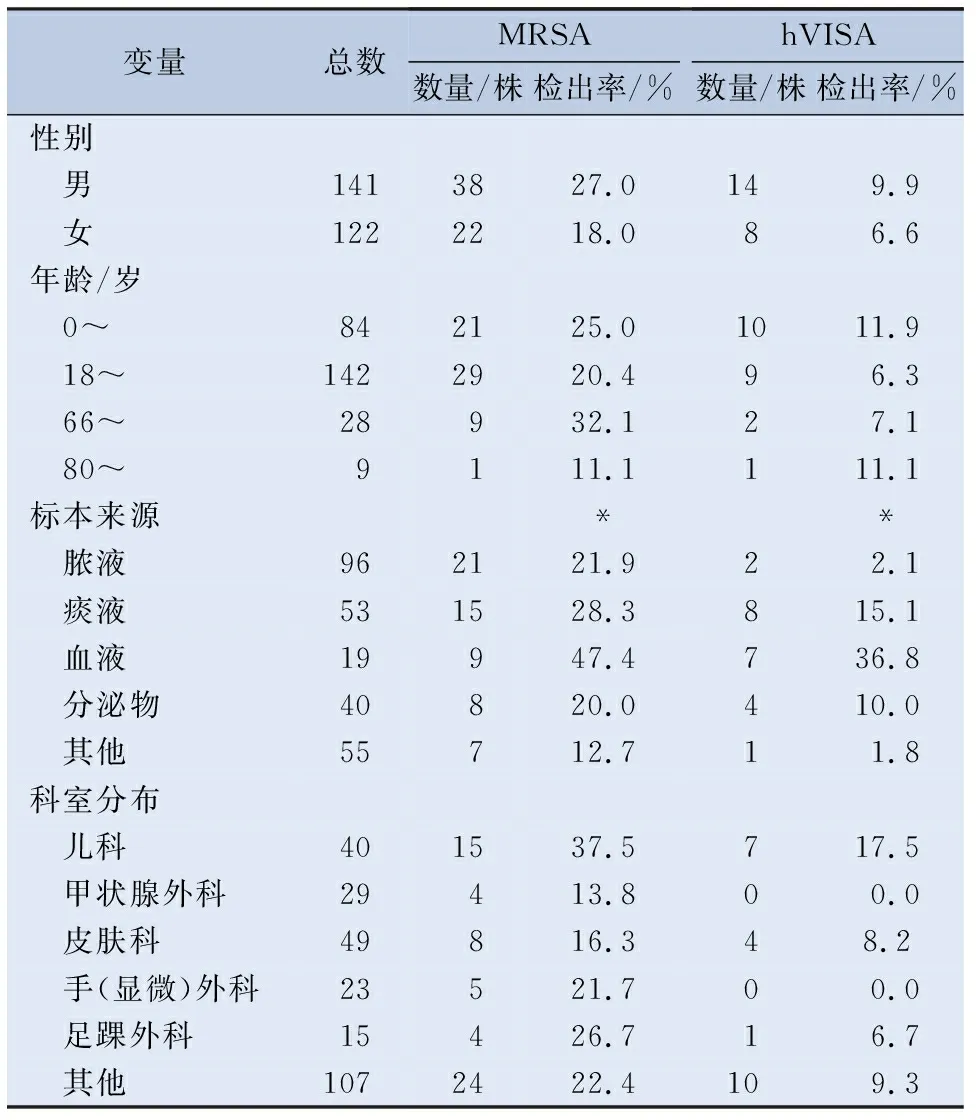
表1 263例金黄色葡萄球菌感染患者的临床资料
2.3 耐药情况 将263株金黄色葡萄球菌分为VSSA组和hVISA组,以及MRSA组和MSSA组。VSSA组与hVISA组对常用抗菌药物的耐药情况见表2。MRSA组与MSSA组对常用抗菌药物的耐药情况见表3。hVISA组和MRSA组对常用抗菌药物的耐药情况见表4。
3 讨论
耐甲氧西林金黄色葡萄球菌(MRSA)是人类最常见的耐药病原菌[3],近年来,耐甲氧西林和其它抗生素菌株的出现已经成为世界范围内的一个主要问题,特别是在医院环境中,由于系统性MRSA感染,死亡率更高[4]。万古霉素作为治疗MRSA感染的首选药物[5],一直在临床上广泛使用。近年来,关于hVISA的报道越来越多,它是一种对万古霉素具有隐性耐药性的新型超级细菌[6]。许多研究报道,宿主免疫系统很难根除hVISA,从而导致慢性、反复和持续性感染[7]。
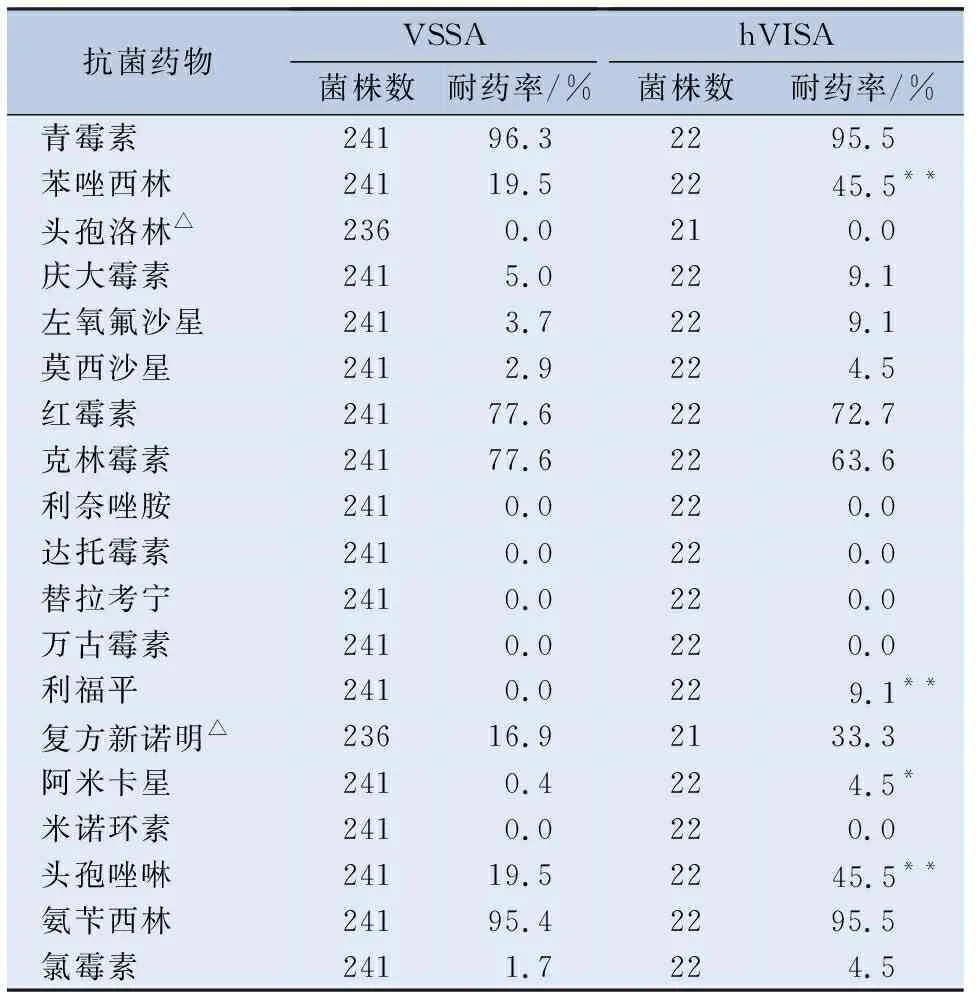
表2 VSSA组与hVISA组对常用抗菌药物的耐药情况

表3 MRSA组与MSSA组对常用抗菌药物的耐药情况
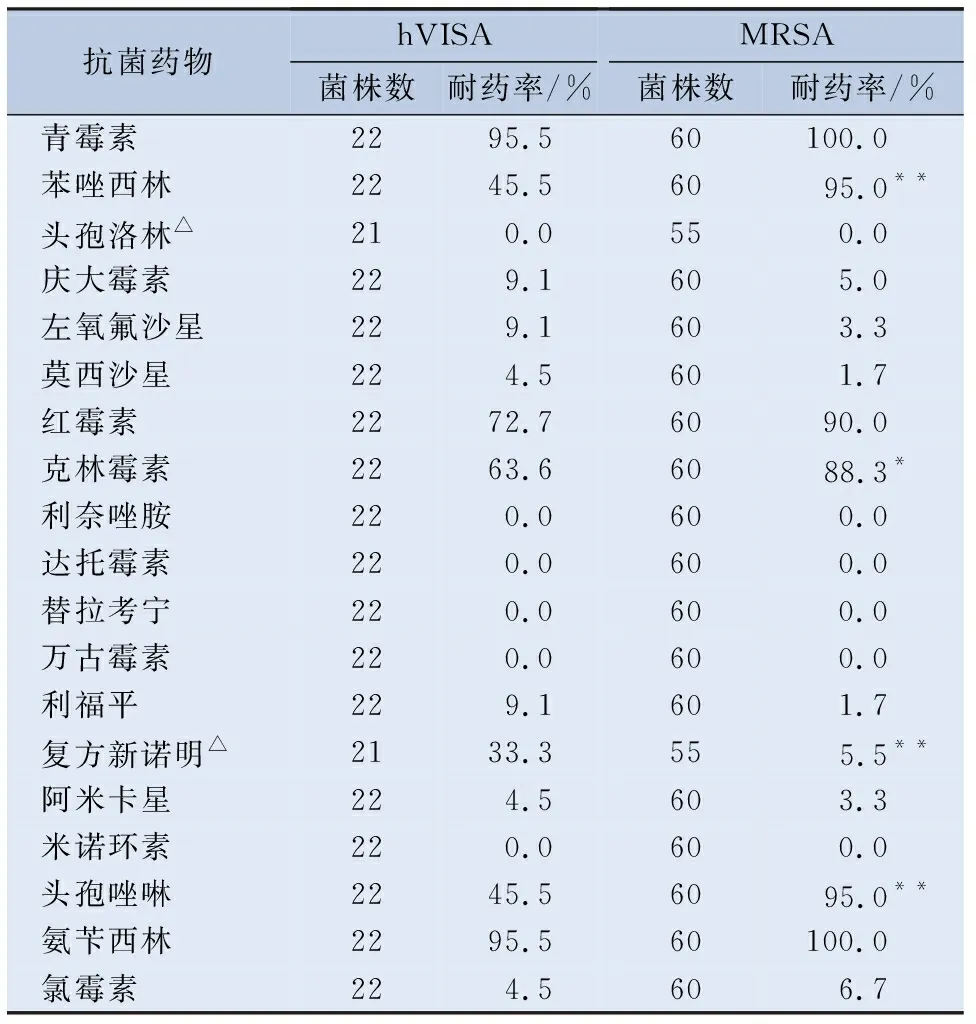
表4 hVISA组和MRSA组对常用抗菌药物的耐药情况
本研究结果显示263株金黄色葡萄球菌中MRSA共60株,检出率为22.8%。低于2019年全国细菌耐药监测报告报道的30.2%的MRSA平均检出率[8],可能是由于地域差异、标本量较少以及近年来MRSA的检出呈下降趋势。2019年全国细菌耐药监测报告显示,MRSA的检出率近年来呈缓慢下降的趋势,从2014年的36.0%下降至2019年的30.2%[8]。此外,Hu等的报道显示MRSA的检出率从2005年的69.0%下降到了2017年的35.3%[9]。尽管已有研究显示MRSA的检出率呈下降趋势,但其仍然是临床常见的多重耐药菌[10],临床仍然需要对其足够重视。本研究发现MRSA组和hVISA组在不同性别、不同年龄段和不同科室中的检出率差异均无统计学意义(P>0.05),在不同来源标本中的检出率差异有统计学意义(P<0.05),且检出率最高的均为血液标本,其次是痰液标本。这与武杰等[10]报道的MRSA检出率最高的是痰液不一致,这可能与临床使用β-内酰胺类抗菌药物有关。此外,血液标本中hVISA检出率高可能也与糖肽类抗菌药物的使用有关。
药敏结果显示MRSA组对青霉素、苯唑西林、红霉素、克林霉素、头孢唑林和氨苄西林耐药率极高,均大于85%。而且,MRSA组对苯唑西林、红霉素、克林霉素、头孢唑林和氯霉素的耐药率均高于MSSA组(P<0.05),但对复方新诺明的耐药率低于MSSA组(P<0.05)。该结果表明MRSA具有多重耐药性,临床在治疗MRSA感染时,必要情况下可以选择与复方新诺明联合用药[11]。
另外,本院263株金黄色葡萄球菌共检出22株hVISA,检出率为8.4%。低于赵罗乐等[12]报道的2012—2015年重庆医科大学附属第一医院18.1%的hVISA检出率以及刘彩林等[13]报道的2013—2017年郑州大学第一附属医院17.9%的hVISA检出率。可能与地区、检测方法以及临床用药等有关。药敏结果显示hVISA组与VSSA组对头孢洛林、利奈唑胺、达托霉素、替拉考宁、万古霉素以及米诺环素均敏感,hVISA组对苯唑西林、利福平、阿米卡星和头孢唑林的耐药率均高于VSSA组(P<0.05)。虽然该结果显示hVISA对万古霉素敏感,但临床治疗hVISA感染时应慎用万古霉素,因为hVISA的出现主要是由于万古霉素等糖肽类药物的选择性压力[13],且hVISA可能会在万古霉素的选择性压力下发展为VISA[14],从而导致万古霉素治疗失败。
此外,hVISA组与MRSA组的药敏结果显示hVISA与MRSA均对头孢洛林、利奈唑胺、达托霉素、替拉考宁、万古霉素以及米诺环素全敏感,且hVISA组对苯唑西林、克林霉素和头孢唑林的耐药率低于MRSA组,但对复方新诺明的耐药率高于MRSA组,差异有统计学意义(P<0.05)。该结果表明临床可以使用头孢洛林、利奈唑胺、达托霉素、替拉考宁、万古霉素以及米诺环素治疗hVISA感染与MRSA感染,虽然静脉注射万古霉素是治疗MRSA感染的首选[15],但可能会导致hVISA的出现,且应用万古霉素治疗hVISA感染很可能会导致万古霉素治疗失败,因此临床还是应该慎用万古霉素。
总之,本院MRSA与hVISA的检出率均不高,但还是应该继续加强细菌耐药监测以及临床用药管理,杜绝出现抗菌药物滥用的情况。目前MRSA和hVISA对头孢洛林、利奈唑胺、达托霉素、替拉考宁、万古霉素以及米诺环素均敏感,因此临床在治疗MRSA引起的感染时可以优先考虑这些抗菌药物,但还需要参考药敏结果,结合患者自身实际情况进行用药。

