CD11b+/CD66b+肿瘤相关中性粒细胞在胃癌中的表达及临床意义
谭 颖 张 超 魏梦娜 李 贺
1 滨州医学院药学院 山东 烟台 264003;2 滨州医学院烟台附属医院胃肠外科 山东 烟台 264100
胃癌(gastric cancer,GC)是世界上最常见的恶性肿瘤之一,其死亡率居恶性肿瘤的第三位[1],全球每年有近70万人死于GC。免疫细胞浸润与肿瘤的发展密切相关。中性粒细胞是从骨髓造血干细胞发育而来的一种具有活跃的变形运动和吞噬功能的白细胞,占白细胞总数的50%~70%,保护机体抵御病原微生物的入侵,并在非特异性细胞免疫中发挥重要作用。肿瘤相关中性粒细胞(tumorassociated neutrophils,TANs)是浸润到肿瘤微环境中的中性粒细胞,是炎症微环境的主要组成部分。TANs是肿瘤发生发展的关键细胞[2-3],其与癌症的侵袭、发展及预后高度相关。TANs已经在多种类型的人类肿瘤中被发现,包括头颈部鳞状细胞癌、结直肠癌和肾细胞癌[4-7]。TANs在乳腺癌和肾癌中的浸润可以减少肺转移的发生,其机制为乳腺癌细胞中的TANs释放CCL2,后者促进活性氧(reactive oxygen species,ROS)的分泌,产生细胞毒性作用,而肾癌细胞则是通过产生IL-8聚集TANs抑制肿瘤的进展转移[8]。TANs在肝癌细胞系中通过分泌BMP2和TGF-β上调肝癌细胞中miR-301-3p的表达来增加其干细胞特性[9]。TANs被认为是肿瘤治疗的真正靶点[10],而其在GC中的存在和意义尚不清楚。
TANs的胞质和胞膜上均有CD66b表达。作为TANs的生物学标志,CD66b的阳性与否反映了肿瘤实质中TANs的浸润情况。而CD11b则是髓系细胞成熟的重要标志物,CD11b+的肿瘤浸润抗原递呈细胞与GC相关[11-12]。本研究拟检测CD11b+/CD66b+TANs亚群在GC中的表达情况,揭示CD11b+的TANs与GC患者年龄、性别、组织学分级、淋巴结转移、Laruen分型、肿瘤大小、浸润深度等临床病理参数的关系。
1 材料与方法
1.1 实验材料 GC标本组织芯片(IWLT-N-114G71)购自上海芯超生物科技有限公司GC组织芯片库,包含GC38例114点,每例取3点(胃癌1点,正常胃组织1点,转移灶1点)。组织芯片的每个点都经过病理诊断,手术时间为 2015年1月至2015年7月。兔抗人CD11b单克隆抗体(Abcam,ab52478,1∶500),兔抗人CD66b多克隆抗体(Abcam,ab197678,1∶500),抗鼠/兔通用型免疫组化检测试剂盒(基因科技,GK500705,1:150),DAB显色试剂盒(北京中杉金桥公司)。
1.2 免疫组化方法 将GC组织芯片在58℃烤片2 h,脱蜡、水化、抗原修复(PBS 洗涤 3 次后滴加3%过氧化氢,胎牛血清封闭30 min)。组织芯片与一抗CD11b、CD66b(1∶500)孵育,4℃过夜,然后与二抗(1∶150)孵育室温1 h,水洗后用DAB显色剂显色,苏木精复染,梯度乙醇脱水,中性树胶封片,在光学显微镜下观察和拍照。通过染色强度和阳性细胞率定量分析GC组织、正常胃组织以及转移灶组织中CD11b+/CD66b+TANs的浸润情况。染色强度为:0为阴性,1为弱阳性,2为阳性,3为强阳性。阳性细胞率为:0~5%为0分,5%~25%为1分,25%~50%为2分,51%~75%为3分,75%~100%为4分。免疫组织化学评分=染色强度×阳性细胞率。本研究将评分<3分归入低表达组,评分≥3分归入高表达组。CD11b、CD66b评分均≥3分判定为CD11b+/CD66b+TANs。
1.4 统计学方法 采用SPSS 22.0统计软件进行分析处理。定性资料采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 CD11b+/CD66b+TANs在GC组织中的浸润程度 免疫组化显示,CD11b和CD66b主要表达于细胞质(图1)。图1是随机选取在GC组织及正常胃组织芯片中的CD11b+/CD66b+TANs的表达情况。38例GC组织芯片中,63.2%(24/38)的GC组织中CD11b和CD66b呈高表达,而23.7%(9/38)的邻近正常胃组织中CD11b和CD66b呈高表达,两者比较,P<0.001(表1)。
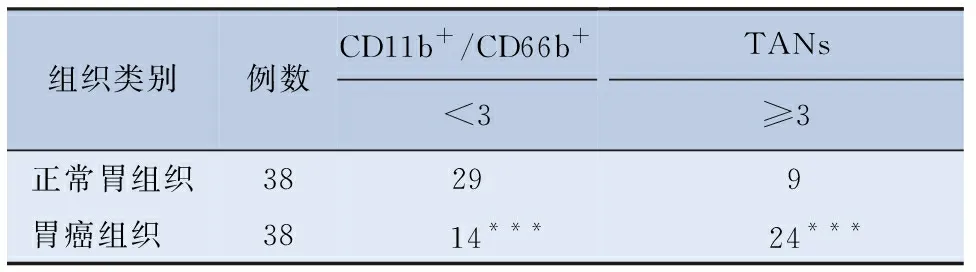
表1 CD11b+/CD66b+TANs在组织芯片中的表达情况
2.2 CD11b+/CD66b+TANs在GC原发灶及转移灶中的分布情况免疫组化结果显示,入组患者中GC组织、转移癌组织中TANs的CD11b、CD66b的蛋白表达明显高于正常胃组织(图2)。这提示,CD11b+/CD66b+TANs在GC原发灶及转移灶中广泛浸润。
2.3 CD11b+/CD66b+TANs表达与GC临床病理参数之间的相关性比较 两组间临床资料的特点,不同性别、Lauren分级的患者与GC组织中 CD11b+/CD66b+TANs表达量,差异无统计学意义。CD11b+/CD66b+TANs随GC患者的年龄(P=0.008)、组织学分级(P=0.028)、肿瘤大小(P=0.001)的上升表达量增加。CD11b+/CD66b+TANs表达水平增加的GC患者淋巴结转移(P=0.009)的风险增高(表2)。
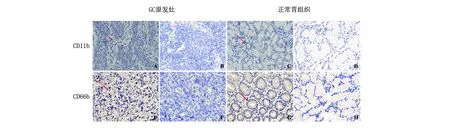
A. CD11b+细胞在GC中呈高表达(Scores≥3);B. CD11b+细胞在GC中呈低表达(Scores<3);C. CD11b+细胞在正常胃组织中呈高表达(Scores≥3);D. CD11b+细胞在正常胃组织中呈低表达(Scores<3);E. CD66b+细胞在GC中呈高表达(Scores≥3);F. CD66b+细胞在GC中呈低表达(Scores<3);G. CD66b+细胞在正常胃组织中呈高表达(Scores≥3);H. CD66b+细胞在正常胃组织中呈低表达(Scores<3)。
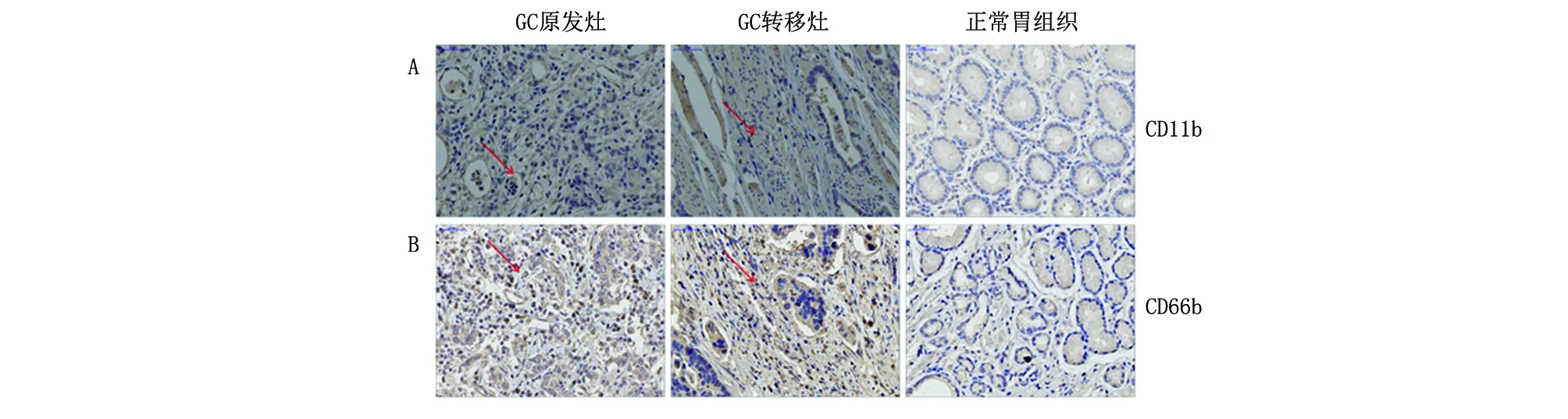
A. 免疫组化结果显示GC组织以及转移组织中的CD11b的蛋白表达情况明显高于其癌旁正常组织中的表达;B. 免疫组化结果显示GC组织以及转移组织中的CD66b的蛋白表达情况明显高于其癌旁正常组织中的表达。
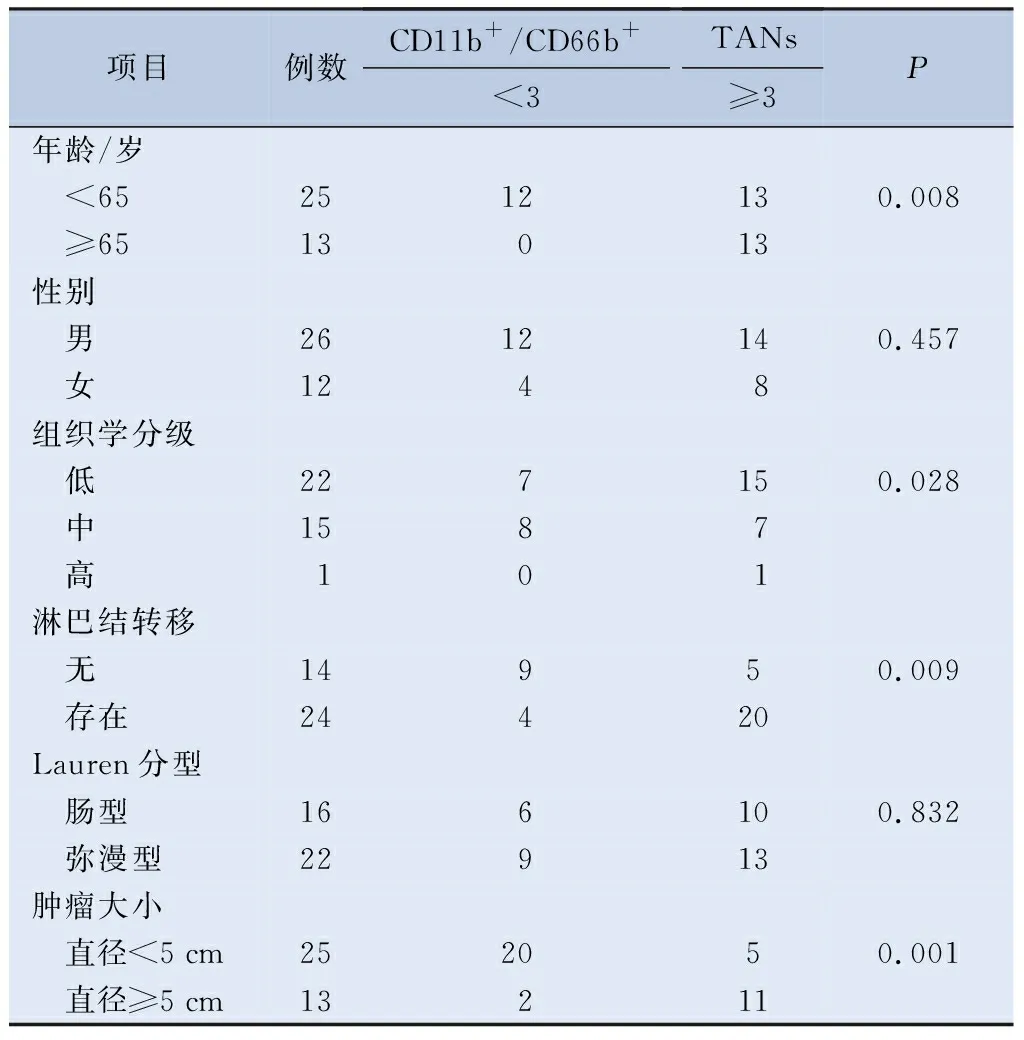
表2 CD11b+/CD66b+TANs表达与临床病理参数之间的相关性(n=38)
3 讨论
GC是消化系统最常见的恶性肿瘤之一。近年来,随着人们生活方式和饮食习惯的改变,GC的发病率逐年上升,给家庭和社会带来了沉重的负担。GC发病隐匿,侵袭性较强,大部分患者就诊时已出现淋巴转移或远处转移[12]。目前针对GC的治疗方式主要以手术或放疗/化疗为主,在术后易复发且5年生存率较低。随着分子生物学研究的进展,肿瘤的分子靶向治疗已成为肿瘤研究领域的热点。近年来越来越多的研究认为GC的免疫治疗是一个新的突破口,例如,在GC组织中呈高表达的PD-L1已经成为GC免疫治疗较为成熟的生物标志物[13]。
髓系细胞广泛参与了肿瘤及其转移灶的形成和进展。CD11b在髓系细胞中呈高表达,参与调节造血和髓系细胞形成过程[14],随着造血细胞的分化,其表达逐渐增加[15]。大量CD11b+髓系细胞的浸润使肿瘤的生长受到明显抑制,一些转移灶体积缩小甚至消失[16-17]。CD11b+肿瘤浸润抗原递呈细胞的浸润程度与肿瘤体积、静脉浸润程度、淋巴结转移、肿瘤分期显著相关。CD11b+肿瘤浸润抗原递呈细胞浸润程度高的患者比浸润程度低的患者手术效果差,提示CD11b+细胞浸润是GC的独立预后因素之一[18]。CD11b/CD18促进miR-let7a依赖的促炎性巨噬细胞转录,从而调控巨噬细胞极化,调节新生血管形成,促进小鼠和人类癌症模型中的抗肿瘤免疫反应[19-20]。
目前关于肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)与GC大小、分化程度、浸润深度、淋巴结转移和TNM分期的相关性已经被研究证实,但是对于TANs的研究仍然较少。TANs可被活化成具有抗肿瘤效应的N1型和具有促肿瘤效应的N2型。干扰素-β可以促进中性粒细胞极化为N1型,转化生长因子-β可诱导TANs向N2型极化[21]。N1型TANs可通过增加肿瘤微环境中的ROS及肿瘤坏死因子杀伤肿瘤,而N2型TANs则可以通过集落刺激因子,趋化因子、机制降解酶等促进肿瘤的生长。目前,N1型和N2型TANs的分类和标志物尚不清楚。
CD66b仅在中性粒细胞中表达,其作为目前临床公认的TANs标志物可以用来监测肿瘤实质中的TANs数量。Yamashita等[22]研究表明,CD66b的表达在浸润性乳腺癌扩散组中明显高于无扩散组,并且侵袭性亚组的生存率更低。Zhi等[23]研究表明,CD66b表达的升高与GC的肿瘤侵袭性特征相关。但也有研究表明,TANs可被GM-CSF和IFN-γ活化,增强T细胞的抗肿瘤作用[23]。因此,TANs在肿瘤中的分布和作用尚存在争议。而关于CD11b和CD66阳性的TANs亚群在GC中的作用未见于报道。
本研究观察了GC组织芯片中CD11b+/CD66b+TANs的浸润情况,发现CD11b+/CD66b+TANs在GC原发灶及转移灶中广泛浸润,与GC患者的年龄、组织学分级、肿瘤大小呈正相关,CD11b+/CD66b+TANs表达水平较高患者淋巴结转移的风险增高,推测该类细胞亚群可能属于N2型肿瘤相关中性粒细胞,参与促进GC的发生和转移。
综上所述,GC中存在大量的中性粒细胞浸润情况,并与肿瘤的转移相关。CD11b+/CD66b+细胞的浸润情况有望成为预测GC转移和复发的潜在指标。关于CD11b+/CD66b+TANs通过何种机制作用于肿瘤细胞将是后续的研究重点。

