ATP5A1在结肠癌中的表达及临床意义
孙思骏 贾景丹 李 欣 骆 徐 杨以正 姜文国
1 滨州医学院药学院 山东 烟台 264003; 2滨州市人民医院 山东 滨州 256600
结肠癌的发病率在常见恶性肿瘤中排名第三位,结肠癌也是第五大常见肿瘤死亡原因。结肠癌的发病率增长迅速,5年生存率较低[1]。在确诊为结肠癌时,超过20%的患者已发生转移。因此,结肠癌的早期诊断和精准靶向治疗十分重要。
正常细胞和肿瘤细胞内的线粒体参与了能量生成、细胞增殖、凋亡等很多复杂的生理过程。线粒体功能障碍与多种恶性肿瘤的发病密切相关[2]。线粒体ATP合酶由F0和F1组成,在细胞能量转变过程中发挥重要作用。F1与催化活性有关,执行ADP-ATP催化功能。F1包括α3、β3、γ、δ、ε亚基。ATP5A1和ATP5B分别是指α亚基和β亚基。
目前研究较多的是ATP5B。ATP5B在肺腺癌、前列腺癌等肿瘤细胞中高表达,并促进肿瘤血管生成[3],而关于ATP5A1的研究相对较少。ATP5A1与糖尿病、心血管疾病、衰老、阿尔兹海默病、自闭症以及肿瘤等疾病均有一定的相关性[4]。ATP5A1在肿瘤细胞和组织中的表达水平和它的临床意义存在一些矛盾的结果。大多数结直肠癌细胞具有染色体不稳定性,ATP5A1的表达降低预示着不良的临床结果[5]。因此,有必要进一步阐明ATP5A1的表达水平改变对结肠癌的诊断和治疗的意义。
本研究采用组织芯片探讨ATP5A1表达与结肠癌患者临床指标的相关性,揭示ATP5A1在结肠癌发生发展中的作用及其与预后的关系。本研究在细胞水平对ATP5A1的表达进行干预,研究细胞功能变化,阐明ATP5A1表达变化、功能变化所影响的信号网络,探讨干预ATP5A1表达对结肠癌靶向治疗的意义。
1 材料与方法
1.1 实验材料 人结肠癌组织芯片(批号为HColA180Su14)购自于上海芯超生物科技有限公司的产品,包括结肠腺癌90例,癌/癌旁各1点,手术时间为2009年1月至2009年10月,随访时间为5.7~6.5年。结肠癌细胞系SW480及采用逆转录病毒稳定转染建立的ATP5A1高表达细胞系SA11由本实验室长期保存,10%胎牛血清的DMEM/F12培养基传代培养。ATP5A1抗体(产品号为ab176569)购自abcam公司。通用型超敏型二步法免疫组化检测试剂盒(PV9000)、浓缩型DAB显色试剂盒(ZLI-9018)均为北京中杉金桥公司产品。CCK-8试剂盒购自北京Solarbio公司。2-Thenoyltrifluoroacetone(TTFA,货号为M6210)购自AbMole生物技术公司,Oligomycin A(产品号为579-13-5)购自MCE公司。
1.2 免疫组化及结果判读 将组织芯片在60℃烤箱中烘烤2 h,脱蜡,水化,抗原热修复,封闭,冲洗后加入ATP5A1抗体(1∶650稀释)孵育过夜,然后采用中杉金桥公司两步法免疫组化试剂盒进行检测,DAB显色试剂盒显色,苏木素复染,梯度乙醇脱水,二甲苯透明,中性树胶封片。在光镜下,阳性细胞显示为棕褐色,显微镜低倍镜下照相保存结果。分别判读癌组织和癌旁组织中ATP5A1的胞浆染色的染色强度和染色阳性率。染色强度评分为0分(阴性),1分(1+),2分(2+),3分(3+)。染色阳性率评分为0分(阴性),1分(1%~25%),2分(26%~50%),3分(51%~75%),4分(76%~100%)。以“染色强度评分”和“染色阳性率评分”的乘积为总评分进行分组,≤6分为抗体低表达组,>6分为抗体高表达组。
1.3 生存期分析 对ATP5A1蛋白表达高低和组织芯片患者随访生存时间进行生存期分析。从The Cancer Genome Atlas (TCGA; https://cancergenome.nih.gov/)数据库中搜索结肠癌患者数据,并下载文件,使用TCGA数据库中341例结肠癌分析ATP5A1基因表达水平和患者生存时间的相关性。
1.4 ATP5A1差异表达的细胞蛋白质组学分析 收集细胞,RIPA裂解液裂解细胞,BCA法蛋白定量后采用胶内酶解方法进行蛋白样品酶解。酶解后的肽段进行LC-MS分析。LC-MS系统包括EASY-nLC 1200的液相色谱系统和Q Exactive Orbitrap质谱系统。所得质谱数据采用MaxQuant 1.6.12.0在UniProtKB数据库中进行蛋白质检索鉴定。通过肽段质谱峰面积获得对应蛋白相对表达量数据。通过组间比较获得差异蛋白,并进行KEGG通路富集分析。
1.5 CCK-8细胞增殖分析 将指数生长期的SW480细胞和SA11细胞悬液200 μL接种到96孔培养板中。当细胞附着后,将不同浓度的氧化呼吸链复合物II抑制剂TTFA(0、0.1、1 mM)和ATP合酶抑制剂oligomycin A(0、0.1、1 μM)以换液的方式加入96孔板,每孔加入200 μL并设置空白对照组,培养48 h。每孔加入110 μL CCK-8试剂混合液(含CCK-8试剂10 μL),培养2 h,酶标仪在波长450 nm下测OD值。

2 结果
2.1 ATP5A1在结肠癌组织的表达 因9例结肠癌和癌旁组织(7例癌旁、2例结肠癌)脱片,本研究对组织芯片中可配对的81对结肠癌和癌旁组织分析发现,与相应癌旁组织比较,ATP5A1在结肠癌组织中的表达显著增高(表1)。图1展示的是正常癌旁组织和结肠癌组织ATP5A1免疫组化染色代表性图片,可以看到在结肠癌组织染色较深,表明ATP5A1在结肠癌组织表达增高,在正常组织表达较低。

表1 ATP5A1在结肠癌和相应癌旁组织的表达情况

图1 结肠癌及癌旁组织中ATP5A1的免疫组化染色图片(40×)
结肠癌组中有2例脱片,在未脱片的88例结肠癌组织中,高表达者54例,低表达者34例。分析对应的临床资料表明,ATP5A1低表达患者多属于TNM分期中的 III/IV期,出现淋巴转移较多,并且ATP5A1低表达患者属于分化较差的高度恶性肿瘤,但ATP5A1表达高低与年龄、性别等因素无关(表2)。

表2 结肠癌中ATP5A1的表达与临床资料之间的相关性
2.2 结肠癌ATP5A1的表达与临床预后之间的关系 本研究将组织芯片中88例结肠癌患者生存时间按照ATP5A1表达高低分组发现,结肠癌患者的ATP5A1高表达预示着较长时间的生存期(图2a)。本研究采用TCGA数据库对341例结肠癌组织中ATP5A1基因表达高低和生存时间分别进行统计学分析。341例结肠癌患者中,高表达者163例,低表达者178例。本研究显示,ATP5A1基因高表达结肠癌患者同样表现出较长生存时间,与组织芯片实验结果的趋势一致(图2b)。这也与患者临床资料中TNM分期、转移情况、分级情况等相关参数相对应。

a. 生存期组织芯片分析;b. TCGA数据库分析。
2.3 ATP5A1表达差异影响的信号网络 本研究应用高分辨质谱对SW480细胞系和SA11细胞系进行蛋白质组学分析,发现表达1 337种蛋白,其中差异蛋白327种,高表达蛋白202种,低表达蛋白125种(图3a)。对327种差异蛋白进行KEGG通路富集分析发现,ATP5A1所在的氧化磷酸化功能相关的信号通路蛋白表达具有显著性差异(图3b)。参与氧化磷酸化功能相关的差异蛋白相对表达量见图3c。随着ATP5A1表达增加,参与氧化磷酸化的各复合物都有不同程度的表达上调,尤以琥珀酸氧化呼吸链复合物II中的琥珀酸脱氢酶复合体B亚基(succinate dehydrogenase B,SDHB)表达增高最为显著。

a. 火山图分析差异蛋白;b. KEGG分析;c. 氧化磷酸化信号通路蛋白相对表达量。
2.4 SDHB与ATP5A1在结肠癌细胞增殖中的协同作用 本研究采用氧化呼吸链复合物II抑制剂TTFA和ATP合酶抑制剂 oligomycin A分别研究其对SW480细胞系和高表达ATP5A1的SA11细胞株增殖能力的影响。与不加抑制剂比较,低表达ATP5A1和SDHB的细胞系中TTFA和oligomycin A均在更大程度上抑制细胞增殖(图4a、4b)。这表明,高表达的ATP5A1使得结肠癌细胞获得了对两种不同机制抑制剂的抵抗力。
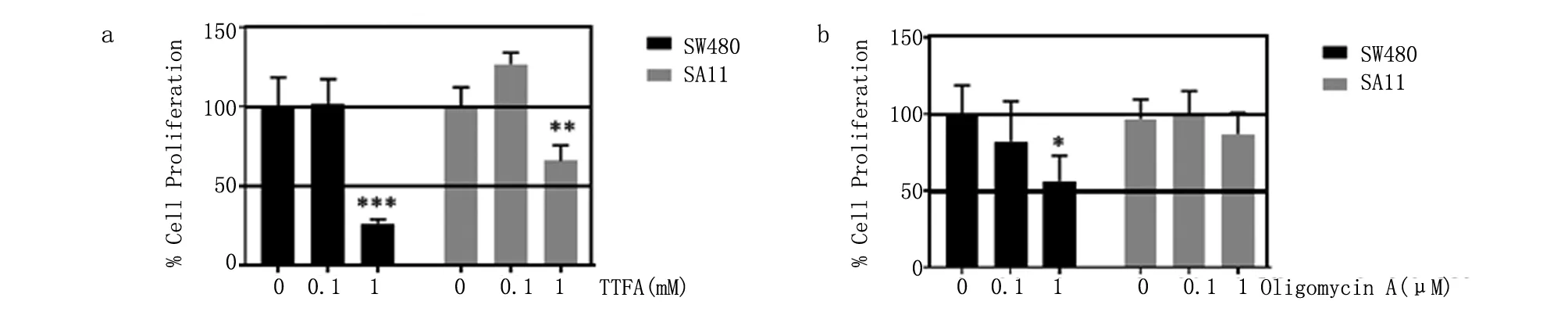
a. TTFA;b. oligomycin A。与不加抑制剂相比较,*P<0.05,**P<0.01,***P<0.001。
3 讨论
恶性肿瘤具有独特的生物能量现象,主要表现为糖酵解增加及线粒体功能降低,主要体现在线粒体ATP合成酶的表达降低和糖酵解酶的表达增加。ATP5A1是ATP合成酶的主要组分之一,其在不同肿瘤细胞和组织表达变化和功能不一致。在前列腺癌中抑制ATP5A1的表达对肿瘤的治疗有益,低表达的患者存活时间较长[6],而在结直肠癌中,低表达ATP5A1代表肿瘤耐药和预后较差[7]。
大多数结直肠癌组织具有染色体不稳定性,ATP5A1的表达降低预示着不良的临床后果[5]。在耐药的结肠癌细胞中,包括ATP5A1亚基在内的ATP合酶表达下降,这提示肿瘤对化疗药物耐药与ATP5A1低表达有关[7-8]。谢春英等[9]研究发现,ATP5A1在大肠癌表达水平显著低于癌旁组织,而王锐等[10]研究发现,ATP5A1在大肠癌表达增高,并且ATP5A1的高表达与低分化及淋巴转移相关。但以上研究并未区分结肠癌和直肠癌。本研究专一研究结肠癌样本,发现结肠癌组织中ATP5A1表达增高显著,ATP5A1表达高低与年龄、性别等因素无关,ATP5A1低表达患者多属于TNM III/IV期,并容易出现淋巴转移,属于分化较差的高度恶性肿瘤。本研究采用了带有生存期资料的组织芯片,结合生存期分析发现ATP5A1高表达患者预示着较长时间的生存期,采用TCGA数据库分析了更多样本,获得了与组织芯片一致的实验结果。该结果进一步明确了ATP5A1在结肠癌的表达水平变化和相关临床参数间的相关性。
SETH R等[8]检测了16种不同结直肠癌细胞系ATP5A1的表达水平,发现不同细胞系之间表达差异较大,其中SW480最低、CaCo2表达最高,差别达到近10倍。本研究选择SW480细胞系,利用慢病毒过表达构建ATP5A1高表达细胞株SA11,采用高分辨质谱发现了差异蛋白327种,发现随着ATP5A1蛋白组分表达增加,ATP5A1蛋白所在的线粒体氧化磷酸化功能相关的信号通路蛋白表达均有显著增加,尤以复合物II中的SDHB表达增高最明显,此种现象被称为线粒体重塑。线粒体重塑使细胞适应生长发育中缺氧等环境的各种变化和挑战[11]。
线粒体是相对独立的细胞器,在细胞代谢和程序性细胞死亡途径中发挥重要的作用。线粒体基因、结构和功能的改变与肿瘤的发生相关。线粒体的一些改变会有利于细胞的生长,决定了它们能否在细胞内外改变中存活。在肿瘤细胞线粒体存在的一些特异性改变使得它有可能成为肿瘤治疗的靶点。本研究发现,在肿瘤细胞中ATP5A1一种蛋白表达增加,会导致多种线粒体蛋白同时表达增加。这说明了氧化磷酸化呼吸链的不同组分间存在协同变化现象,一种组分的改变会诱导氧化呼吸链其他组分的表达和功能的同步变化,出现线粒体重塑现象。
XIAO等[12]研究发现,线粒体复合物II中的SDHB下调有利于结直肠癌的增殖和迁移,促进糖酵解。SDHB在结直肠癌组织低表达,与肿瘤分级密切相关,分化越差,表达越低[13]。ATP5A1诱导所致的SDHB表达增高,意味着结肠癌细胞中琥珀酸呼吸链功能增强。采用氧化呼吸链复合物II抑制剂TTFA和ATP合酶抑制剂 oligomycin A处理结肠癌细胞,与不加抑制剂相比较,在低表达ATP5A1和SDHB的细胞系发现TTFA和oligomycin A能更大程度上抑制细胞增殖。这说明,由单一ATP5A1高表达引起的线粒体蛋白组分和功能的变化导致了细胞对两种不同机制的抑制剂产生了耐受性。因此,这提示在对出现线粒体重塑现象的结肠癌进行治疗时需采用更具针对性的协同分子靶向治疗策略和个性化治疗方案。

