肥胖及其变化对中国华北新发NAFLD成年男性患者心血管疾病发病风险的影响
胡诗琪,蓝彦琦,吴寿岭,王晓墨,陈朔华,汪国栋*,王 丽*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 流行病与卫生统计学系,北京 100005; 2.开滦总医院 心内科,河北 唐山 063000)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)(简称脂肪肝)是指肝内至少5%的肝细胞发生脂肪变性,同时排除过量饮酒、病毒或药物等已知的损害因素导致的肝损伤[1]。NAFLD作为目前最常见的一种慢性肝病,影响了全球约25%的人群[2]。更为重要的是,NAFLD可能发展为一系列肝内和肝外的不良结局[3],包括心血管疾病(cardiovascular diseases, CVDs)[4]。越来越多的证据表明,心血管疾病比肝病的进展更频繁、更大程度地决定NAFLD患者的预后[4],其原因可能与NAFLD患者常伴随肥胖、Ⅱ型糖尿病、血脂代谢异常等CVDs危险因素有关[4]。
目前尚无有效的药物治疗NAFLD,以减重为中心的生活方式改善被推荐为NAFLD的一线干预手段。美国胃肠病学协会最新的专家共识提出,所有NAFLD患者,无论是否伴有超重/肥胖,均应控制体质量,以期实现肝脏脂肪变性、血糖控制、以及胰岛素敏感性的改善,从而最终降低包括CVDs在内的不良结局的发生[6]。然而,上述共识所依赖的证据有限,需要更多的证据支持。
因此,本研究基于开滦队列研究(Kailuan cohort study)的新发NAFLD人群,分析肥胖(身体质量指数[body mass index, BMI]和腰围[waist circumference, WC])及其状态变化对CVDs风险的关系,旨在探讨肥胖程度和短期肥胖状态改变对新发NAFLD患者心血管状态发展的影响。
1 材料与方法
1.1 研究对象
开滦队列研究(临床试验注册号:Chi-CTR-TRNC-11001489)纳入了开滦集团在职和离退休职工等超过15万名成年人(18~98岁)[7]。自2006年建立队列以来,每2年开展1次随访,收集所有队列人员的人口学、人体测量学及实验室检查指标。本研究遵守赫尔辛基宣言原则,并通过开滦医疗集团伦理委员会([2006]医伦字5号)和中国医学科学院伦理委员会(批准号:2018ZX10715005)批准;并获得所有研究对象的知情同意。
由于男性约占队列人群的80%,因此本研究纳入了2006—2013年新发的12 555例18~59岁新发脂肪肝的男性。其新发脂肪肝的定义为:在进入队列时无脂肪肝史,并在后续3轮随访(2008—2009、2010—2011、2012—2013年)中首次被诊断为脂肪肝。同时根据NAFLD的诊断标准[1]排除了:1)酒精摄入量缺失或酒精摄入量过高(酒精摄入量≥30 g/d,n=2 903);2)乙肝表面抗原(HBsAg)阳性或缺失(n=354);并进一步排除了1)心血管疾病(n=203)、癌(n=18)、肝硬化(n=17)病史者;2)服用降糖药等可能严重影响体质量变化者(n=188);3)BMI异常(<15或>50 kg/m2)和基线BMI缺失者(n=281)。最终纳入8 591例。
1.2 研究方法
1.2.1 协变量的收集:采用问卷调查收集人口统计学特征(年龄、性别、教育水平)、生活方式因素(吸烟、酒精摄入和体力活动)、自我报告的糖尿病、高血压、心血管疾病、癌病史以及相关药物治疗(降压药、降糖药治疗)。根据闲暇时间的体育活动(每次运动≥20 min)频率(从不、有时或≥4次/周),将体育活动水平分为不活跃、中等或较活跃。采用统一型号的电子秤测量受试者的体质量和身高,所有受试者均要求着轻便的服装,赤脚站立;其中身高精确到最接近的0.5 cm,体质量精确到0.1 kg。腰围根据世界卫生组织的准则[8]在肋骨下缘和胸骨上缘的中点测量,精确到0.1 cm。所有受试者禁食8 h以上后采集空腹静脉血,采用自动分析仪(日立747/7600,日本东京)检测测量空腹血糖(fasting blood glucose, FBG)、总胆固醇(total cholesterol, TC)、三酰甘油(triglyceride, TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDL-C)和丙氨酸氨基转移酶(alanine aminotransferase, ALT);应用酶联免疫吸附法(科华生物工程公司,上海)检测HBsAg;所有的实验室检测均在开滦总医院中心实验室完成。
1.2.2 相关定义和诊断标准:根据世界卫生组织提出针对亚洲成年男性的标准,将BMI≥25 kg/m2或腰围≥90 cm定义为肥胖[9](后者为“中心性肥胖”);其中BMI=体质量(kg)/身高(m)2。根据基线BMI和腰围将研究对象分为非肥胖组和肥胖组,并进一步根据每个个体第2次体格测量(与基线测量间隔时间1~4年)时的BMI和腰围变化,进一步分为“持续非肥胖组”(两次测量时均满足BMI<25 kg/m2和两次测量时均满足腰围<90 cm)、“增重组”(非肥胖组进展到肥胖组)、“减重组”(肥胖组逆转为非肥胖组)和“持续肥胖组”(两次测量时均同时满足BMI≥25 kg/m2或两次测量时均同时满足腰围≥90 cm)。糖尿病的诊断标准为空腹血糖(fasting blood glucose,FBG)≥7.0 mmol/L,或自我报告糖尿病史/服用降糖药。高血压的诊断标准为收缩压(systolic blood pressure, SBP)≥140 mmHg(1 mmHg=0.133 kPa)或舒张压(diastolic blood pressure, DBP)≥90 mmHg,或自我报告高血压史/服用降压药。中心性肥胖的标准定义为腰围≥90 cm(男性)。
1.2.3 随访和终点事件的确定:本研究为新发NAFLD患者队列,在探究肥胖对CVDs发病风险影响时以第1次BMI测量时点为随访起点;而探究肥胖变化的影响时则以第2次BMI测量时点为随访起点。随访终点均为新发CVDs事件(包括心肌梗死、缺血性卒中和出血性卒中)、死亡或至随访结束(2019年12月31日)的时间。CVDs与全因死亡结局每年通过开滦社会保障信息系统获取,由经过培训的医务人员到新发病例诊治的医院收集观察对象的终点事件情况。所有诊断均由专业医师根据住院病历确认。
1.3 统计学分析
2 结果
2.1 研究人群的基本特征
本研究总共纳入研究对象新发NAFLD成年男性基线特征如表1所示。基于BMI和WC定义肥胖,均可发现与非肥胖组相比,肥胖组患者饮酒率、血压、血糖、血脂和肝酶都较高(P<0.05),但吸烟率较低。另外,两组总胆固醇水平的差异无统计学意义。但按BMI和WC定义的非肥胖组和肥胖组之间在年龄上的差异并不一致,BMI划分的两组人群平均年龄有差异(P<0.001),但按腰围划分的两组平均年龄相近。
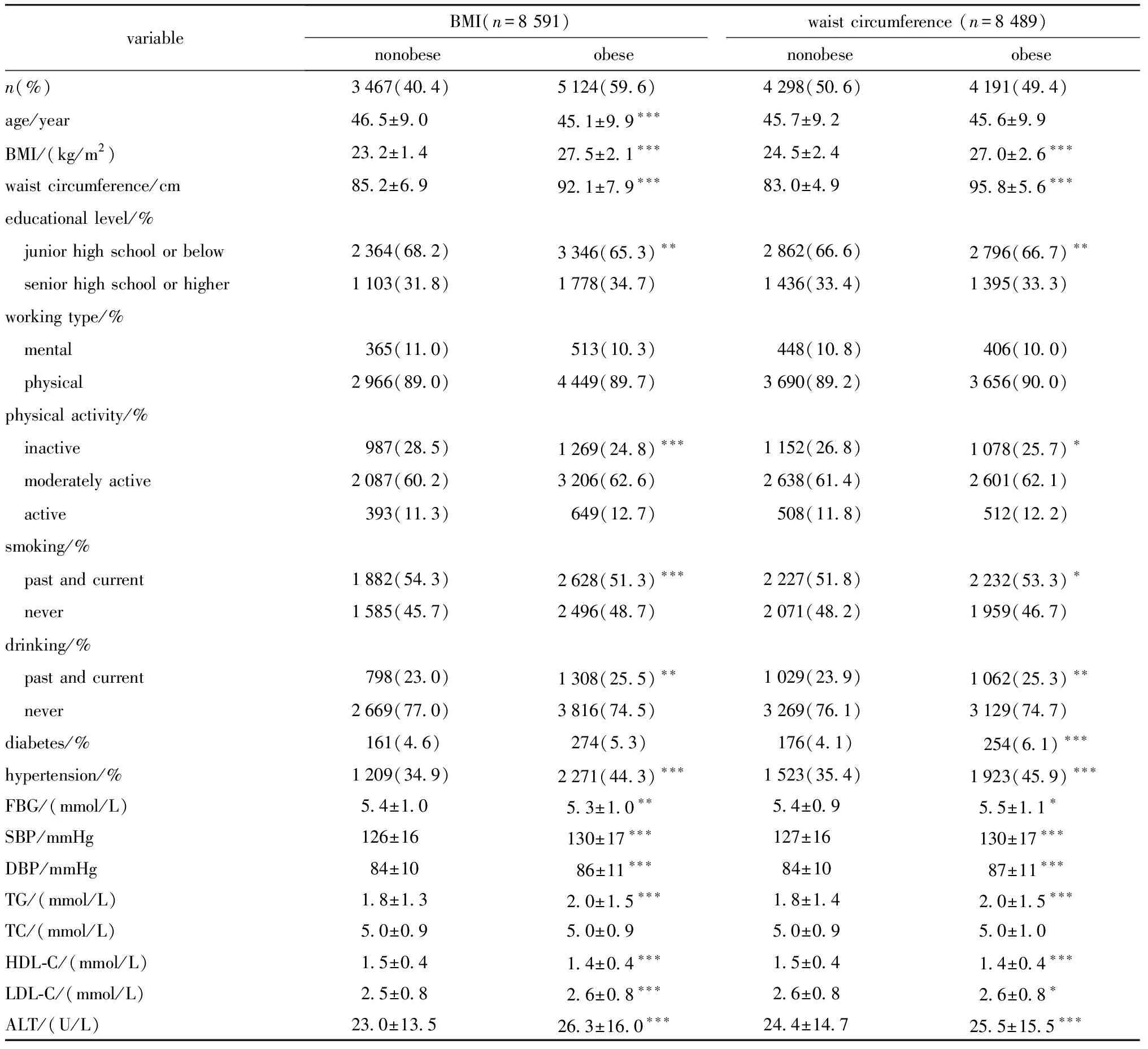
表1 不同肥胖分组观察对象的基线资料Table 1 Characteristics of the participants at baseline
2.2 不同基线肥胖状态与新发CVDs的关联
经过中位9.41年的随访,8 591例研究对象共发生了349例CVDs事件。按照BMI划分,非肥胖组和肥胖组CVDs的10年累积发病率分别为3.2%和4.1%(图1);基于腰围划分的非肥胖和肥胖组累积发病率与BMI划分相似,分别为3.3%和4.3%(P<0.05)(图1)。但经过多因素校正后,无论是基于BMI还是腰围划分,非肥胖组和肥胖组发生CVDs均无差别(表2)。
2.3 不同肥胖变化状态与新发CVDs的关联
平均间隔2.04年后,分别有7 082、6 861例新发NAFLD男性患者进行了第2次BMI、腰围测量,中位随访7.32年后共发生了255、244例CVDs事件(图2,表3)。按BMI划分的持续非肥胖组、增重组、 减重组与持续肥胖组的8年累积发病率分别为2.8%、3.6%、4.2%和3.3%;按腰围划分的4组发病密度分别为2.8%、3.1%、2.9%和3.8%。

A.body mass index of NAFLD onset; B.waist circumference at NAFLD onset
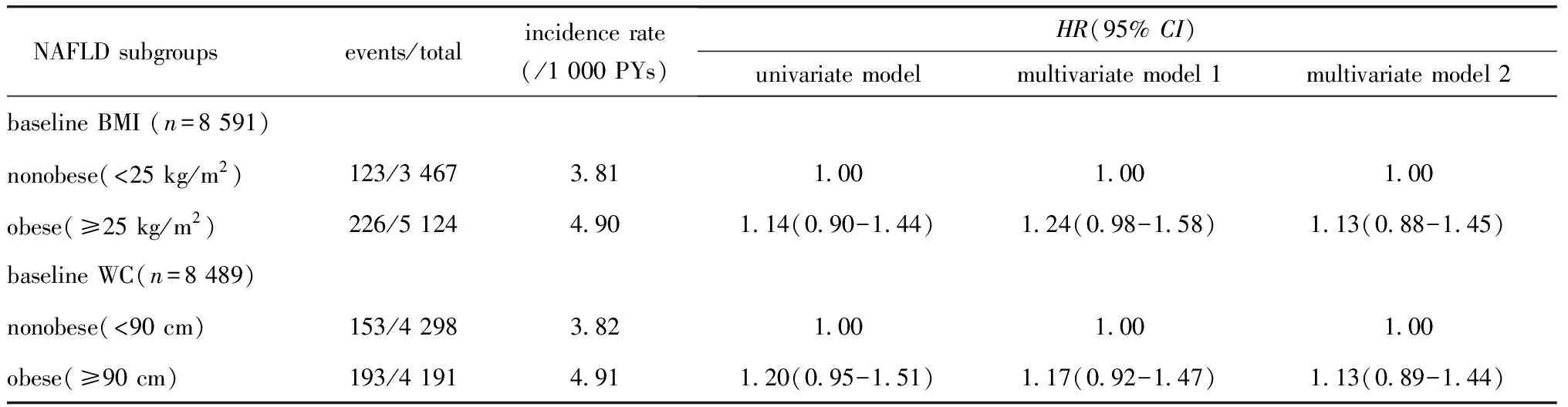
表2 不同基线肥胖状态对新发CVDs影响的竞争风险模型
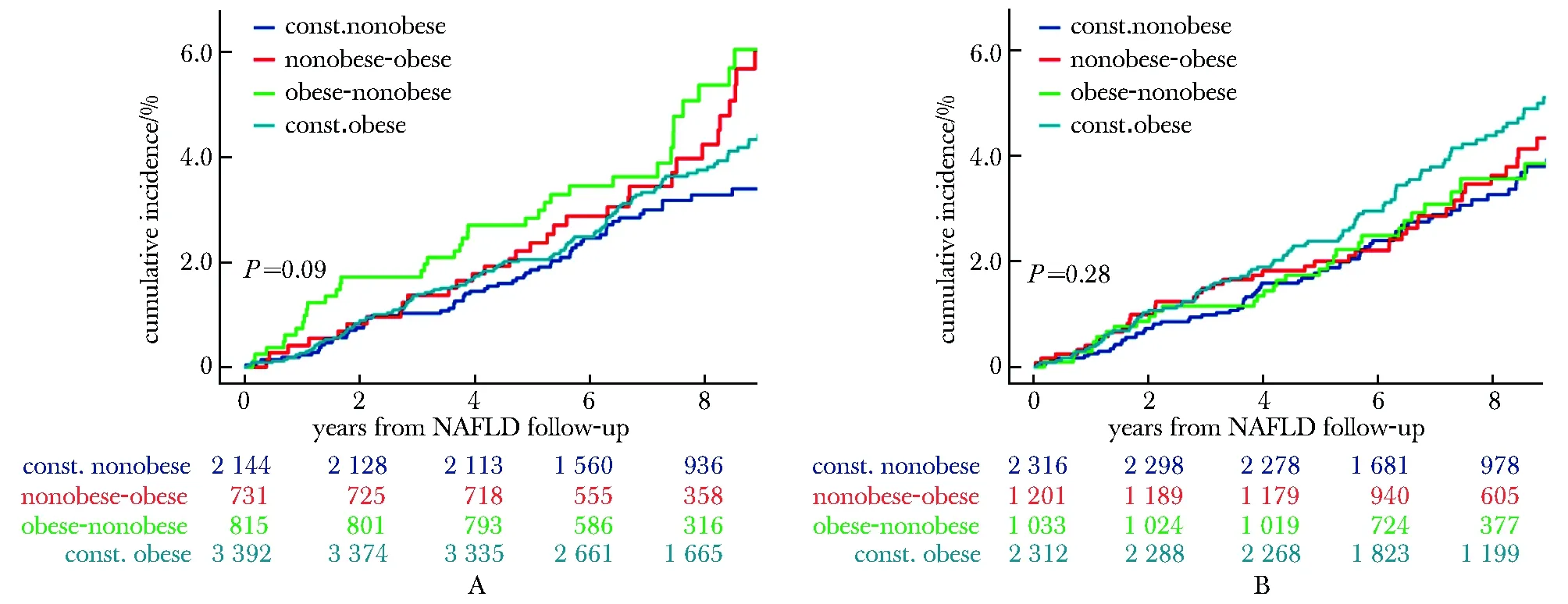
A.trajectory of body mass index during the follow-up; B.trajectory of waist circumference during the follow-up

表3 不同肥胖变化轨迹对新发CVDs影响的竞争风险模型
考虑了死亡竞争风险后,与持续非肥胖组相比,无论是在单因素,多因素模型1和2中均观察到增重组和减重组发生CVDs的风险增加,模型3的HR(95%CI)分别为1.57(1.03~2.38),1.52(1.00~2.30);但进一步校正基线BMI以后,减重组与持续非肥胖组之间没有差异(表3,多因素模型3)。以腰围持续非肥胖组为参照,其他3个组CVDs发病风险均无差异。
3 讨论
本研究探讨了中国华北成年男性新发NAFLD患者BMI、腰围及其变化与CVDs之间的关系。发现基于BMI定义的肥胖状态变化,新发NAFLD患者短期内从非肥胖转化为肥胖会显著增加未来CVDs发病风险,其效应独立于基线肥胖状态。
目前尚无明确的NAFLD药物治疗建议。由于肥胖是NAFLD进展中重要的影响因素,因此多个指南均将通过饮食和运动减轻体质量作为NAFLD的一线治疗方式[11]。上述手段均能降低胰岛素抵抗并改善心脏代谢危险因素,提示控制体质量可能会降低NAFLD患者CVDs的发生风险[4]。本研究发现1~4年的短期增质量会导致CVDs发病风险升高,从相反的方面证实了控制体质量可能预防NAFLD患者CVDs的发生,这可能与脂肪囤积的危害有关。肝脏是葡萄糖和脂质代谢的重要调节器,同时也是促动脉粥样硬化分子的来源。NAFLD加速动脉粥样硬化形成可能起源于扩张的内脏脂肪组织,扩张和发炎的内脏脂肪组织释放大量能参与胰岛素抵抗和动脉粥样硬化形成的分子,包括游离脂肪酸、白细胞介素-6、肿瘤坏死因子α和其他促炎细胞因子,从而导致CVDs发病风险增加[12]。值得注意的是,本研究中发现增重组、减重组的男性拥有相似且相对持续非肥胖组偏高的CVDs事件风险,这可能是由于除了肥胖的严重程度外,肥胖持续时间也会对冠状动脉疾病事件带来影响。另外,本研究中并未同时考虑BMI和腰围指标来综合界定人群的肥胖变化情况,比如BMI下降但腰围未改变的减重亚组带来的影响,也未考虑减重组在随访期间可能出现的体质量反复波动的情况,所以短期减重对心血管系统带来的风险如何还需要进一步探讨,仍需更多证据来进行检验。
本研究并未发现基线肥胖与CVDs风险相关,可能与随访时间有限有关。但据报道[13],瘦NAFLD患者与肥胖NAFLD患者拥有相似的胰岛素抵抗和血脂异常等代谢特征,可以部分解释本研究观察到的阴性结果。另外, 本研究发现中心性肥胖即男性腰围≥90 cm)与CVDs风险增高相关,但考虑死亡竞争风险后差异无统计学意义,提示中心性肥胖对死亡的影响可能更大,这与之前的报道一致[14]。
本研究也有一定局限性。首先,本研究使用腹部超声来诊断脂肪肝,当肝细胞脂肪含量<20%时可能导致NAFLD错误分类[15],这会导致肥胖与CVDs的关联被低估;第二,本研究只评估了短期体重变化,且随访期较短,结果有必要在后续研究中进行验证。
综上所述,本研究发现短期由BMI非肥胖状态增重至肥胖状态基于会增加男性新发NAFLD患者未来CVDs的发病风险。提示应该对早期NAFLD男性患者提供科学控制体质量的干预计划,为制定合理的健康管理措施提供证据。

