气液交互法培养小鼠来源的肿瘤类器官的建立及优化
李钊璇,罗云萍,陈 翀
(中国医学科学院基础医学研究所 北京协和医学院基础学院 免疫学系, 北京 100005)
免疫微环境(immune microenvironment)在肿瘤发生发展的过程中起到重要作用,靶向免疫微环境的肿瘤治疗策略受到科学家的极大关注,例如抗细胞毒性T淋巴细胞相关蛋白4(cytotoxic T-lymphocyte-associated protein 4,CTLA-4)或抗程序性死亡受体1(programmed cell death protein 1,PD-1)抗体可以增强T淋巴细胞的抗肿瘤效应。异质性的肿瘤免疫微环境可以影响肿瘤免疫治疗效果[1],在体外真实地模拟肿瘤细胞与免疫细胞之间的相互作用是肿瘤免疫治疗药物研发的关键。
现阶段,肿瘤药物研究模型主要包括2D(two-dimension)细胞培养模式、患者来源的移植瘤模型(patient-derived xenografts,PDX)[2-4]和3D(three-dimension)细胞培养模式。2D细胞培养模式中肿瘤细胞会在长期的传代培养过程中丢失原有的遗传特性和病理特征导致临床相关性较低。PDX模型是将患者的肿瘤组织移植到免疫缺陷小鼠体内,因此,不适用于肿瘤免疫微环境的研究,移植的肿瘤组织可能会发生小鼠样进化[5],并且PDX模型移植成功率较低、培养周期长、成本费用高。3D细胞培养模式包括单一细胞类型来源的类器官培养,通常只包含肿瘤上皮细胞,加入特定的免疫细胞后所形成的肿瘤免疫微环境难以重现体内真实的细胞间位置关系且操作复杂[6-8]。
为了在体外保留肿瘤的免疫微环境,便于开展肿瘤免疫治疗的相关研究,本研究拟构建一种保留小鼠原始肿瘤中各类免疫细胞的鼠源肿瘤类器官(mouse-derived tumor organoid,MTO)模型,以观察MTO的组织学形态以及各类免疫细胞的比例,并初步探讨IL-2对MTO中T淋巴细胞数量的影响。
1 材料与方法
1.1 材料
1.1.1 细胞:小鼠结肠癌细胞系CT26和MC38、小鼠肺癌Lewis细胞系(ATCC)。
1.1.2 动物:SPF 级 6~8 周龄,Balb/c 雄鼠和C57BL/6雄鼠(中国医学科学院基础医学研究所实验动物中心)。
1.1.3 试剂:RPMI 1640(Biological Industries公司);胎牛血清和100× 青霉素链霉素(Gibco公司);流式抗体:CD45-Percp、CD3-FITC、CD4-APC、CD8-APC、CD11b-APC、F480-FITC、CD11c-APC、MHCII-FITC和B220-APC(Biolegend公司);Cellmatrix type Ⅰ-A(FUJIFILM Wako Chemicals公司);Ham’s F-12、HEPES和Ham’s F-12干粉培养基(Invitrogen公司);Normocin(InvivoGen公司);重组鼠白细胞介素-2(Peprotech公司);Collagenase Ⅳ(Worthington公司)。
1.2 方法
1.2.1 CT26结肠癌、MC38结肠癌和Lewis肺癌移植瘤模型的建立:将处于对数增殖期的CT26、MC38和Lewis贴壁细胞消化成单个细胞,分别用 PBS 重悬成 5×106个/mL,将CT26细胞和Lewis细胞分别接种 100 μL 于8周龄的C57BL/6雄鼠右侧肋骨皮下中,将MC38细胞接种100 μL 于8 周龄的 Balb/c雄鼠右侧肋骨皮下中。成瘤后用断颈法处死小鼠,取出肿瘤组织,将每种类型的肿瘤组织分为两部分,一部分用于检测肿瘤中各种免疫细胞的比例,另一部分用于制作肿瘤类器官。
1.2.2 构建气液交互法(air-liquid interaction method)培养小鼠来源的肿瘤类器官(MTO)
1.2.2.1 重构的胶原蛋白溶液的配制:配制0.1 L的含有200 mmol/L HEPES和0.05 mol/L NaOH的缓冲液,再加入2.2 g NaHCO3,配成无菌重建缓冲液。将Cellmatrix Ⅰ-A、10×的浓缩无菌培养基(Ham’s F12)和无菌重建缓冲液以8∶1∶1的比例在冰上混合,先将Cellmatrix Ⅰ-A和10×的浓缩无菌培养基(Ham’s F12)混匀后再加入无菌重建缓冲液再次混匀,避免产生气泡,混匀后将重构的胶原蛋白溶液放在冰上以防止形成凝胶。
1.2.2.2 肿瘤类器官的制作:在无菌的条件下将1 mL重构的胶原蛋白溶液添加到30 mm 0.4 μm的内部插入式细胞培养皿中,用作没有肿瘤组织的底层凝胶,将底层凝胶放在37 ℃下固化30 min。将上述CT26结肠癌、MC38结肠癌和Lewis肺癌移植瘤模型的肿瘤组织取出后,各取大小约为1 cm3的肿瘤组织在冰上切碎,切碎后的肿瘤组织应小于0.3 mm3,切碎过程保持肿瘤湿润,在含Normocin的F12中清洗数次,防止污染。将切碎的肿瘤组织重悬于1 mL的胶原蛋白溶液中,然后铺在预先固化的1 mL胶原蛋白凝胶上。将装有肿瘤组织和胶原蛋白凝胶的插入式细胞培养皿置于60 mm细胞培养皿中,然后在37 ℃孵箱中固化30 min,形成凝胶。
1.2.2.3 肿瘤类器官的培养:肿瘤类器官的制作完成后,在60 mm细胞培养皿中放入2 mL基础培养基(Ham’s F12中加入20% FBS和Normocin)或优化培养基(基础培养基中加入500 IU/mL的IL-2),培养基液面高度不应超过含有肿瘤组织层的凝胶,以形成气液界面。在37 ℃,5% CO2的条件下进行培养,每2 d更换1次培养基。
1.2.3 流式细胞测量术检测各种免疫细胞的比例:将原始肿瘤和MTO消化成单个细胞后计数,分别将其制备成 1×106个/mL的单细胞悬液,离心后用 流式细胞荧光分选技术(fluorescence activated cell sorting,FACS)流式染液重悬,加入抗体(抗体:细胞悬液=1∶100),4 ℃ 避光孵育 20 min后,用PBS洗涤2次后,进行流式细胞测量术检测。所得数据使用BD公司的FlowJo X软件进行分析。
2 结果
2.1 小鼠CT26结肠癌、Lewis肺癌和MC38结肠癌的MTOs的构建
成功建立的小鼠CT26结肠癌、Lewis肺癌和MC38结肠癌的MTOs(图 1A),均体现了原始肿瘤的组织学形态(图1B),包括紧密结合的上皮细胞和基质细胞。
2.2 小鼠CT26结肠癌来源的MTO中各类免疫细胞的比例
与小鼠CT26结肠癌原始肿瘤组织相比,其MTO中CD4+T细胞、CD8+T细胞和CD19+B细胞的比例基本保持不变,CD11b+F4/80+巨噬细胞比例从66.7%减少到44.3%,CD11c+MHCⅡ+树突状细胞的比例从66.5%减少到7.25%(图2)。
2.3 小鼠Lewis肺癌来源的MTO中各类免疫细胞的比例
与小鼠Lewis肺癌原始肿瘤组织相比,其MTO中CD4+T细胞、巨噬细胞、树突状细胞和B细胞的比例基本保持不变,CD8+T细胞的比例从5.6%减少到1.95%(图3)。
2.4 小鼠MC38结肠癌来源的MTO中各类免疫细胞的比例
与小鼠MC38结肠癌原始肿瘤组织相比,其MTO中CD4+T细胞、CD8+T细胞和B细胞的比例基本保持不变,巨噬细胞的比例从33.5%减少到17%, 树突状细胞的比例从46.8%减少到1.2%(图4)。
2.5 细胞因子IL-2对MTO中T淋巴细胞的影响
加入IL-2后,在小鼠CT26结肠癌MTO中CD4+T细胞的比例从6.87%上调至17.5%,CD8+T细胞比例从5.5%上调至21.7%;在小鼠Lewis肺癌MTO中CD4+T细胞的比例从7.73%上调至10.2%,CD8+T细胞比例从1.95%上调至11.4%;在小鼠MC38结肠癌MTO中CD4+T细胞的比例从1.98%上调至4.81%,CD8+T细胞比例从2.26%上调至4.84%(图5)。
3 讨论
类器官技术于2017年被《自然·方法》评为年度方法,标志着其作为人类疾病的体外研究新模型得到科研人员的广泛认可。目前,包含单一肿瘤细胞的多种肿瘤类器官模型已成功建立,包括结直肠癌、胃食管癌和乳腺癌等,临床中利用肿瘤类器官进行药物筛选,预测患者对靶向药物或化学治疗的反应,从而实现肿瘤患者的个性化医疗[9-11]。然而,如何在体外模型中构建肿瘤免疫微环境来研究免疫药物反应一直是肿瘤研究中的难点。
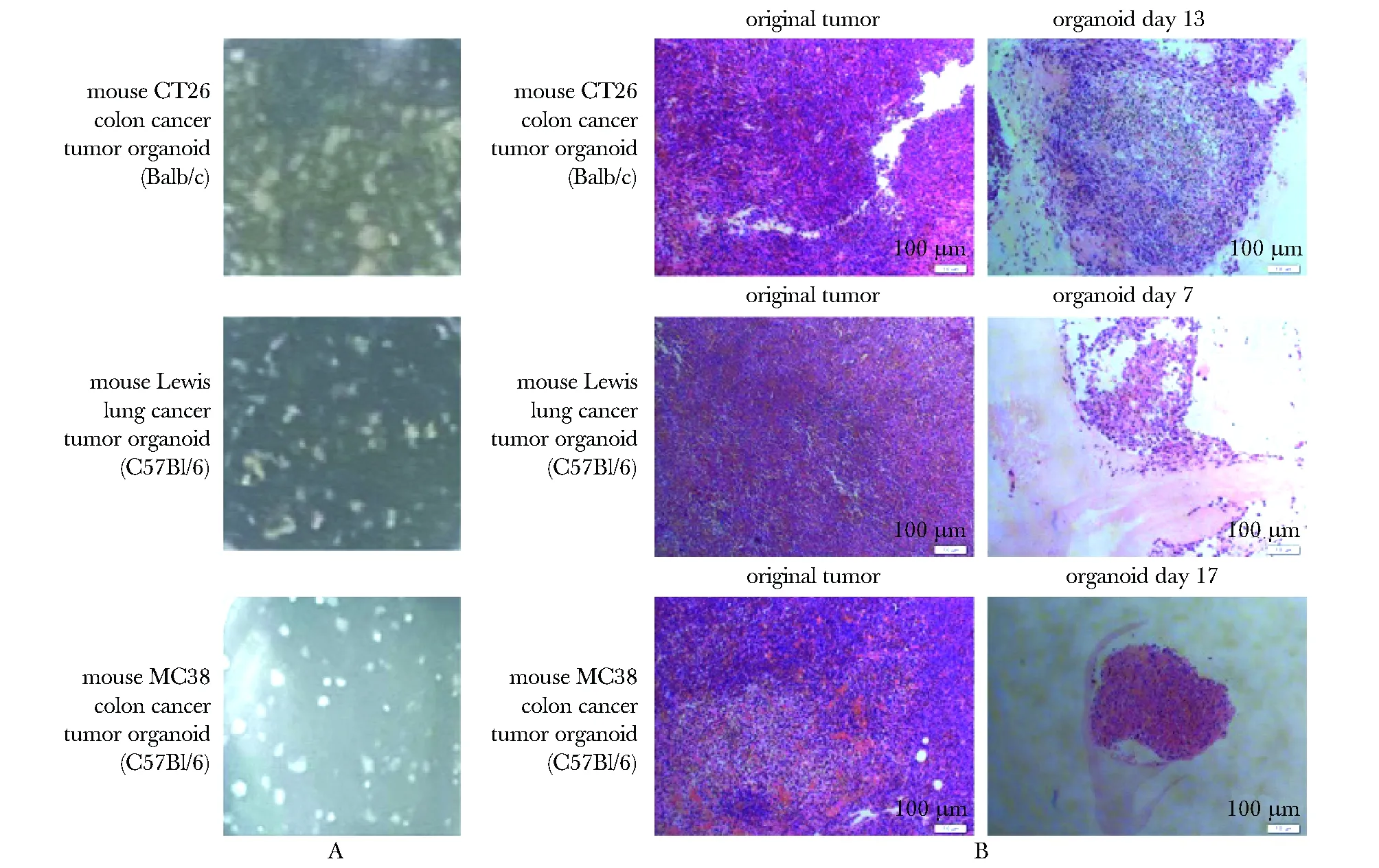
A.images of MTOs from diverse tumor types; B.HE of original tumor and MTOs from diverse tumor types;HE.hematoxylin-eosin staining

图2 CT26结肠癌原始肿瘤及其MTO中各类免疫细胞的比例Fig 2 Proportion of immune cells in original tumor or MTO of CT26 colon cancer
本研究结果显示,气液交互法培养的小鼠来源的肿瘤类器官可以保留肿瘤上皮细胞、内源性免疫成分以及肿瘤固有的基质细胞,这种 MTO模型不同于仅有肿瘤上皮细胞的类器官模型[12-13]和外周血或肿瘤浸润淋巴细胞共培养的模型[7,14], 其特点是拥有肿瘤上皮细胞和具有特异性肿瘤免疫反应的肿瘤浸润淋巴细胞,可以在一定程度上保留原始的肿瘤免疫微环境,从而在体外实现针对肿瘤免疫治疗的相关研究。最初气液交互法常用来培养由多能干细胞诱导分化形成的组织或器官比如胃肠道类器官,这种类器官仍不具备器官中的微环境,缺少相应的基质细胞。本研究中的方法直接利用原始肿瘤组织构建类器官,并且可以模拟培养过程中营养物质和代谢物质在肿瘤组织内的运输。
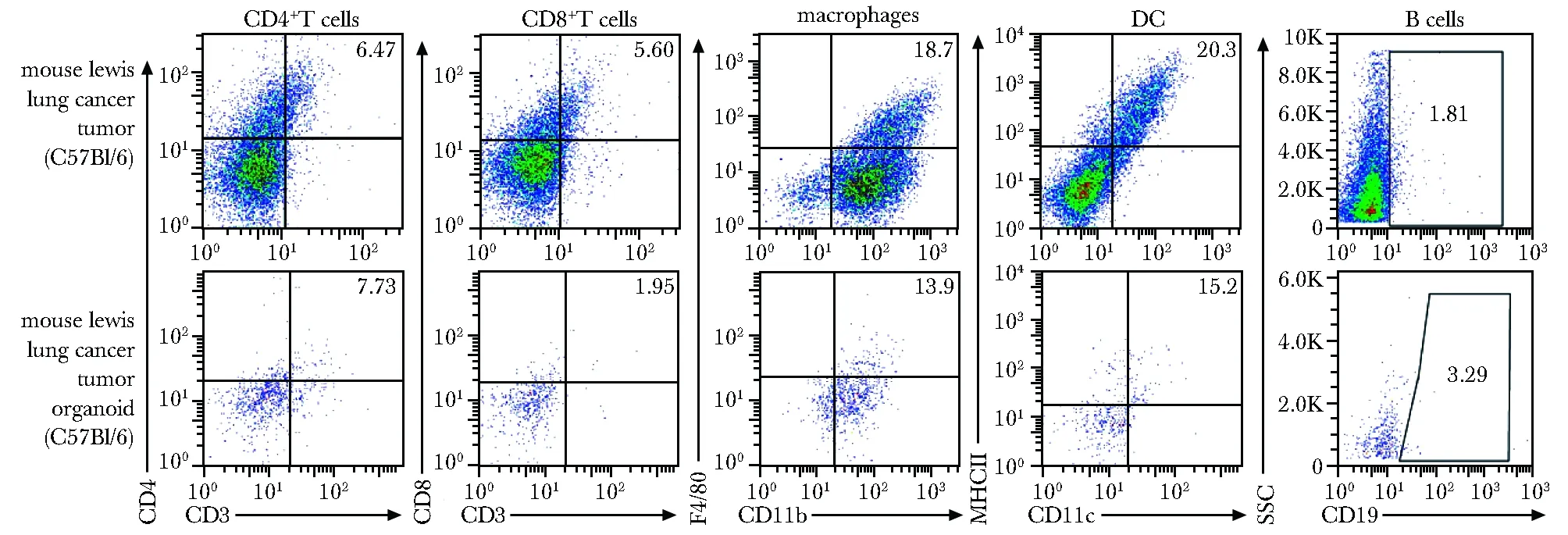
图3 Lewis肺癌原始肿瘤及其MTO中各类免疫细胞的比例Fig 3 Proportion of immune cells in original tumor or MTO of Lewis Lung cancer

图4 MC38结肠癌原始肿瘤及其MTO中各类免疫细胞的比例Fig 4 Proportion of immune cells in original tumor or MTO of MC38 colon cancer
MTO中保留了原始肿瘤中各种内源性免疫细胞类型,但随着培养时间的延长,肿瘤浸润的免疫细胞数量随之降低,本研究发现IL-2可以增加T细胞的数量从而降低培养过程中T细胞的损失。如果需要维持MTO中巨噬细胞和树突状细胞的数量,还要进一步优化MTO的培养方法。维持巨噬细胞的数量可以考虑加入巨噬细胞集落刺激因子(M-CSF),M-CSF在巨噬细胞由G1期跨入S期过程中起决定性作用,促进和维持单核-巨噬细胞的增殖和分化。维持树突状细胞数量可以考虑加入粒细胞巨噬细胞集落刺激因子(GM-CSF)、白细胞介素-4(IL-4)或肿瘤坏死因子-α(TNF-α)。GM-CSF可以促进树突状细胞的存活,提高细胞表面MHCII类的表达从而增强细胞的抗原递呈功能;IL-4可以引导单核细胞向树突状细胞(dentritic cell,DC)方向分化;TNF-α可以诱导未成熟树突状细胞分化成成熟树突状细胞。未来还可以利用MTO模型在体外研究药物对肿瘤免疫微环境中免疫细胞功能的调控作用,开发新型的肿瘤联合免疫治疗策略。
综上所述,本研究构建了一种气液交互法培养的小鼠来源的肿瘤类器官模型,系统分析了其中关键的免疫细胞组分,并证实了IL-2可以维持T淋巴细胞的数量,为进一步优化肿瘤类器官培养方法和药物研发奠定了基础。
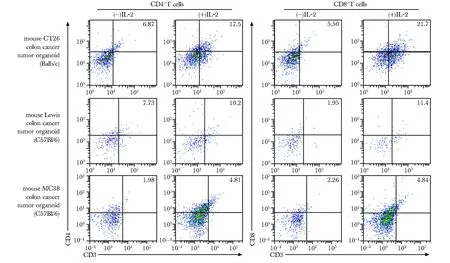
图5 IL-2处理MTOs后CD3+CD4+ T细胞和CD3+CD8+ T细胞的比例Fig 5 Proportion of CD3+CD4+ T cells and CD3+CD8+ T cells after IL-2 treatment on MTOs

