瓦雷兹芽孢杆菌FZB42对松杉球壳孢抑菌活性的影响1)
隋凤翔 郑义 杨芷怡 李晓岩 牛犇
(东北林业大学,哈尔滨,150040)
松树枯梢病是一种世界范围内分布最广泛的松树病害,其病原菌为松杉球壳孢(Sphaeropsissapinea),该菌主要侵害樟子松、黑松、油松、红松、马尾松等针叶树,影响范围大,发展速度快,严重时可导致林木大面积枯死,造成严重经济损失[1]。目前防治松树枯梢病的方法主要是化学防治,然而,化学药剂的频繁使用不仅会使病原菌产生耐药性,还会导致越来越严重的环境污染和生态破坏[2-3]。因此,开展松树枯梢病的生物防治十分必要。基于微生物拮抗剂的生物防治具有环境友好且耐药性低等优点,是实现对松树枯梢病绿色防控的重要选项之一。
瓦雷兹芽孢杆菌(Bacillusvelezensis,曾用名B.amyloliquefacienssubsp.plantarum)FZB42是重要的植物促生根际细菌(plant growth promoting rhizobacterium,PGPR)[4]。此外,基因组测序结果分析显示,菌株FZB42含有11个与次级代谢产物合成相关的基因簇,能够通过非核糖体途径及核糖体途径合成多种脂肽类(bacillomycin D,fengycin,surfactin)、聚酮类(bacillaene,difficidin,macrolactin)及多肽类(plantazolicin,amylocyclicin)抑菌活性物质,具有显著的生防潜力[4-6]。研究表明,FZB42可抑制尖孢镰刀菌等多种病原菌的生长,但其对松杉球壳孢的潜在影响尚未被充分评价[7]。本研究利用瓦雷兹芽孢杆菌FZB42对松杉球壳孢的抑菌效果进行了研究,并对其抑菌活性物质进行了初步分离及抑菌效果验证,以期深入解析其防治机理,为瓦雷兹芽孢杆菌FZB42作为松树枯梢病生防制剂的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
供试菌:瓦雷兹芽孢杆菌(Bacillusvelezensis)FZB42,松杉球壳孢(Sphaeropsissapinea),均为实验室保存。
LB液体培养基:10 g NaCl、5 g酵母提取物、10 g胰蛋白胨,1 000 mL蒸馏水。
PDA培养基:46 g马铃薯葡萄糖琼脂培养基、1 000 mL蒸馏水。
Landy培养基:5 g L-谷氨酸、0.5 g KCl、0.15 mg FeSO4·6H2O、5.0 mg MnSO4·H2O、0.16 mg CuSO4·5H2O,加入超纯水使终体积为940 mL,调节pH=7.0,分装至三角瓶中,121 ℃高压灭菌锅灭菌20 min;40%葡萄糖50 mL、10% KH2PO410 mL,分装至三角瓶,115 ℃高压灭菌15 min,将两瓶液体混合均匀,待用。
MSGG培养基:50 mL 0.1 mol/L Pot. phosphate buffer、100 mL 1 mol/L MOPS、10 mL 5 mmol/L FeCl3、10 mL 200 mmol/L MgCl2、5 mL 10 mmol/L MnCl2、0.1 mL 10 mmol/L ZnCl2、1 mL 2 mmol/L硫胺素、5 mL 10 g/L色氨酸、5 mL 10 g/L苯基丙氨酸、5 mL 10 g/L苏氨酸、25 mL 20%丙三醇、25 mL 20%谷氨酸盐、700 μL 1 mol/L CaCl2、758.2 mL ddH2O。
硫酸铵、胃蛋白酶、PBS等购于天津市天力化学试剂有限公司。
1.2 瓦雷兹芽孢杆菌FZB42体外抑菌活性测定
瓦雷兹芽孢杆菌FZB42抑菌活性测定采用平板对峙法[8]。将瓦雷兹芽孢杆菌FZB42从冰箱(-80 ℃)取出,使用平板划线法接种于LB固体培养基中,倒置于30 ℃培养箱中过夜培养。将松杉球壳孢接种于固体PDA培养基,放置于25 ℃培养箱培养一周,待用。挑取瓦雷兹芽孢杆菌FZB42单菌落,接种到5 mL LB液体培养基中,放置于摇床中30 ℃培养16 h,测定菌液在600 nm处的吸光度,并将其调整至OD600=1(以LB液体培养基作为空白对照)。利用5 mm打孔器在上述松杉球壳孢菌落边缘打菌柄,并将菌丝面向下接种至PDA培养基中央。取上述FZB42菌液2 μL分别接种于距中央菌饼3.5 cm处的4个方向。设定3个重复。培养4 d后观察拮抗结果,通过测量抑菌圈大小,根据下述公式计算抑制率:
抑制率=((对照菌落直径-处理菌落直径)/对照菌落直径)×100%。
1.3 瓦雷兹芽孢杆菌FZB42发酵液的制备及抑菌活性测定
采用Landy培养基制备瓦雷兹芽孢杆菌FZB42发酵液。选取500 mL三角瓶,按照器皿体积与培养液以体积比10∶1的比例加入50 mL Landy培养液,将瓦雷兹芽孢杆菌FZB42菌液1 mL(OD600=1)接种于Landy培养液中,置于摇床中30 ℃培养60 h,设定空白Landy培养液作为对照。发酵结束后,将瓦雷兹芽孢杆菌FZB42发酵液离心(6 000 r/min,30 min)取上清,重复上述操作,直至肉眼观察无菌液沉淀后,取上清液,利用0.22 μm注射器驱动过滤器过滤细菌,得到瓦雷兹芽孢杆菌FZB42的发酵滤液。
将制备好的瓦雷兹芽孢杆菌FZB42发酵滤液与PDA培养基按照体积比1∶5的比例混合测定发酵滤液的抑菌活性。将5 mL FZB42发酵滤液与PDA培养基混合液分别加入到6孔板中,待其凝固后,取直径5 mm的松杉球壳孢菌饼接种于每孔中央,设定空白PDA培养基作为对照,置于培养箱中25 ℃培养1 d,观察抑菌结果,分别测定实验组和对照组的测量菌落半径,并计算抑制率。
在PDA培养基中央接种直径8 mm的松杉球壳孢菌饼,并在菌饼周围距菌饼相同直径处以45°插入盖玻片若干,放置于培养箱25℃培养5 d,使松杉球壳孢菌丝生长至盖玻片上。将表面有松杉球壳孢菌丝的盖玻片浸泡在FZB42 Landy发酵滤液中培养2 d,利用光学显微镜观察菌丝形态的变化,设定空白对照。
1.4 瓦雷兹芽孢杆菌FZB42发酵液抗菌肽的粗提及抑菌活性测定
采用硫酸铵沉淀法分离提取FZB42发酵液中的抑菌物质[9]。分别向20 mL FZB42发酵滤液中加入固体硫酸铵,直至最终饱和度达到60%和90%,置于冰箱4 ℃过夜沉淀,次日离心(10 000 r/min,4 ℃,30 min),去上清,收集沉淀。用5 mL PBS(10 mmol/L,pH=7.5)将上述沉淀物充分溶解,并将其放入分子质量为10 ku的透析袋中进行透析脱盐24 h,然后用10 mmol/L PBS (pH7.5)稀释至20 mL,得到FZB42发酵液肽类粗提物。将上述粗提取物与PDA培养基以体积比1∶5的比例混合,测定其对松杉球壳孢的抑菌效果,设定空白对照(PBS,10 mmol/L pH=7.5)。
为验证60%和90%饱和度的硫酸铵得到的沉淀为粗蛋白,在上述发酵液肽类粗提物中加入胃蛋白酶(终质量浓度为1 g/L,pH=2.0)37 ℃处理2 h。将上述胃蛋白酶水解液pH调至8,将胃蛋白酶水解液与PDA培养基以体积比1∶5的比例混合,测定其对松杉球壳孢的抑菌效果,设定空白对照(PBS,10 mmol/L pH=7.5)。
1.5 瓦雷兹芽孢杆菌FZB42定殖相关生物学性状检测
将瓦雷兹芽孢杆菌FZB42单菌落接种于LB液体培养基中,置于摇床30 ℃过夜培养,将OD600调至0.5,备用。
在96孔板中分别加入198 μL的MSGG液体培养基和2 μL上述瓦雷兹芽孢杆菌FZB42菌液,设定200 μL MSGG液体培养基作为空白对照,置于培养箱中30 ℃静置培养48 h。培养结束后,使用蒸馏水清洗96孔板3次后将其吸出,加入0.1%的结晶紫溶液染色30 min。染色结束后,吸去培养板中的结晶紫溶液,加入10%的醋酸溶液处理30 min,溶解与生物膜结合的结晶紫,利用酶标仪测定各孔在570 nm处的OD值[9]。
在24孔板中分别加入495 μL LB液体培养基和5 μL上述瓦雷兹芽孢杆菌FZB42菌液,设定500 μL LB液体培养基作为空白对照,置于培养箱中30 ℃静置培养48 h。用牙签将24孔培养板上每个孔的悬浮型生物膜挑起并移至2 mL离心管中,晾干后称量每个孔中的生物膜质量。
用高压灭菌后的牙签蘸取瓦雷兹芽孢杆菌FZB42菌液(OD600=0.5)菌液,使用牙签穿刺法分别接种于含0.2%琼脂的LB固体培养基(swimming运动性检测)和含0.7%琼脂的LB固体培养基(swarming运动性检测),避光静置于培养箱中30 ℃培养8~24 h,培养结束后拍照并测量菌落半径[9]。
2 结果与分析
2.1 瓦雷兹芽孢杆菌FZB42体外抑菌活性
如图1所示,与空白对照组相比,瓦雷兹芽孢杆菌FZB42菌液处理组的松杉球壳孢平板出现了明显的抑菌圈,松杉球壳孢的生长受到显著抑制,FZB42对松杉球壳孢的抑制率为43.6%,说明瓦雷兹芽孢杆菌FZB42在体外具有较强的抑制松杉球壳孢生长的活性。
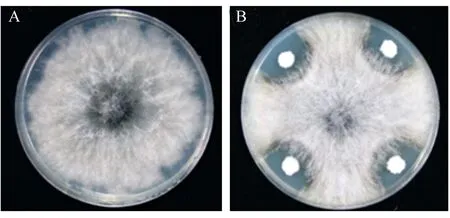
A为空白对照;B为B. velezensis FZB42处理组。
2.2 瓦雷兹芽孢杆菌FZB42发酵液的体外抑菌活性评价
如图2所示,未经FZB42发酵液处理的松杉球壳孢生长良好,FZB42发酵液(Landy培养基,60 h)可显著抑制松杉球壳孢生长,抑制率高达98%。由此推测,FZB42可通过合成分泌某些代谢物抑制松杉球壳孢生长。
通过显微镜观察瓦雷兹芽孢杆菌FZB42发酵滤液对松杉球壳孢菌丝生长的影响,结果如图3所示。对照组菌丝生长良好,经发酵滤液处理1 d,松杉球壳孢菌丝内部出现较小较疏松的空泡,处理2 d后的菌丝表面出现了较明显密集的突起和囊泡,菌丝形态受到严重破坏。

A为CK;B为B. velezensis FZB42 Landy培养基发酵液处理组。
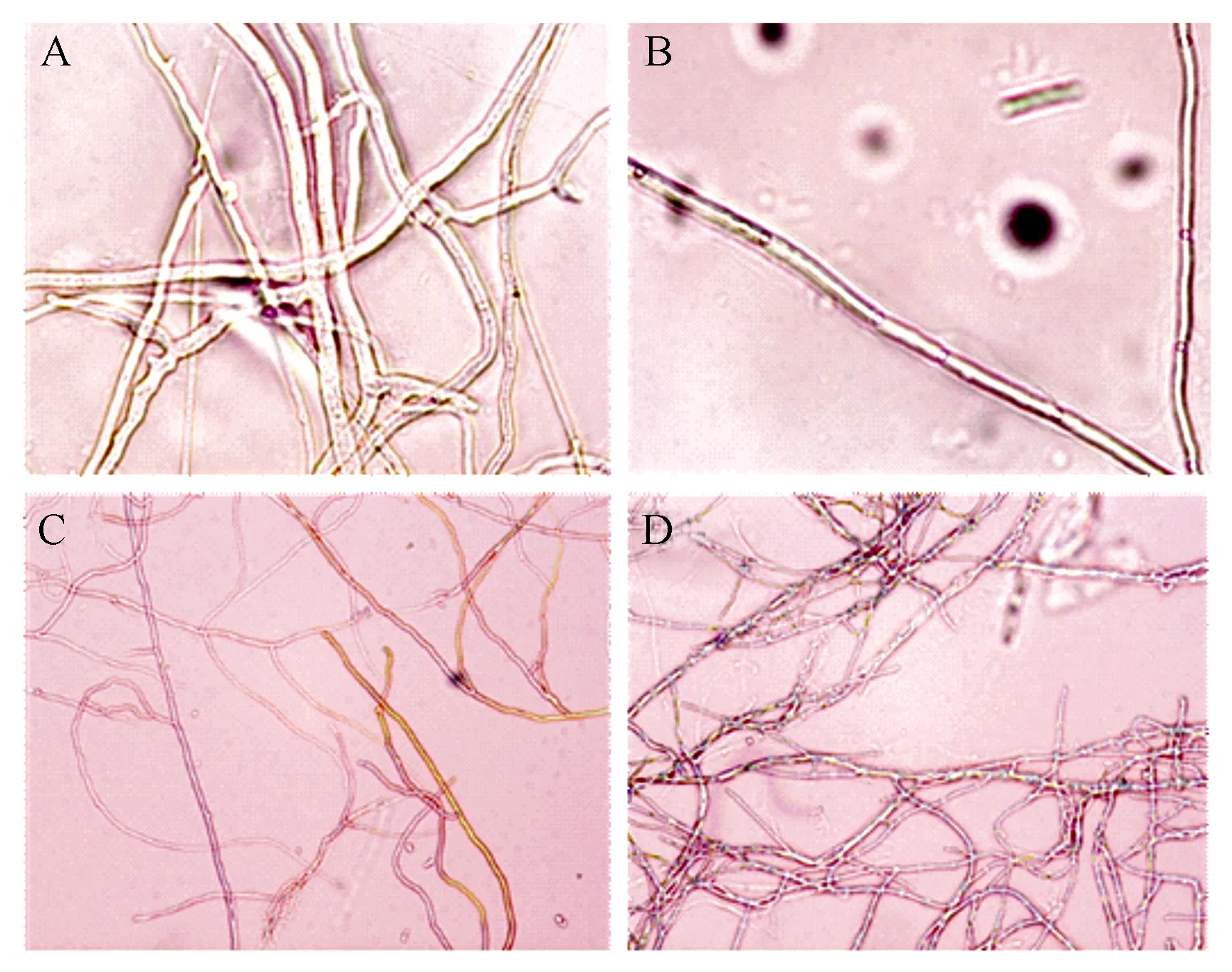
A为CK,400×;B为发酵液处理1 d,400×;C为CK,100×;D为发酵液处理2 d,100×)。
2.3 瓦雷兹芽孢杆菌FZB42发酵液抗菌肽的分离纯化及其抑菌活性
为明确瓦雷兹芽孢杆菌FZB42发酵液中的抑菌物质,采用硫酸铵沉淀法分离肽类物质并对其进行抑菌活性测定,结果如图4和表1所示。结果表明,饱和度为60%和90%的硫酸铵粗提蛋白均能有效抑制松杉球壳孢生长,且两种饱和度硫酸铵粗提蛋白对松杉球壳孢的抑菌率相差不大,60%硫酸铵粗提蛋白的抑菌率为63.7%,90%硫酸铵粗提蛋白抑菌率为62.8%,但均低于FZB42Landy培养基发酵滤液的抑菌率(96.1%)。使用胃蛋白酶水解粗提蛋白后,60%和90%饱和度硫酸铵粗提蛋白液对松杉球壳孢的抑制作用显著减弱,分别降至8.6%和8.7%(表1),可证明硫酸铵粗提蛋白在体外可抑制松杉球壳孢的生长。
2.4 瓦雷兹芽孢杆菌FZB42菌株生物膜形成测定
FZB42在MSGG培养基中形成的生物膜如图5所示。在96孔板中,未加入FZB42菌液的空白对照组为澄清、透明液体,证明试验过程中没有杂菌污染,加入FZB42菌液的每个孔中都形成了有褶皱并且结构致密的细菌生物膜,利用结晶紫染色并通过酶标仪测量CK及试验组OD570分别为0.10和3.27,结果如图5B所示,说明FZB42具有较强的生物膜形成能力。用灭菌牙签挑取FZB42在24孔板中形成的生物膜,烘干并称其质量,生物膜总干质量为1.189 0 g,平均每孔干质量为0.066 g。
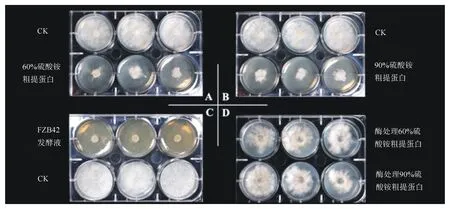
A.60%硫酸铵粗提蛋白对松杉球壳孢的抑制试验;B.90%硫酸铵粗提蛋白对松杉球壳孢的抑制试验;C.FZB42发酵液对松杉球壳孢的抑制试验;D.胃蛋白酶处理粗提蛋白物对松杉球壳孢的抑制试验。

表1 瓦雷兹芽孢杆菌FZB42发酵液及粗蛋白对松杉球壳孢的抑制率
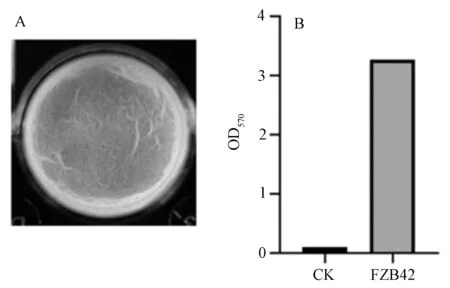
A.FZB42生物膜表面形态,B.FZB42生物膜吸光值。
2.5 瓦雷兹芽孢杆菌FZB42运动性测定
细菌的运动能力与其定殖密切相关。如图6所示,FZB42培养12 h后,FZB42在两种不同琼脂浓度的LB培养基中的菌落半径均为4.25 cm,由此证明FZB42具有很好的swarming运动性和swimming运动性。
3 讨论
芽孢杆菌作为生防细菌最常见的机制之一就是通过分泌次生代谢产物抑制病原菌的生长[10-12]。瓦雷兹芽孢杆菌(Bacillusvelezensis)FZB42是一株具有高效生防性能的土壤细菌。瓦雷兹芽孢杆菌FZB42能够产生多种抑菌化合物,包括聚酮类化合物(bacillaene、difficidin、macrolactin)、脂肽类化合物(bacillomycin D、fengycin、durfactin)及多肽类化合物(plantazolicin、amylocyclicin)等。基因组测序结果分析显示,FZB42含有11个与次级代谢产物合成相关的基因簇,能够通过非核糖体途径及核糖体途径合成脂肽及聚酮类抑菌活性物质[13-15]。
本研究以松树枯梢病的生物防治为切入点,证实瓦雷兹芽孢杆菌FZB42可在体外有效抑制松树枯梢病原菌松杉球壳孢的生长。为确定FZB42的抑菌活性物质,以FZB42 Landy培养基发酵液为研究对象,利用硫酸铵沉淀法分离发酵液中的抑菌物质并对其抑菌活性进行了测定。结果表明,FZB42发酵液中抑制松杉球壳孢生长的活性物质为肽类物质。目前,FZB42抑菌活性物质的研究主要集中于脂肽化合物的抑菌活性及机理研究。Gu等[7]研究发现,FZB42产生的bacillomycin D可引起禾谷镰刀菌(Fusariumgraminearum)细胞质膜和细胞壁的形态学改变,诱导菌体孢内活性氧累积,最终导致菌丝和孢子死亡,而脂肽类化合物表面活性肽能够破坏或者溶解细胞膜,从而抑制菌体生长。然而,在本研究中,通过盐析法从FZB42 Landy培养基发酵液中分离获得粗提蛋白(分子质量>10 ku),并对其抑菌活性进行测定,证实该蛋白粗提物对松杉球壳孢具有良好的抑菌活性。在后续试验中,利用胃蛋白酶水解上述蛋白粗提物并对其抑菌活性进行测定,其抑菌活性显著下降,证实FZB42发酵液中抑制松杉球壳孢生长的物质确为蛋白质或肽类物质,但其结构及氨基酸组成需要通过构建突变株,破坏FZB42的多肽类次生代谢物plantazolicin、amylocyclicin等的合成途径,来判断探究对病原菌松杉球壳孢的抑制作用的贡献者,进一步研究。
生防菌的定殖能力是影响其生防作用发挥的关键因素,生防菌生物膜的形成能力与其定殖能力密切相关[16-18]。生物膜是指细菌通过分泌多糖、蛋白质等大分子物质以连结细菌群体而形成的具有黏附性有组织的膜状结构[19-21]。生物膜能将细胞与细胞紧密连结起来,提高彼此之间的基因转移与交换频率,从而增强其环境适应能力,增加种群多样性。同时,生物膜也是影响细菌定殖能力的关键指标。大量研究表明,细菌的生物膜形成能力与其在寄主植物上的聚集与附着密切相关,且生物膜的形成是一个连续的过程。细菌在物体表面的初始黏附是影响生物膜形成的关键因素,且细菌本身的特性及及鞭毛等结构均会影响菌体生物膜的形成。此外,在细菌生物膜的发育过程中,菌体的运动性也发挥着重要作用。本研究发现,瓦雷兹芽孢杆菌FZB42可在培养液的表面与培养板的壁上形成生物膜。运动性测定试验证明FZB42具有较强的运动能力,这与其生物膜的形成具有密切的关系。
4 结论
本研究从松杉球壳孢的生物防治入手,探索瓦雷兹芽孢杆菌FZB42对松杉球壳孢的抑菌活性,得到如下结论:瓦雷兹芽孢杆菌FZB42在体外可显著抑制松杉球壳孢生长,其Landy培养基发酵液对松杉球壳孢的抑菌率为96.1%。瓦雷兹芽孢杆菌FZB42 Landy培养基中的有效抑菌物质为蛋白质,且其分子质量大于10 ku瓦雷兹芽孢杆菌FZB42具有较强的生物膜形成能力及运动能力,具有良好的定殖潜力。

