梅花鹿KGF的基因克隆及在不同时期顶端茸皮组织的表达分析
郭梦雅 韩若冰 邢海华 张芙蕊 李和平
(东北林业大学 野生动物与自然保护地学院,哈尔滨 150040)
鹿茸是雄性鹿科动物尚未骨化并带有茸毛的幼角,是哺乳动物唯一能够周期性脱落并完全再生的复杂器官。鹿茸具有较高的经济价值,主要表现为药用价值和科学研究价值。我国自古将鹿茸作为传统名贵中药材,认为其具有补肾壮阳、强筋健骨、抗氧化和抗肿瘤等功效。鹿茸可以周期性再生且生长速度快,约为1~2 cm/d,超过了某些癌组织的生长速度。鹿茸独特的生长发育方式有它特殊的物质基础,现阶段已有研究发现由众多基因形成多重的基因网络调控鹿茸各个生长时期的生长发育,这使得鹿茸变成了一个天然的细胞生长因子库,为研究哺乳动物细胞发生、生长与分化提供了理想模型。除此之外,鹿茸再生也被作为再生医学的热点研究模型,对人类再生医学产生深远影响。
角质细胞生长因子(Keratinocyte growth factor,KGF
)又名成纤维细胞生长因子-7(Fibroblast growth factor-7,FGF
-7),是FGF
s 超家族中角质细胞生长因子家族的成员之一。最初由Rubin等从人类胚胎肺成纤维细胞系M426培养的上清液中分离提纯获得,能够促进小鼠角质细胞的有丝分裂,主要通过旁分泌和自分泌的两种方式对各种组织中上皮细胞的增殖分化进行调节。KGF
基因编码的蛋白在机体内有重要的生物学功能,它在人的健康皮肤中弱表达,但在皮肤损伤后的真皮成纤维细胞(DFB
s)中表达强烈上调,从而促进皮肤再上皮化,加速了伤口收缩,也有研究发现KGF促进了大鼠皮肤伤口愈合的血管化作用。现阶段对KGF的研究大多集中在人类医学领域,将其作为一种基因治疗剂来促进各类组织器官的创伤愈合。基于鹿茸生长发育中许多特殊的生理现象与KGF蛋白的生物学功能特点相似,有学者推测KGF
基因可能与茸角周期性再生的起始以及后期的发育息息相关。已有研究克隆了驯鹿和梅花鹿KGF
基因部分启动子区序列,通过比较甲基化水平差异推测其表达水平的高低。郑文静克隆了马鹿KGF
基因,并分析KGF
基因与其他生长因子在转录水平的差异,然而梅花鹿KGF
基因的CDS序列尚未见报道,其作用在鹿茸各生长时期的规律特点尚不明确,前期鹿茸创口愈合后KGF
是否继续发挥其他作用还不清楚,亟需进一步探索。本研究旨在以鹿科典型代表动物——梅花鹿(Cervus
nippon
)为研究对象,以梅花鹿鹿茸生长前期、中期、后期3个不同生长时期的顶端茸皮组织为试验材料,通过克隆得到KGF
基因cDNA的完整编码区序列后进行相关生物信息学分析,并构建系统进化树,为全面了解与鹿茸生长相关的基因奠定基础。同时运用实时荧光定量PCR技术探索KGF
基因在梅花鹿鹿茸顶端茸皮组织3个时期的表达量差异,为进一步研究KGF蛋白在鹿茸生长发育不同时期可能发挥的作用奠定基础,为鹿茸生长发育的分子调控机理的研究和哺乳动物开展组织创伤修复、肿瘤发生及皮肤再生的研究提供科学参考。1 材料与方法
1.1 样品采集
选取哈尔滨市金地鹿业的3头健康成年雄性东北梅花鹿为试验动物,于2018年分别采集其鹿茸生长前期(小鞍子、约30 d)、中期(二杠、约60 d)、后期(三杈、约90 d)的顶端茸皮组织为试验样品,采集后将样品迅速放入灭菌的无RNA酶的冻存管中,置于液氮中保存备用。
1.2 主要试剂
柱式动物RNAout试剂盒(71201),购自北京天恩泽基因科技有限公司;DEPC,购自Sigma公司;2×RapidTaq
Master Mix、DL2 000 DNA Marker购自南京诺唯赞生物科技有限公司;反转录试剂盒(RR047A)、pMD18-T 载体、大肠杆菌DH5α感受态细胞、核酸染料、荧光定量PCR试剂盒(RR820A)、琼脂糖凝胶纯化回收试剂盒(9762)购自TaKaRa公司;琼脂糖,购自Gigco公司。1.3 总RNA的提取及cDNA合成
将样品在盛有液氮的研钵中彻底粉碎,粉碎后的样品根据柱式动物RNAout试剂盒说明书按步骤提取样品的总RNA并纯化,用琼脂糖凝胶电泳检测总RNA的完整性,同时用紫外分光光度计检测提取总RNA的浓度和纯度。之后将所得RNA按照PrimeScrip RT reagent Kit with gDNA Eraser反转录试剂盒说明书反转录为cDNA。反转录反应分为两步,第一步去除基因组DNA,反应体系:5×gDNA Eraser Buffer 2.0 μL,gDNA Eraser 1.0 μL,Total RNA 2.0 μL,ddHO 5.0 μL,总体系 10.0 μL,反应条件:42 ℃ 2 min。第二步合成cDNA第一条链,反应体系:步骤一反应液 10.0 μL,Prime Script RT Enzyme MixⅠ 1.0 μL,RT Primer Mix 1.0 μL,5×Prime Script Buffer2 4.0 μL,ddHO 4.0 μL,总反应体系20.0 μL,反应条件:37 ℃ 15 min,85 ℃ 5 s,将cDNA置于-20 ℃冰箱保存备用。
1.4 梅花鹿KGF基因的扩增与克隆
1
.4
.1
引物设计与合成参考Genebank数据库中白尾鹿(Odocoileus
virginianus
)、牛(Bos
taurus
)、羊(Ovis
aries
)等同源物种KGF
基因的mRNA序列中的CDS区上、下游设计引物。利用Oligo7软件设计的引物序列如下:上游引物KGF
F,5′ATGCGCAAATGGATACTGACATGGAT3′;下游引物KGF
R,5′CTCCCTGCTGGAACTGGTTTCT3′。1
.4
.2
KGF
基因扩增与克隆以梅花鹿茸皮组织cDNA作为模板,KGF
F和KGF
R为上、下游引物,经PCR反应后回收目的基因扩增产物,将其与PMD18-T载体在16 ℃连接1 h 后转化至大肠杆菌DH5α感受态细胞中,在含有Amp、IPTG、X-gal的LB固体培养基上37 ℃培养14~18 h后进行蓝白斑筛选,挑取白色菌落至含有Amp的LB液体培养基中,37 ℃、120 r/min摇菌培养8 h,经菌液PCR验证阳性克隆。1.5 梅花鹿KGF基因序列测定
将克隆成功的菌液送往生物公司进行双向测序,得到的测序结果先应用DNAStar中的Seqman模块对测序峰图进行查看校准,然后通过ORFfinder进行开放阅读框查询后获得准确的cDNA编码区序列,最后将其翻译为氨基酸序列展开生物信息挖掘。
1.6 梅花鹿KGF基因的生物信息学分析
通过Blast功能对测序结果进行比对验证,同时对目的基因在各物种间的相似性进行初步分析。将测序得到的KGF
基因的编码区翻译为氨基酸序列,分别利用ExPASy在线服务器中的ProtParam程序、TMpred程序、Swiss-Model程序对KGF
基因编码蛋白的理化性质、跨膜结构、三级结构进行预测分析。用在线软件SOPMA和SignalP-5.0 Server对KGF
基因编码蛋白的二级结构和信号肽进行预测。在NCBI网站下载白尾鹿(Odocoileus
virginianus
)、马鹿(Cervus
elaohus
)、羊(Ovis
aries
)、牛(Bos
taurus
)、野猪(Sus
scrofa
)、人(Homo
sapiens
)等8个物种KGF蛋白的氨基酸序列,用MEGA6软件构建N-J系统进化树。1.7 实时荧光定量PCR检测
对梅花鹿KGF
基因进行实时荧光定量分析,以3个时期的茸皮组织cDNA为模板,以β
-actin
为内参基因,在Primer5.0软件中按照测序得到的KGF
基因编码区序列设计相应的荧光定量PCR引物。引物序列如下:qKGF
F,5′TGACTCCAGAGCAAATGGCTA3′;qKGF
R,5′ TGCCTCGTTTATCAATCCTCA3′;β
-actin
F,5′GCGTGACATCAAGGAGAAGC3′;β
-actin
R,5′GCAAGGACGGCTGCAAGA3′。荧光定量PCR的反应体系为:TB green 10 μL,上、下游引物各0.8 μL,ROXⅡ 0.4 μL,cDNA模板2 μL,ddHO 6 μL,总体系为20 μL。试验中对3个个体3个时期模板中的KGF
基因和内参基因均设置3个重复和3个空白对照,保证试验数据的准确性。1.8 实时荧光定量数据处理与分析
利用ABI 7 500 software软件计算定量所有目的基因和内参基因β
-actin
的平均拷贝数,在Excel中用2法计算不同基因在不同组织中mRNA的相对表达量,其中以KGF
基因在梅花鹿茸皮组织生长前期的表达量为对照组。使用SPSS Statistics 24.0软件对荧光定量PCR所得数据进行单因素方差分析,方差分析结果用GraphPad Prism 6.04 软件绘制柱形图。2 结果与分析
2.1 梅花鹿KGF基因克隆
对提取的总RNA进行1%琼脂糖凝胶电泳并利用紫外分光光度计检测,结果表明,3个时期中的总RNA完整且浓度和纯度合格,达到后续实验要求。
根据设计引物的最佳退火温度扩增梅花鹿KGF
基因,经1%琼脂糖凝胶电泳检测后切取该基因的目的条带进行回收纯化后克隆,对克隆产物进行阳性检测(图1)。根据电泳图的扩增效果判断引物特异性良好,获得大小为623 bp的单一明亮的目的条带,与预期片段大小一致。随机选取3份克隆成功的菌液进行双向测序,得到包含cDNA完整编码区在内的大小为623 bp的基因序列,与引物设计时预期的片段大小一致。在NCBI上通过与其他同源物种进行Blast比对,确认此序列为梅花鹿KGF
基因的cDNA序列,证明测序结果正确。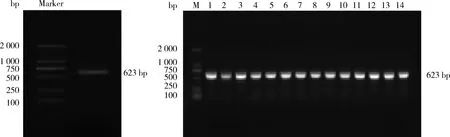
M:DL2 000; 1~14:克隆产物阳性鉴定。 M: DL 2 000; 1-14: Positive results of the cloning products.图1 梅花鹿KGF基因PCR扩增Fig.1 PCR amplification of KGF gene from sika deer
2.2 梅花鹿 KGF基因生物信息学分析
2
.2
.1
KGF
基因编码蛋白质理化性质预测对梅花鹿KGF蛋白的理化性质进行预测,通过ORFfinder进行开放阅读框查询后得到cDNA编码区全长为585 bp,共编码194个氨基酸,其中赖氨酸占比最高,为9.3%;蛋白质相对分子量为22 489.17;理论等电点pI为9.35;脂肪系数为76.39;含有酸性氨基酸19个,碱性氨基酸30个;分子式为:CHNOS,总原子个数为3 154;不稳定系数为48.17;亲水性平均值为-0.441;预测结果显示该蛋白是不稳定的亲水蛋白。
2
.2
.2
信号肽与跨膜结构预测信号肽预测结果显示梅花鹿KGF蛋白可能具有信号肽,切割位点为31~32:SLA~CN;对KGF蛋白跨膜区进行预测,结果显示在氨基酸4~32位点从内到外及13~32位点从外到内螺旋的得分分别为1 406分和1 421分,均>500分,结果说明其具有跨膜结构基础,由此推测KGF蛋白是跨膜蛋白。
2
.2
.3
KGF
基因编码蛋白质空间结构预测对梅花鹿KGF蛋白的二级结构进行预测,结果显示α-螺旋有51个,占全部蛋白的26.29%;延伸连有41个,占全部蛋白的21.13%;β-转角有22个,占全部蛋白的11.34%;无规则卷曲有80个,占全部蛋白的41.24%。利用ExPASy在线服务器中Swiss-Model同源结构建模的方法对梅花鹿KGF蛋白的三级结构进行预测(图2),结果显示序列与模板的相似度达到97.14%。
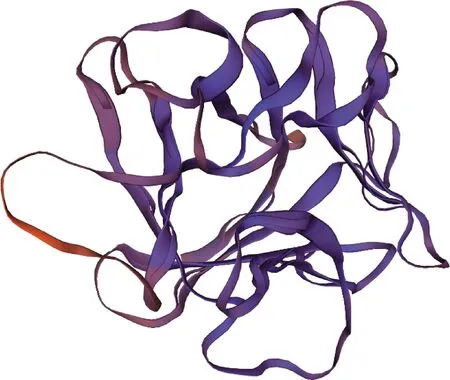
图2 梅花鹿KGF基因编码蛋白空间结构预测图Fig.2 Structure prediction of encoding protein of sika deer KGF gene
2
.2
.4
氨基酸序列同源性比对与系统进化树构建克隆成功后,将梅花鹿KGF蛋白的氨基酸序列在Genebank中进行Blastp功能比对。结果显示:梅花鹿KGF蛋白与马鹿(Cervus
elaphus
)、白尾鹿(Odocoileus
virginianus
)、牛(Bos
taurus
)、野牛(Bison
bison
)、山羊(Capra
hircus
)的相似性均在99%以上,其次为野猪(Sus
scrofa
)97%。通过NCBI网站搜索、下载白尾鹿(Odocoileus
virginianus
)、马鹿(Cervus
elaphus
)、山羊(Capra
hircus
)、牛(Bos
taurus
)、野猪(Sus
scrofa
)和人(Homo
sapiens
)等8个物种KGF蛋白的氨基酸序列,将下载好的序列导入MEGA6软件构建N-J系统进化树(图3)。进化树结果表明梅花鹿KGF蛋白与马鹿(Cervus
elaphus
)KGF蛋白的亲缘关系最近。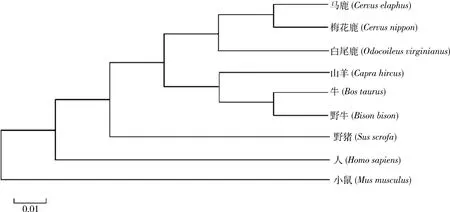
图3 梅花鹿KGF蛋白的系统进化树构建Fig.3 Phylogenetic tree construction of sika deer KGF protein
2.3 KGF基因在梅花鹿不同时期顶端茸皮组织中的表达
KGF
基因和内参基因β
-actin
扩增曲线基线平整,拐点清晰,呈S型且指数期明显,符合实验要求;溶解曲线峰值单一且重合性较好,表明Ct值可靠,能正确表示基因的表达情况。荧光定量结果(图4)表明KGF
基因在梅花鹿生长发育不同阶段的茸皮组织中均有表达且表达量存在差异,在中期的表达量最高,后期次之,前期的表达量最低。以KGF
基因在梅花鹿茸皮组织生长前期的表达量为对照组,通过2法计算得到KGF
基因在梅花鹿茸皮组织生长中期的表达量是前期的(2.158 5±0.014 1)倍;后期的表达量是前期的(1.728 5±0.225 3)倍。前期与中期的表达量、前期与后期的表达量存在显著差异(P
<0.05);中期与后期的表达量差异不显著(P
>0.05)。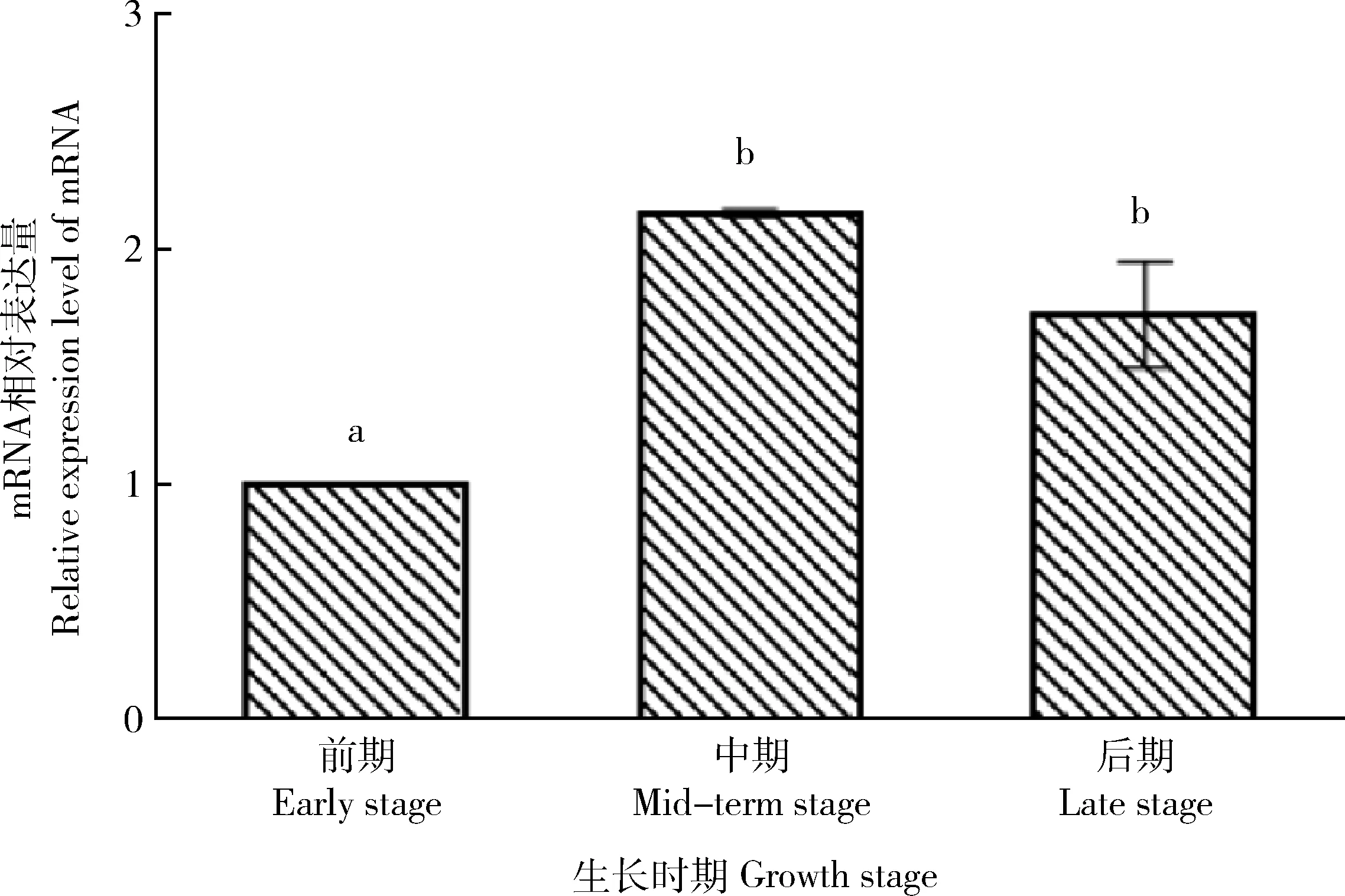
柱标中不同小写字母表示差异显著(P<0.05)。 Different lowercase letters in the column mark indicate significant difference (P<0.05).图4 梅花鹿KGF基因在不同时期顶端茸皮组织中的表达量分析Fig.4 Analysis of KGF gene expression level in the different stages of skin tissue at the tip of sika deer
3 讨 论
鹿茸的再生与生长发育是鹿茸研究领域的热点话题,其独特的生长发育特点和重要的药用价值受到国内外学者的广泛关注。顶端组织是其生长分化的中心,该处组织是生长因子和其它很多活性成分含量较高的部位。目前相比于对鹿茸间充质层的研究,对茸皮层的研究较少,然而鹿茸的再生起始于鹿角脱落后角柄残桩处茸皮的再生性伤口愈合,表现为鹿茸中心组织向内生长推进的同时,茸皮呈环状向中心迁移,直至自伤口愈合,之后在鹿茸快速生长过程中茸皮以同样的速度生长,对鹿茸再生有重要的辅助作用。故本研究采用梅花鹿鹿茸顶端的茸皮组织作为试验材料,克隆KGF
基因并进行相关的生物信息学分析,对鹿茸再生机制和快速生长、增殖特点的探索具有一定的价值。本研究成功克隆获得了梅花鹿KGF
基因cDNA完整的编码区序列,经Blastp功能比对发现梅花鹿KGF
基因与白尾鹿、马鹿的相似性最高,为99.8%,与其他物种KGF
基因的相似性均高于90%,表明KGF
基因在哺乳动物的进化过程中高度保守。郑文静克隆出的马鹿KGF
基因的CDS序列片段大小与梅花鹿的相同,该基因在梅花鹿和马鹿之间高度同源,与本研究所构建系统进化树结果一致。已有研究发现人KGF
基因编码的蛋白由194个氨基酸组成,包括一段由21个氨基酸组成信号肽与一潜在的天冬氨酸结合的糖基化位点,这一结果与本研究预测梅花鹿KGF
基因存在信号肽相一致。KGF蛋白是一种具有跨膜结构的亲水蛋白,推测该理化性质与蛋白的功能相关。综上,本研究对梅花鹿KGF蛋白的预测结果对未来研究梅花鹿KGF蛋白功能有一定的帮助。鹿茸生长有明显的季节性,整体生长规律呈典型的S曲线。鹿茸角在春季脱落后,随着角柄处“芽基”、上皮组织及生长中心的形成开始进入生长前期(30 d左右),中期(60 d左右)是生长最旺盛的时期,后期(90 d左右)生长逐渐放缓并开始进入骨化期。已有研究证实生长因子在组织损伤修复过程中扮演重要角色,能够通过调控有丝分裂、细胞的趋化、细胞外基质的合成以及血管生成,进而调控组织损伤修复。KGF
基因作为重要的生长因子,其编码的蛋白可以通过诱导上皮细胞增殖,促进角质化细胞从伤口边缘移行至基质,从而加快真皮和表皮再生及新生血管形成。孙佳阳研究发现在梅花鹿茸皮组织的3个生长时期中,KGF
基因的甲基化水平在前期较低,而在中期和后期均未出现甲基化,由此推测KGF
基因在茸皮组织中出现的这种低甲基化高表达的现象与鹿茸的生长发育密切相关,这一推测在本研究中得到证实。刘海龙在梅花鹿快速生长期的鹿茸顶端组织中通过转录组测序分析发现,相对于鹿茸生长至第10 天的表达量,KGF
基因在60 d的表达量显著上调,与本研究结果一致。杨永刚等研究表明,在鹿茸的快速生长期,茸皮中促进组织进行损伤修复的基因发生显著上调,这种变化将有利于鹿茸损伤后创口的愈合及新鹿茸的再生。本研究通过荧光定量PCR实验表明KGF
基因在梅花鹿鹿茸的茸皮组织中不同时期表达量由高到底的顺序为:中期>后期>前期,与鹿茸的生长快慢正相关,可能是由于在快速生长期的局部调控作用更复杂,进一步证明KGF蛋白在鹿茸再生和生长发育过程中发挥重要作用。4 结 论
本研究成功克隆了梅花鹿KGF
基因,其编码区全长为585 bp,共编码194个氨基酸;KGF蛋白是有信号肽和跨膜结构的不稳定的亲水蛋白;该基因在生物进化上高度保守且与偶蹄目动物相似性较高。KGF
基因的mRNA表达量在梅花鹿鹿茸顶端茸皮组织前期与中期、前期与后期差异显著,在中期与后期差异不显著。本研究对梅花鹿KGF蛋白的结构及功能有了进一步的认识和预测,为研究梅花鹿鹿茸组织生长机理奠定了基础,提供了一定的理论依据,之后可进一步研究鹿茸顶端组织不同层之间KGF
基因的表达量情况并设计试验对KGF
基因在鹿茸生长过程中的具体作用机制进行功能验证,以期为研究鹿茸生长发育和再生的分子调控机理提供有价值的参考。
