ETT2转录因子EivF调控禽致病性大肠杆菌运动性和环境胁迫耐受性
吴剑梅 傅丹丹 李佳璇 邵颖 宋祥军 涂健 祁克宗




摘要:為探究禽致病性大肠杆菌(Avian pathogenic Escherichia coli, APEC)中大肠杆菌Ⅲ型分泌系统(Escherichia coli Type Ⅲ secretion system2, ETT2)转录因子EivF的功能,通过透射电镜观察检测野生株(AE81)、缺失株(AE81△eivF)和回复株(AE81△eivF-comp) Curli菌毛的合成能力,并探究3种菌株在不良环境中的存活情况,通过RT-qPCR检测鞭毛和环境耐受相关基因的转录水平。结果表明,与野生株相比,缺失株的curli菌毛合成能力无明显变化,在透射电镜下缺失株鞭毛数量明显减少,缺失株在强酸、强碱、氧化应激、高温、高渗环境中的存活率均显著(P<0.05)或极显著(P<0.01)降低,回复株上述表型基本恢复。转录组数据显示,缺失株的flgB、flgC、flgE等鞭毛相关基因和proV、cadA等环境耐受相关基因的转录水平下调。RT-qPCR结果显示,flgB、flgC、flgE、proV等基因的转录水平下调。综上所述,ETT2转录因子EivF参与调控禽致病性大肠杆菌运动能力和在不良环境中的存活能力。
关键词:禽致病性大肠杆菌;ETT2转录因子EivF;鞭毛;环境胁迫
中图分类号:S858.351+.2文献标识码:A文章编号:1000-4440(2022)02-0438-08
Regulation of ETT2 transcription factor EivF on avian pathogenic Escherichia coli motility and tolerance to environmental stress
WU Jian-mei, FU Dan-dan, LI Jia-xuan, SHAO Ying, SONG Xiang-jun, TU Jian, QI Ke-zong
Abstract:To investigate the function of transcription factor EivF of Escherichia coli Type Ⅲ secretion system2 (ETT2) in avian pathogenic E. coli (APEX), the synthetic ability for Curli pili of wild strain (AE81), deleted strain (AE81△eivF) and revertant strain (AE81△eivF-comp) were detected by transmission electron microscopy, and the survival condition of three strains in adverse environment was investigated. The transcriptional levels of flagella and environmental tolerance related genes were detected by RT-qPCR. The results showed that, there was no significant change in Curli pili synthetic ability of the deleted strain compared with the wild strain. The flagella number of deleted strain (AE81△eivF) decreased significantly under transmission electron microscope. The survival rates of deleted strain under the environments of strong acid, strong alkali, oxidative stress, high temperature and hyperosmotic pressure were significantly(P<0.05)or extremely significantly (P<0.01) decreased, and the above phenotype was basically restored in the revertant strain. Transcriptome data showed that, the transcriptional levels of flagellum-related genes such as flgB, flgC, flgE and environmental tolerance related genes such as proV, cadA were down-regulated in the deleted strains. The results of RT-qPCR showed that, the transcriptional levels of flgB, flgC, flgE, proV and other genes were down-regulated. In conclusion, the ETT2 transcriptional factor EivF is involved in the regulation of motor ability and survival ability of avian pathogenic E. coli in adverse environments.
Key words:avian pathogenic Escherichia coli;ETT2 transcription factor EivF;flagella;environmental stress
禽致病性大肠杆菌(Avian pathogenic Escherichia coli, APEC)属于肠外致病性大肠杆菌(Enterotoxigenic Escherichia coli, ExPEC),常与其他病原混合感染引起禽类细菌性疾病或死亡,主要临床症状有腹膜炎、输卵管炎、慢性呼吸道疾病和败血症等[1-2]。APEC血清型众多,且不同血清型、不同菌株之间缺乏交叉免疫,给养殖业造成巨大的经济损失[3]。研究发现,APEC与脑膜炎大肠杆菌(Necrotoxigenic Escherichia coli, NMEC)有相似的遗传因子,是人源肠外致病性大肠杆菌毒力基因的贮存库[4],因此开展APEC致病机制相关的研究对防控APEC引起的疾病具有重要的公共卫生学意义。
大肠杆菌Ⅲ型分泌系统(Escherichia coli type Ⅲ secretion system2, ETT2)首次在肠出血性大肠杆菌(Enterohemorrhagic Escherichia coli,EHEC)O157:H7中发现[5]。ETT2的基因簇包含5个转录因子,分别是YqeI(ECs_3704)、YgeH(ECs_3709)、YgeK(ECs_3712)、EtrA(ECs_3720)和EivF(ECs_3734)[6]。轉录因子YgeK直接与EHEC的ler调控区相互作用,激活肠细胞脱落位点 LEE 毒力岛表达,促进黏附及擦拭性损伤(Attaching and effacing lesions,A/E Lesions)形成[7]。在肠聚集菌株042中,转录因子YgeH诱导了invF的表达[8]。etrA基因缺失显著降低了APEC菌毛的表达量、在巨噬细胞中的存活能力以及在鸭中的增殖能力和毒力[9]。同时ETT2转录因子还能够参与调控细菌生物被膜形成、运动鞭毛组装、抗血清杀菌、调节肠细胞脱落位点(LEE)毒力岛分泌等致病过程[10-12]。转录因子EivF位于ETT2 eiv侵袭基因簇最末端[13],与沙门氏菌 SPI-1毒力岛核心转录调控基因invF同源。研究发现,在EHEC O157:H7中,缺失EivF导致细菌LEE毒力岛编码的蛋白质分泌量大幅增加,细菌对人肠细胞的黏附力增加[14]。
鞭毛是APEC的毒力因子,是细菌蛋白质输出装置,控制细菌的运动和行为[15]。研究发现,KdpD/KdpE双组分系统、转录调节因子ArcA、群体感应系统等多种调控因子影响APEC鞭毛组装过程[15-17]。APEC在入侵和定殖机体的过程中,会经过机体的高氧、强酸等不良环境,细菌通过调节相关基因从而适应不良环境,增强其存活能力[18-19]。PhoR/PhoB双组分系统、转录因子IbeR等参与调控APEC对环境胁迫的耐受[18,20]。EivF是ETT2毒力岛重要的转录因子,在鞭毛组装和环境胁迫耐受等过程中扮演的作用尚未见报道。
本研究以APEC ETT2转录因子eivF基因为研究对象,基于转录组数据分析EivF参与调控的细菌信号通路,通过透射电镜、环境耐受和荧光定量PCR等试验,探究eivF基因调控APEC运动和响应环境胁迫的能力,为深入研究禽致病性大肠杆菌致病机制提供研究基础。
1材料与方法
1.1材料
1.1.1菌株禽致病性大肠杆菌AE81菌株为本实验室保存的临床分离株,缺失株AE81△eivF和回复株AE81△eivF-comp由本实验室构建和保存[12]。
1.1.2主要试剂和仪器酵母浸粉、胰蛋白胨、三羟甲基氨基甲烷(Tris)、刚果红、考马斯亮蓝购自生工生物工程(上海)股份有限公司,氯化钠购自国药集团化学试剂有限公司,琼脂粉购自索莱宝科技有限公司,RNA裂解液、HiScriptⅢ RT SuperMix for qPCR、AceQ qPCR SYBR Green Master PCR Master Mix购自诺唯赞生物科技有限公司,超净工作台(型号SW-CJ-2F)购自苏州设备进化有限公司,恒温培养箱(型号DHP-9082)购自上海一恒科技有限公司,ViiATM 7 Real-time PCR仪购自赛默飞世尔科技公司。
1.2基于转录组学测序筛选差异基因
本实验室前期获得AE81和AE81△eivF转录组数据[12]。使用Bowtie2比对软件(http://bowtie-bio.sourceforge.net/Bowtie2/index.shtml)将clean reads与Escherichia coli O157:H7 str. Sakai参考基因进行比对,使用RSEM软件包(http://deweylab.biostat.wisc.edu/RSEM)计算基因的表达水平。使用possionDis 差异分析方法检测样品之间的差异表达基因(DEGs),对差异表达基因进行 GO 分析和KEGG通路分析。
1.3透射电镜观察
将野生株AE81、缺失株AE81△eivF和回复株AE81△eivF-comp培养至对数生长期,取5 ml菌液,用无菌滤膜过滤,再用磷酸盐缓冲液(PBS)洗涤2次,加入等体积PBS重悬。铜网正面覆盖在菌液表面,静置约2 min,滴加磷钨酸负染液,用滤纸吸干铜网表面多余样品,然后将铜网覆在负染液上,负染2~3 min,再用滤纸吸取多余的染液,烘干铜网,用透射电镜观察拍照。
1.4红色、干燥、粗糙(rdar)表型的观察
将野生株AE81、缺失株AE81△eivF和回复株AE81△eivF-comp于37 ℃静置培养至对数生长期,用PBS洗涤菌液2次,再用PBS重悬,浓缩至OD600为3.0。按参考文献[21],配制CR培养基(刚果红 0.008 g,考马斯亮蓝 0.004 g,蛋白胨 2.000 g,酵母粉1.000 g,琼脂粉 1.600 g,200 ml ddH2O)。取1 μl菌液滴于刚果红(CR)培养基上,37 ℃培养48 h,观察菌落形态。
1.5环境耐受试验
将野生株AE81、缺失株AE81△eivF和回复株AE81△eivF-comp培养至对数生长期,用PBS洗涤2次,重悬备用。分别检测野生株、缺失株及回复株在酸性、碱性、氧化、高渗透压和高温不利环境中的存活情况。
1.5.1耐酸试验用乙酸(HAC)溶液调节LB培养基pH至4.0。将菌液与酸性培养基等体积混合,37 ℃培养30 min。用PBS进行10倍梯度稀释,挂板于LB固体培养基平板上,37 ℃过夜培养,次日进行菌落计数,比较3株菌存活情况。
1.5.2耐碱试验菌液与Tris-HCl缓冲液(100 mmol/L,pH=10.0) 等体积混匀后,于37 ℃作用30 min。梯度稀释后挂板于LB固体培养基平板上,于37 ℃过夜培养后,进行菌落计数。
1.5.3氧化应激试验菌液与10 mmol/L H2O2溶液等体积混合,37 ℃培养20 min。用PBS进行10倍梯度稀释,滴板于LB固体培养基平板上,37 ℃过夜培养后,进行菌落计数。
1.5.4渗透压试验菌液与等体积的NaCl溶液(4.8 mol/L)混匀后,37 ℃作用60 min。用PBS进行10倍梯度稀释,滴板于LB固体培养基平板上,37 ℃过夜培养后,进行菌落计数。
1.5.5耐热试验菌液于54 ℃作用3 min。用PBS稀释到一定梯度后滴板于LB固体培养基平板上,37 ℃过夜培养后,进行菌落计数。
1.6实时荧光定量PCR检测鞭毛和环境胁迫相关基因转录量
1.6.1设计引物根据GenBank中已发布的内参基因16S rRNA,选取环境耐受相关基因cadA、cadB、cadC、adiA、adiC、gadA、gadC、proV和鞭毛组装相关基因flgB、flgC、flgE,用Primer Premier 5软件分析并设计特异性引物,引物序列见表1。
1.6.2总RNA提取和cDNA合成将AE81、AE81△eivF和AE81△eivF-comp 3株菌培养至对数生长期,取1 ml菌液于12 000 r/min离心15 min,弃上清液,加入1 ml RNA isolater吹打混匀,再加入200 μl三氯甲烷剧烈振荡15 s,4 ℃静置5 min,12 000 r/min離心15 min,吸取上清液,加入等体积的异丙醇,上下颠倒混匀,4 ℃静置10 min,12 000 r/min离心10 min,弃上清液,加入1 ml 去RNA酶的75%乙醇,上下颠倒混匀并室温静置3~5 min,12 000 r/min离心5 min,弃上清液,开口干燥3~5 min,加入30 μl RNase-free H2O溶解,-80 ℃保存备用。将AE81、AE81△eivF和AE81△eivF-comp 3株菌培养至对数生长期,用PBS洗涤2次,加入等量的酸性LB培养基(pH=4.0),37 ℃静置共培1 h。按上述方法提取细菌mRNA,-80 ℃保存备用。使用反转录试剂HiScriptⅢ RT SuperMix for qPCR,按试剂盒说明书进行反转录,-20 ℃保存备用。
1.6.3荧光定量PCR以16S rRNA为内参基因,用AceQ qPCR SYBR Green Master Mix荧光定量试剂盒检测各菌株cadA、cadB、adiA、proV等基因的表达水平。RT-qPCR 反应体系(10 μl):2×Taq PCR Master Mix 5.0 μl,cDNA 1.0 μl,上、下游引物(10 μmol/L)各0.2 μl,ddH2O 3.6 μl。PCR 反应条件:预变性95 ℃ 5 min;95 ℃ 10 s,60 ℃ 30 s,40个循环;熔解曲线95 ℃ 15 s,60 ℃ 60 s,95 ℃ 15 s。每株菌进行3次重复。数据采用 2 -△△Ct 法计算上述基因的mRNA转录水平。
1.7数据统计分析
利用GraphPad Prism 5软件分析数据,采用t检验法对试验数据进行分析。
2结果与分析
2.1转录组学差异基因分析
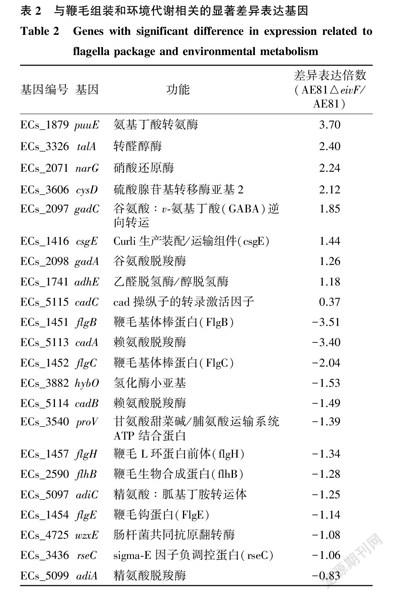
以差异倍数(Fold Change)≥2为筛选标准,分析显著差异表达基因。与AE81相比,缺失株AE81△eivF有576个基因差异表达,其中上调表达基因368个,下调表达基因208个。KEGG信号通路分析发现EivF参与调控细菌多个信号通路,其中参与鞭毛组装和微生物在不良环境中代谢这2条信号通路的基因表达差异显著。筛选转录组数据中与之相关的差异表达基因,发现与鞭毛组装相关基因均下调表达,在不良环境中微生物代谢相关基因以下调表达为主(表2)。
2.2eivF基因对禽致病性大肠杆菌AE81鞭毛微观形态的影响
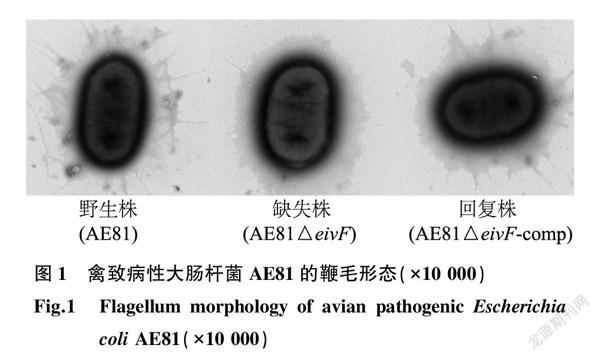
透射电镜观察结果(图1)显示,野生株(AE81)鞭毛数量多且长,结构完整;而缺失株(AE81△eivF)鞭毛数量明显减少,只有几根;回复株(AE81△eivF-comp)鞭毛数量基本恢复至野生株水平。表明转录因子EivF参与APEC鞭毛的形成。
2.3禽致病性大肠杆菌AE81的rdar(红色、干燥、粗糙)形态
如图2所示,在CR培养基上,AE81、AE81△eivF和AE81△eivF-comp 3种菌株菌落形态均无差异,均呈现rdar(红色、干燥、粗糙)表型,说明这3株菌产生Curli菌毛和纤维素[22],缺失eivF基因不会影响AE81菌毛和纤维素合成的能力。
2.4转录因子EivF对禽致病性大肠杆菌AE81环境耐受能力的影响
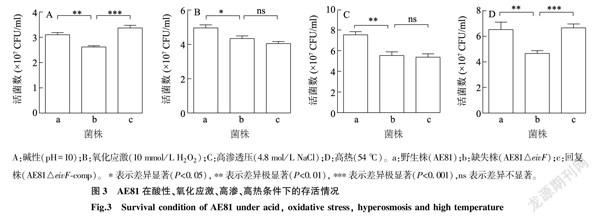
如图3所示,在碱性(pH=10)、氧化应激(10 mmol/L H2O2)、高渗透压(4.8 mol/L NaCl)、高热(54 ℃)环境中AE81的存活率显著(P<0.05)或极显著(P<0.01)低于野生株,碱性、高热环境下回复株的存活率有所回升,表明转录因子EivF影响APEC的环境耐受能力。
2.5转录因子EivF对 APEC抗酸能力的影响
在酸胁迫下,与野生株AE81比较,缺失株AE81△eivF存活率(活菌数)极显著降低(P<0.001),回复株有所回升;RT-qPCR结果显示,在酸胁迫下耐酸基因adiA、adiC、cadA、cadB均下调表达,cadC、gadA、gadC均上调表达(图4)。表明转录因子EivF影响APEC的耐酸能力。
2.6转录因子EivF的缺失对AE81鞭毛和环境耐受基因转录水平的影响
3讨论
APEC作为典型的肠道外致病菌,具有促使细菌远离外界不利环境的运动系统,还具备抵抗外界不良环境的能力。ETT2是大肠杆菌重要的毒力岛,其转录因子参与调控LEE毒力岛基因的表达[7,14],目前还未见ETT2转录因子EivF对APEC鞭毛组装和不良环境存活影响的报道。本研究结果表明,缺失ETT2毒力岛的转录因子eivF基因将减弱APEC鞭毛的形成能力,降低其在不良环境中的存活率。本研究初步探讨了转录因子EivF对APEC运动能力及环境耐受的影响,研究结果可以为深入研究禽致病性大肠杆菌致病机制和禽大肠杆菌病的防治提供参考。
鞭毛是细菌的运动装置,当细菌受到外界刺激时,鞭毛驱使细菌躲避不良环境,同时还能定植于宿主细胞引起感染[23]。ETT2转录因子YqeI影响APEC鞭毛形成能力[15],eivC的缺失导致APEC鞭毛减少[24]。在本研究中,eivF基因不影响细菌rdar形态,影响APEC鞭毛的形态。flgB和flgE基因参与细菌鞭毛组成。flgB是鞭毛复合体MS环上亚基,介导从MS环到杆的扭矩传递,可克服电机旋转结构和螺旋结构之间的对称不匹配[25];flgE参与编码鞭毛环蛋白[26]。转录组数据中与鞭毛组装相关的基因flgB、flgE、flgH、flgC等的表达量均下调。RT-qPCR结果显示,基因flgB、flgE、flgC也表现出明显下调表达,猜测转录因子EivF可能通过调控flgB、flgE、flgC等基因,进而影响细菌鞭毛组装过程。
细菌在感染过程中,除通过鞭毛运动远离不良环境、定植机体外,还必须快速响应外界环境变化,以促进其在局部微环境或宿主细胞中的适应和生存。本研究结果表明,eivF基因参与APEC在酸性、碱性、氧化应激、渗透压和高温等不良环境中存活情况的调控。转录组数据显示,hybO、wzxE、proV、rseC等均下调表达。hybO基因参与还原型辅酶Ⅱ(NADPH)合成,NADPH在细胞代谢、生物合成和氧化应激反应中起着至关重要的作用[27-28]。proV编码脯氨酸运输系统ATP结合蛋白以应对高渗透条件,增强细菌的存活能力[29-30]。猜测转录因子EivF正调控hybO、wzxE、proV等基因的表达,从而促进APEC在不良环境中存活。
细菌引起机体感染,需要突破机体免疫系统,而这会使细菌暴露在酸性环境中。细菌主要依赖氨酸脱羧酶系统来中和细胞内酸性,快速适应酸性环境[31]。相关研究结果表明,精氨酸/胍丁胺和赖氨酸/1,5-戊二胺系统有助于沙门氏菌适应酸性环境,细菌通过逆向转运体(adiC和cadB)将精氨酸脱羧成胍丁胺和赖氨酸,这个过程消耗细胞中质子,从而调节胞内pH[32]。RT-qPCR结果显示,在酸胁迫条件下,缺失株AE81△eivF的基因adiA、adiC、cadA、cadB表达量下调,而gadA、gadC表达量上调,猜测原因可能是转录因子EivF能够正向调控adiA、adiC、cadA、cadB,进而促进细菌适应酸性环境。本研究初步探讨了转录因子EivF对APEC的鞭毛组装和环境耐受能力的影响,eivF的缺失使得细菌鞭毛数量减少,对不良环境的耐受力减弱。
参考文献:
[1]JOHNSON J R, RUSSO T A. Extraintestinal pathogenic Escherichia coli: “The other bad E.coli” [J]. Journal of Laboratory & Clinical Medicine, 2002, 139(3): 155-162.
[2]WANG S, NIU C, SHI Z, et al. Effects of ibeA deletion on virulence and biofilm formation of avian pathogenic Escherichia coli[J]. Infect Immun,2011,79(1):279-287.
[3]馬兴树,范翠蝶,夏玉龙. 禽致病性大肠杆菌研究进展[J]. 中国畜牧兽医, 2013, 40(2):169-174.
[4]TIVENDALE K A, LOGUE C M, KARIYAWASAM S, et al. Avian-pathogenic Escherichia coli strains are similar to neonatal meningitis E. coli strains and are able to cause meningitis in the rat model of human disease[J]. Infect Immun, 2010,78(8):3412-3419.
[5]PERNA N T, PLUNKETT G, BURLAND V, et al. Genome sequence of enterohaemorrhagic Escherichia coli O157:H7[J]. Nature, 2001,409(6819):529-533.
[6]尹磊,祁克宗,宋祥军,等. 大肠杆菌Ⅲ型分泌系统2毒力岛研究进展[J]. 微生物学通报, 2017, 44(12):3031-3037.
[7]LUZADER D H, WILLSEY G G, WARGO M J, et al. The type three secretion system 2-encoded regulator EtrB modulates enterohemorrhagic Escherichia coli virulence gene expression[J]. Infection & Immunity, 2016, 84(9):2555-2565.
[8]HTTENER M, DIETRICH M, PAYTUBI S, et al. HilA-like regulators in Escherichia coli pathotypes: the YgeH protein from the enteroaggregative strain 042[J]. Bmc Microbiology, 2014, 14(1):268.
[9]SHAOHUI W, XUAN X, XIN L, et al. Escherichia coli type Ⅲ secretion system 2 regulator EtrA promotes virulence of avian pathogenic Escherichia coli[J]. Microbiology, 2017, 163(10):1515-1524.
[10]肖亞婷,傅丹丹, MUHAMMAD A R,等. Ⅲ型分泌系统2转录因子YqeI对禽致病性大肠杆菌生物被膜调控机制的研究[J]. 畜牧兽医学报, 2019, 50(12):2488-2497.
[11]王泽平,李倩文,尹磊,等. 大肠杆菌三型分泌系统2转录调节子EtrA对禽致病性大肠杆菌致病性的影响[J]. 微生物学通报, 2020(5):1515-1523.
[12]傅丹丹,肖亚婷,薛媚,等. 禽致病性大肠杆菌ETT2转录因子eivF缺失株的生物学特性及转录组学分析[J]. 西北农林科技大学学报(自然科学版), 2020,48(8):28-36.
[13]PRAGER R, BAUERFEIND R, TIETZE E, et al. Prevalence and deletion types of the pathogenicity island ETT2 among Escherichia coli strains from oedema disease and colibacillosis in pigs[J]. Veterinary Microbiology, 2004, 99(3/4):287-294.
[14]ZHANG L, CHAUDHURI R R, CONSTANTINIDOU C, et al. Regulators encoded in the Escherichia coli Type Ⅲ secretion system 2 gene cluster influence expression of genes within the locus for enterocyte effacement in enterohemorrhagic E. coli O157:H7[J]. Infection and Immunity, 2004, 72(12):7282-7293.
[15]XUE M, RAHEEM M A, GU Y, et al. The KdpD/KdpE two-component system contributes to the motility and virulence of avian pathogenic Escherichia coli[J]. Research in Veterinary Science, 2020, 131:24-30.
[16]HELMY Y A,DEBLAIS L,KASSEM I I,et al. Novel small mole- cule modulators of quorum sensing in avian pathogenic Escherichia coli (APEC)[J].Virulence,2018,9: 1640-1657.
[17]JIANG F, AN C, BAO Y, et al. ArcA controls metabolism, chemotaxis, and motility contributing to the pathogenicity of avian pathogenic Escherichia coli[J]. Infection & Immunity, 2015, 83(9):3545-3554.
[18]CRPIN S, LAMARCHE M G, GARNEAU P, et al. Genome-wide transcriptional response of an avian pathogenic Escherichia coli (APEC) pst mutant[J]. BMC Genomics, 2008,9:568.
[19]FLECHARD M, CORTES M, REPERANT M, et al. New role for the ibeA gene in H2O2 stress resistance of Escherichia coli[J]. Journal of bacteriology, 2012, 194(17):4550-4560.
[20]WANG S, BAO Y, MENG Q, et al. IbeR facilitates stress-resistance, invasion and pathogenicity of avian pathogenic Escherichia coli[J]. PLoS One, 2015, 10(3):e0119698.
[21]RMLING U. Characterization of the rdar morphotype, a multicellular behaviour in Enterobacteriaceae[J]. Cellular & Molecular Life Sciences Cmls, 2005, 62(11):1234-1246.
[22]CIMDINS A, SIMM R. Semiquantitative analysis of the red, dry, and rough colony morphology of Salmonella enterica serovar typhimurium and Escherichia coli using Congo Red[J]. Methods Mol Biol, 2017,1657: 225-241.
[23]PR B M. Involvement of two-component signaling on bacterial motility and biofilm development[J]. Bacteriol, 2017,199(18):e00259-17.
[24]WANG S, LIU X, XU X, et al. Escherichia coli Type III secretion system 2 ATPase EivC is involved in the motility and virulence of avian pathogenic Escherichia coli[J]. Front Microbiol,2016,31:1387.
[25]TAN J X, ZHANG X, WANG X F, et al. Structural basis of assembly and torque transmission of the bacterial flagellar motor[J]. Cell, 2021,184(10):2665-2679.
[26]KOMEDA Y, ONO N, KAGAWA H. Synthesis of flagellin and hook subunit protein in flagellar mutants of Escherichia coli K12[J]. Molecular & General Genetics Mgg, 1984, 194(1/2):49-51.
[27]PINSKE C, KRGER S, SOBOH B, et al. Efficient electron transfer from hydrogen to benzyl viologen by the [NiFe]-hydrogenases of Escherichia coli is dependent on the coexpression of the iron-sulfur cluster-containing small subunit[J]. Archives of Microbiology, 2011, 193(12):893-903.
[28]SPIELMANN A, BAUMGART M, BOTT M. NADPH-related processes studied with a SoxR-based biosensor in Escherichia coli[J]. Microbiologyopen,2018,25:e785.
[29]MAY G, FAATZ E, LUCHT J M, et al. Characterization of the osmoregulated Escherichia coli proU promoter and identification of ProV as a membrane-associated protein[J].Molecular Microbiology, 2010, 3(11):1521-1531.
[30]SCHIEFNER A, BREED J, BOSSER L, et al. Cation-π interactions as determinants for binding of the compatible solutes glycine betaine and proline betaine by the periplasmic ligand-binding protein ProX from Escherichia coli[J]. Journal of Biological Chemistry, 2004, 279(7):5588-5596.
[31]SEN H, AGGARWAL N, ISHIONWU C,et al. Structural and functional analysis of the Escherichia coli acid-sensing histidine kinase EvgS[J]. Journal of Bacteriol,2017,22:e00310-17.
[32]GAVRIIL A, PARAMITHIOTIS S, SKORDAKI A,et al . Prior exposure to different combinations of pH and undissociated acetic acid can affect the induced resistance of Salmonella spp. strains in mayonnaise stored under refrigeration and the regulation of acid-resistance related genes[J]. Food Microbiol,2021,95:103680.
(責任编辑:张震林)
收稿日期:2021-06-21
基金项目:国家自然科学基金项目(31772707);安徽农业大学2019年度研究生创新基金项目(2019ysj-24)
作者简介:吴剑梅(1998-),女,安徽安庆人,硕士研究生,主要从事动物性食品安全研究。(E-mail)1916679282@qq.com
通讯作者:祁克宗,(E-mail)qkz@ahau.edu.cn

