宫腔粘连患者子宫内膜中CD38、CD138的表达情况分析*
刘 宝,池余刚△,冯 倩,陈明倩
重庆市妇幼保健院:1.妇科;2.感染科,重庆 400021
宫腔粘连是指各种原因所致宫腔基底层内膜损伤后,内膜的胶原纤维过度增生而导致肌壁相互粘连。临床上可能表现为月经失调(包括闭经、经量减少、痛经),不孕症等[1]。宫腔粘连形成的确切机制仍不清楚,且缺乏较好的预测复发的指标[2]。慢性子宫内膜炎(CE)是一种非特异的持续性炎症,诊断该疾病的“金标准”是子宫内膜间质中发现异常的浆细胞浸润[3]。有研究发现,CE可能参与了子宫内膜纤维化的过程,加速了宫腔粘连的形成,且宫腔粘连患者子宫内膜中若出现浆细胞的浸润,其术后复发率明显增加[4-5]。若采用传统的苏木精伊红染色(HE)检测浆细胞,难以将其与子宫内膜间质的单核细胞及成纤维细胞区分,加上所取活检组织的局限性,无法准确诊断CE。有学者提出,通过检测浆细胞特异性表面抗原CD38、CD138来诊断CE具有更高的灵敏度[6]。但有关宫腔粘连中CD38及CD138的研究目前较少。因此,本研究采用前瞻性队列研究,利用免疫组织化学法检测宫腔粘连患者子宫内膜中CD38、CD138的表达情况,并探讨其表达差异与宫腔粘连复发及妊娠的关系,为治疗宫腔粘连提供新的思路和方向。
1 资料与方法
1.1一般资料 采用前瞻性队列研究的方法选取2019年12月至2020年12月在本院就诊的宫腔粘连及继发不孕行宫腔镜诊治术的患者为研究对象。本研究经本院医学伦理委员会审查通过[(2019)伦审(科)001号],并在中国临床试验注册中心完成注册(注册号:ChiCTR1900027896)。所有入组患者均签署知情同意书。通过查阅文献笔者预计女性不孕症患者中慢性子宫内膜炎的发生率约为15%,宫腔粘连中慢性子宫内膜炎的发生率约为35%[7],Ⅰ类错误选取0.05,Ⅱ类错误选取0.10,通过公式计算出宫腔粘连组及继发不孕组各需93例,按10%失防率计算每组需纳入103例患者。后因失访和不愿意再取子宫内膜等其他因素最终宫腔粘连组纳入95例患者,继发不孕组97例患者。宫腔粘连组中,年龄31.00(28.00,34.00)岁,体质量指数(BMI)20.70(19.15,22.83)kg/m2;妊娠次数2(1,4)次;清宫次数2(1,3)次;末次清宫原因:稽留流产35例,人流44例,中孕引产9例,其他7例;术前美国生育协会(AFS)评分8(6,10)分;术前月经情况:闭经8例,经量减少83例,经量正常4例;术前宫腔粘连程度:轻度22例,中度38例,重度35例。继发不孕组中,年龄31.00(27.50,33.00)岁;BMI 21.41(19.57,24.19)kg/m2;妊娠次数1(0,2)次;清宫次数1(0,1)次;末次清宫原因:稽留流产23例,人流32例,剖宫产3例,其他39例。两组患者在年龄、BMI等方面比较,差异均无统计学意义(P>0.05)。
1.2纳入与排除标准
1.2.1纳入标准 宫腔粘连组:年龄≤45岁且≥18岁,符合宫腔粘连诊断标准(按照AFS评分标准分度,0分为无宫腔粘连,>1~4分为轻度,>4~8分为中度,>8~12分为重度),有生育要求,有宫腔镜下宫腔粘连分离术指征且无手术禁忌,宫腔镜手术在月经干净后7 d内实施,闭经者随时手术。继发不孕组:同期年龄≤45岁且≥18岁的继发不孕患者,经宫腔经检查确认为正常宫腔。
1.2.2排除标准 绝经;合并其他生殖系统疾病如感染、肿瘤、结核等;合并其他内科疾病;患有乳腺肿瘤、乳腺增生等不适宜术后使用激素疾病;可疑或已确诊的与雌、孕激素相关的疾病;未明确原因的阴道出血;有血栓形成高危因素或有血栓性疾病史、家族史;参与本研究前3个月内曾参加过其他研究项目;根据研究者判断,不适合参加本研究。
1.3方法
1.3.1患者术前准备 对于未闭经的患者,月经干净后3~7 d不同房实施手术;闭经的患者,排除妊娠后随时手术。手术均由2位具有丰富经验的副主任医师完成。术前3~4 h于阴道后穹隆放置米索前列腺醇0.4 mg,术中均采用生理盐水作为膨宫液,膨宫压力设置为80~100 mm Hg。
1.3.2宫腔粘连分离术 患者采用静脉麻醉,在超声监护下进行宫腔粘连分离术(TCRA)。用等离子针形电极分离至与左右输卵管开口连线基本处于同一水平。术毕宫腔安置宫腔球囊,5 d后取出。术中取部分子宫内膜进行CD38及CD138检测。术后雌激素应用剂量遵循《宫腔粘连临床诊疗中国专家共识》[8],轻、中度宫腔粘连患者术后给予雌激素口服(补佳乐) 2 mg,1 d两次,共口服21 d,而重度粘连患者术后给予雌激素(补佳乐) 3 mg,1 d两次21 d,后7 d均加用地屈孕酮10 mg,一天两次。 月经来潮则全部停药,1~2个月经周期后再次行宫腔镜检查。再次取子宫内膜检测CD38及CD138的表达。若宫腔镜复查满意,建议2个月后备孕,随访妊娠情况。术后随访时间5~22个月。
继发不孕组患者,宫腔镜下未见粘连、纵隔、息肉、肌瘤等子宫内疾病,内膜平整,无充血等异常表现,取部分子宫内膜行CD38及CD138检测。
1.3.3CD38、CD138检测 子宫内膜PBS冲洗干净,置于4%多聚甲醛中,常规经酒精脱水、石蜡包埋、切片后进行CD38、CD138免疫组织化学(SP)染色(武汉三鹰)。染色结果及判定:CD38定位于细胞膜,呈棕黄色线状为阳性;CD138定位于细胞质和细胞膜中,细胞质和细胞膜出现棕黄色为阳性[9]。
1.3.4临床指标收集 记录宫腔粘连患者与继发不孕患者的年龄、BMI、妊娠及清宫次数、末次清宫原因、术前AFS评分,术前月经、术前宫腔粘连程度等基本情况。并分别记录CD38、CD138阳性及阴性患者AFS评分差值、宫腔形态恢复情况、月经恢复情况及妊娠率等指标。宫腔形态评价标准分为:无效,二次宫腔镜检查仍见粘连,需再次手术;好转,宫腔形态大致正常,宫腔镜下仅可见一侧或双侧输卵管开口未见;治愈,宫腔形态正常,双侧可见输卵管开口[1]。月经量的评估主观性较强,以患者第一次TCRA术前月经情况为基线,若第一次TCRA术后月经量无明显改善甚至减少为无效;若月经量较术前增多,但未达到正常月经量为好转;若月经量恢复到正常水平则为治愈。采用电话、微信或短信的随访方式,询问术后3、6、9、12个月的妊娠情况,B超提示宫内见妊娠囊视为受孕。
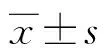
2 结 果
2.1宫腔粘连组与继发不孕组患者情况比较 宫腔粘连组CD38阳性、CD138阳性、CD38和CD138双阳性的比例均明显高于继发不孕组(43.16%vs.8.25%,65.26%vs.11.34%,42.11%vs.5.15%,P<0.001)。两组SP染色图见图1。

注:A、B为CD38在继发不孕组和宫腔粘连组中的表达,C、D为CD138在继发不孕组和宫腔粘连组中的表达。图1 CD38、CD138在继发不孕组及宫腔粘连组中的表达(×400)
2.2宫腔粘连患者CD38、CD138表达阳性组与阴性组一般情况比较 CD38阳性组和阴性组之间、CD138阳性组和阴性组之间、CD38及CD138双阳性组和CD38、CD138阴性组(其中之一或均阴性)之间在年龄、BMI、清宫及妊娠次数、术前AFS评分、术前月经、术前宫腔粘连程度方面比较,差异均无统计学意义(P>0.05)。CD38及CD138双阳性组和CD38、CD138阴性组末次清宫原因比较,差异有统计学意义(P<0.05),进一步两两比较,CD38及CD138双阳性组末次清宫因引产或胎盘残留的比例较CD38、CD138阴性组更高(P<0.05);但CD38阳性组和阴性组之间、CD138阳性组和阴性组之间末次清宫原因比较,差异均无统计学意义(P>0.05)。见表1。
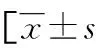
表1 宫腔粘连患者CD38、CD138表达阳性组与阴性组一般情况比较或n(%)]
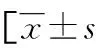
续表1 CD38/CD138表达阳性组与阴性组一般情况比较或n(%)]
2.3宫腔粘连患者CD38、CD138表达阳性组与阴性组术后情况比较 CD38阳性组、CD138阳性组、CD38及CD138双阳性组AFS评分差值较CD38阴性组、CD138阴性组和CD38、CD138阴性组更小(P<0.05),宫腔形态恢复情况更差(P<0.05)。CD138阳性组、CD38及CD138双阳性组二次宫腔术前AFS评分较CD138阴性组和CD38、CD138阴性组更高(P<0.05),术后月经恢复情况更差(P<0.05)。各组间术后妊娠率比较,差异均无统计学意义(P>0.05)。经单疗程多西环素治疗后CD38及CD138的转阴率分别为60.98%、61.29%,差异无统计学意义(P>0.05)。见表2。
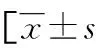
表2 CD38、CD138表达阳性组与阴性组术后情况比较或n(%)]
3 讨 论
宫腔粘连的发病率较高,反复人工流产、清宫所致的宫腔粘连发生率高达25%~30%[1,8]。宫腔粘连的标准治疗是TCRA,但粘连分离后复发率可能高达62.5%,妊娠成功率仅22.5%~33.3%[2]。目前宫腔粘连的确切发病机制仍不清楚,且缺乏可靠的预测复发的指标。1981年,TAYLOR等[10]就提出亚急性或CE是宫腔粘连形成的危险因素。2017年一项前瞻性队列研究结果亦表明,合并CE的宫腔粘连患者粘连复发率明显高于未合并CE的宫腔粘连患者[4]。这些结果表明CE与宫腔粘连的发生及复发密切相关。诊断CE的“金标准”是在组织切片中发现浆细胞浸润,但传统的HE染色识别浆细胞较为困难,近年来CD38和CD138被认为是识别浆细胞很好的标志物[11-12]。CD38是一种多功能蛋白,具有许多独特的生物学特性及功能,且其主要在活化前β细胞、β细胞、浆细胞、胸腺细胞中表达。研究表明,浆细胞中的CD38着色性强,因此通过观察浆细胞中CD38的表达情况可以提高识别浆细胞的精准度[13]。而CD138是一种多配体聚糖,它是浆细胞中最具有特异性的指标,约95%的石蜡切片中浆细胞膜表面均能检测到CD138的表达[14]。因此本研究希望通过检测宫腔粘连患者内膜中CD38、CD138的表达情况,并随访其与宫腔粘连术后复发率及妊娠率的关系,为预测宫腔粘连的复发提供新的指标,并为治疗宫腔粘连提供新的方向。
本研究结果显示,宫腔粘连组CD38阳性、CD138阳性、CD38和CD138双阳性的比例均明显高于对照组(P<0.05),且较文献报道的宫腔粘连患者中CE的比例更高[4]。提示检测CD38、CD138的表达情况,可能有助于提高对浆细胞的检出率,对于常规HE染色未辨认的浆细胞可通过免疫组织化学法进行更加准确的诊断,进而提高CE的检出率,降低漏诊率。此外,本研究发现,CD38及CD138双阳性组末次清宫因引产或胎盘残留的比例较CD38、CD138阴性组更高(P<0.05)。有研究报道,产后胎盘残留或引产清宫较其他原因更容易导致宫腔粘连[15],因此笔者推测可能是因为胎盘粘连或者引产对子宫的损伤更大,感染的风险增加,从而导致术后发展为CE的概率上升,而更多的患者表现出CD38及CD138均阳性。
进一步的研究结果表明,CD38阳性组、CD138阳性组、CD38及CD138双阳性组AFS评分差值较CD38阴性组、CD138阴性组和CD38、CD138阴性组更小(P<0.05),宫腔形态恢复情况更差(P<0.05)。CD138阳性组、CD38及CD138双阳性组二次宫腔术前AFS评分较CD138阴性组和CD38、CD138阴性组更高(P<0.05),术后月经恢复情况更差(P<0.05)。提示CD38、CD138可能有助于预测宫腔粘连的复发情况。但各组间术后妊娠率比较,差异均无统计学意义(P>0.05),这可能与本研究随访时间较短有关。
目前关于CE形成原因及其引起或加重宫腔粘连的机制仍不明确,有学者指出,CE形成的主要病因是病原微生物的感染,其治疗应根据子宫内膜病原微生物的培养及药敏实验合理选择抗菌药物[7]。而CE可通过影响血液循环障碍、局部免疫变化,并增加细胞因子的产生,进而导致慢性组织缺氧和炎症增强,促进纤维化发展,最终加速宫腔粘连的发生[16]。因此,笔者推测CE是宫腔粘连形成的原因之一,但宫腔粘连的粘连程度与多种因素相关,如有条件可以对CE患者行内膜病原微生物的培养并进行药敏实验以指导后续治疗。值得注意的是,CD38与CD138在人类各组织细胞中分布较广泛,其对子宫内膜中的浆细胞检测的特异度与灵敏度亦有所差异,因此CD38与CD138联合检测可能有助于提高检测的准确率。
本研究还发现,CD38阳性组和阴性组之间、CD138阳性组和阴性组之间、CD38及CD138双阳性组和CD38、CD138阴性组之间在术前宫腔粘连程度方面比较,差异均无统计学意义(P>0.05)。且经单疗程多西环素治疗后CD38及CD138的转阴率分别为60.98%、61.29%,这较CICINELLI等[17]报道的23%有效率高,但较LIU等[5]报道的93.59%有效率低。导致这些差异的具体原因尚不明确,但为笔者下一步的研究指明了方向。
综上所述,本研究证实CD38、CD138作为CE的标志物在宫腔粘连患者子宫内膜中高表达,且其表达差异与宫腔粘连的复发及生殖预后可能有一定关系。采用免疫组织化学法检测宫腔粘连患者子宫内膜中CD38、CD138的表达简便易行,为治疗宫腔粘连提供了新的思路。但CE造成或促进宫腔粘连的具体机制尚不明确,而CD38、CD138阳性患者经多西环素治疗后其转阴率并不理想,仍需后期进一步研究。

