人血清癌胚抗原发光免疫分析方法的建立及性能评价*
杨进波,焦 蓉,曹 琳,武军驻,孙 莉,童 伟
1.湖北医药学院附属襄阳市第一人民医院检验科,湖北襄阳 441000;2.武汉大学基础医学院生物化学与分子生物学系,湖北武汉 430071;3.襄阳职业技术学院医学实训中心,湖北襄阳 441000
肿瘤标志物可用于胃癌、肠癌、肺癌、肝癌等常见肿瘤疾病的预防筛查、辅助诊断及复发监测[1]。癌胚抗原(CEA)是一种广谱肿瘤标志物,可通过细胞膜分泌进入人体体液中[2]。健康人群血液中CEA浓度很低,部分吸烟人群血液中CEA浓度会升高[3]。目前,CEA被广泛应用于各类恶性肿瘤的辅助诊断、筛查。化学发光免疫分析法是将化学光信号检测技术和免疫分析法相结合的一种新技术,该方法的灵敏度高,仪器操作智能简便,检测时间短,并且没有放射性污染[4-5]。本研究通过双抗夹心法原理建立人血清CEA发光免疫分析方法,并对各项性能进行了评估,选取雅培CEA检测系统作为参比系统,调试检测结果与世界公认的检测系统靠拢,以期为国内临床快速检测CEA提供方法。
1 材料与方法
1.1材料来源 血清标本由湖北医药学院附属襄阳市第一人民医院提供。
1.2仪器与试剂 SMART 500全自动化学发光免疫分析仪(科斯迈生物技术有限公司)、雅培i2000全自动化学发光免疫分析仪(美国雅培公司)、BY-L600型立式低速离心机(白洋医疗器械有限公司)、移液器[大龙兴创实验仪器(中国)有限公司]、CEA捕获抗体和检测抗体(金斯瑞生物科技有限公司)、CEA(海肽生物科技有限公司)、吖啶酯[西格玛奥德里奇(上海)贸易有限公司(Sigma-Aldrich)]、羧基磁珠(重庆博蓝鹰生物技术有限公司)、CEA测定试剂盒(化学发光微粒子免疫检测法,美国雅培公司)、ProClin 300[西格玛奥德里奇(上海)贸易有限公司(Sigma-Aldrich)]、新生牛血清(杭州四季青生物科技有限公司)。
1.3方法
1.3.1吖啶酯标记CEA检测抗体 取pH=7.4的磷酸盐缓冲液置换抗体缓冲体系,调整抗体浓度为1 mg/mL。吖啶酯用无水N,N-二甲基甲酰胺配制成3 mg/mL的溶液。取500 μL抗体溶液,加入一定量的吖啶酯溶液,室温避光振荡反应40 min。反应结束后用G25脱盐纯化柱纯化后加入等体积甘油,储存于-20 ℃冰箱备用。
1.3.2羧基磁珠偶联CEA捕获抗体 取1 mL浓度为10 mg/mL的羧基磁珠于EP管中,磁力架磁性分离磁珠和保存液,移液枪移除上清液,加入1 mL MES缓冲液,反复清洗2次后混合重悬于1 mL MES缓冲液中。重悬液中依次加入EDC和NHS活化剂,置于混匀仪中反应30 min,反应结束后置于磁力架中静置,移除上清液,加入1 mL MES缓冲液,反复清洗2次。清洗结束,加入0.5 mL MES缓冲液重悬,再加入0.5 mL预处理的CEA捕获抗体,置于混匀仪中反应120 min。反应结束后,用1 mL MES缓冲液反复清洗3次。加入磁珠封闭液封闭120 min后用1 mL MES缓冲液反复清洗3次,加入磁珠保存液于2~8 ℃冰箱中备用。
1.3.3CEA校准品配制 新生牛血清中加入0.1% ProClin 300,混匀仪混匀60 min后制备成校准品稀释液,经雅培i2000全自动化学发光免疫分析仪检测CEA浓度低于检测下限,可用作CEA校准品的配制。将CEA用校准品稀释液分别配制成浓度为0.0、1.0、2.5、50.0、100.0、1 000.0 ng/mL的校准品,各浓度使用雅培CEA检测系统进行标定,溯源至国际标准品NIBSC73/601。
1.3.4检测方法设定 使用SMART 500全自动化学发光免疫分析仪设定检测程序,将20 μL标本、包被在羧基磁珠上的CEA捕获抗体、吖啶酯标记的CEA标记抗体加入到反应杯中,37 ℃恒温条件下孵育反应一定时间形成磁珠-CEA捕获抗体-抗原-CEA标记抗体-吖啶酯复合物。利用磁场吸引复合物,清洗液洗涤后,加入100 μL预激发液和100 μL激发液。免疫复合物中的吖啶酯在两种试剂的作用下会形成激发态中间体,激发态回到基态时会发出恒定波长的可见光,通过SMART 500全自动化学发光免疫分析仪中的传感器可检测到反应过程中的发光强度。发光强度与标本中的CEA浓度在线性范围内呈正相关,四参数Logistic方程进行拟合后,即可计算得到血清标本中CEA的浓度。
1.3.5羧基磁珠偶联CEA捕获抗体浓度及工作浓度的筛选 采用棋盘实验法。分别向10 mg磁珠中加入0.05、0.10、0.20 mg的CEA捕获抗体进行偶联,分别按照200∶1、100∶1、50∶1的质量比进行偶联(因素A)。每个羧基磁珠偶联物,其工作浓度分别按照1∶5、1∶10、1∶20的稀释比例进行稀释(因素B),采用双因素交叉实验,评估校准品拟合的线性及校准品1(S1)与零浓度校准品(S0)信噪比(S1/S0)。
1.3.6吖啶酯标记CEA检测抗体浓度及工作浓度的筛选 采用棋盘实验法。分别向5 μg吖啶酯试剂中加入25、50、100 μg的CEA检测抗体进行标记,分别按照1∶5、1∶10、1∶20的质量比进行标记(因素A)。每个浓度的标记物其工作浓度分别按照1∶500、1∶1 000、1∶2 000的比例进行稀释(因素B),采用双因素交叉实验。评估校准品拟合的线性和S1/S0。
1.3.7反应时间选择 确定了羧基磁珠偶联CEA捕获抗体、吖啶酯标记CEA检测抗体的工作浓度后,进一步探究最佳的反应时间。设定反应时间分别为5、8、10、15 min,通过评估不同时间下校准品的回归曲线选择最佳反应时间。
1.4统计学处理 采用Excel2019及SPSS20.0软件进行数据处理及统计分析。呈偏态分布的计量资料以M(P25,P75)表示,组间比较采用配对Wilconxon符号秩和检验。以P<0.05为差异有统计学意义。
2 结 果
2.1方法学建立
2.1.1羧基磁珠偶联CEA捕获抗体浓度及工作浓度确定 随着CEA捕获抗体浓度的升高,其线性相关系数(r)呈升高趋势。随着羧基磁珠浓度的升高,信噪比随之降低。因此,根据CEA校准曲线的线性和信噪比情况,筛选出最优的偶联条件为羧基磁珠与CEA捕获抗体质量比为100∶1,羧基磁珠工作浓度为1∶10,在该条件下其r值和信噪比最优,并且原料用量较少。见表1。
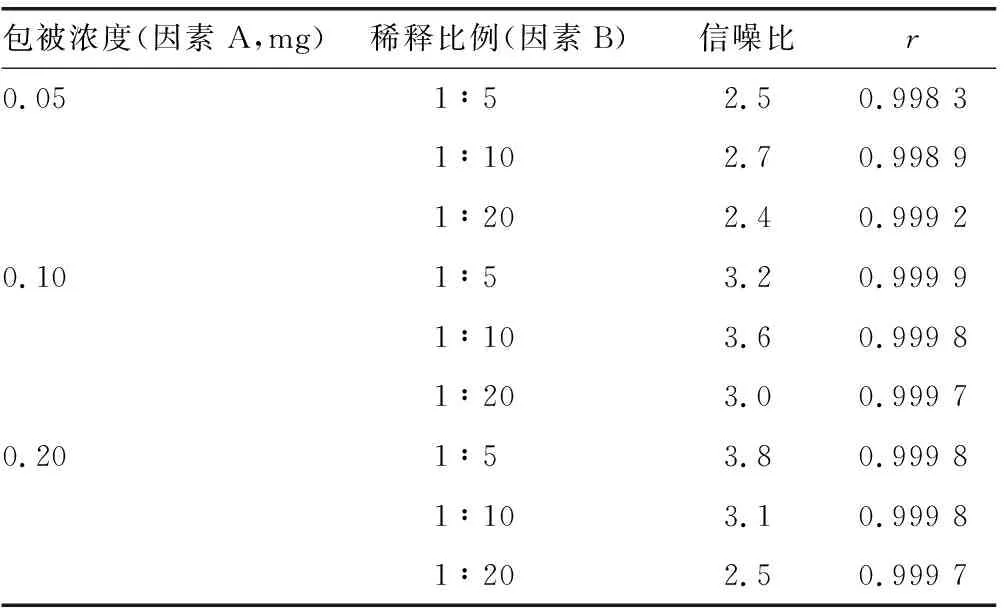
表1 不同包被浓度及稀释比例的选择
2.1.2吖啶酯标记CEA检测抗体浓度及工作浓度确定 吖啶酯标记的CEA偶联物稀释至1∶1 000时,其信噪比降低,在稀释比例为1∶1 000时,标记物的线性和信噪比能达到最优。因此,筛选出最优偶联条件为吖啶酯与CEA检测抗体质量比为1∶10,吖啶酯标记的CEA偶联物的稀释比例为1∶1 000时,其校准曲线拟合的r值和信噪比最优,并且原料用量较少。见表2。
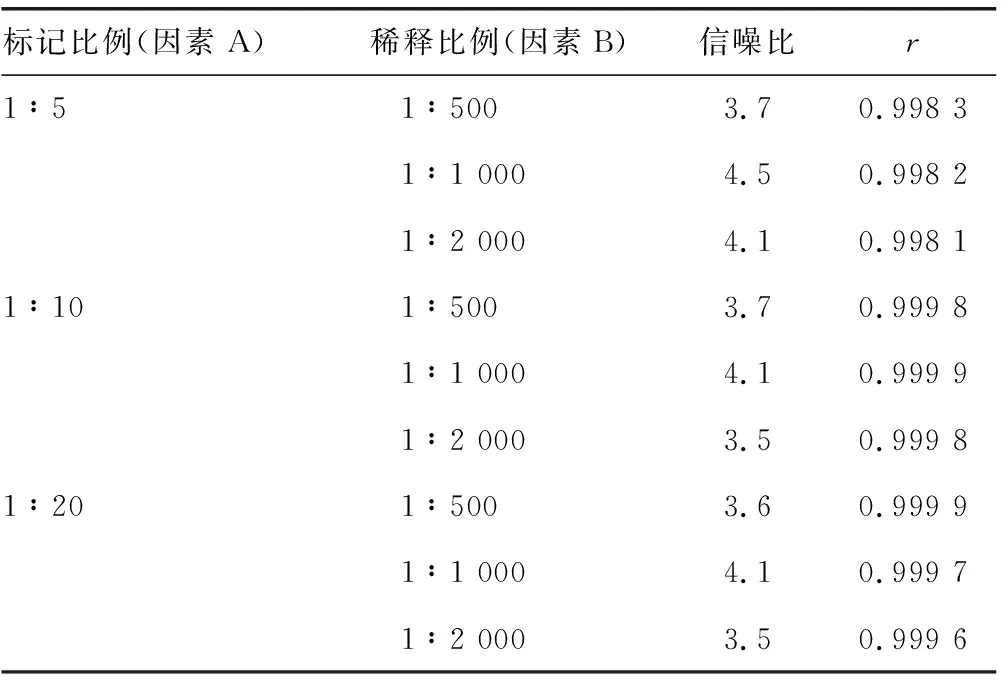
表2 不同标记物浓度及稀释比例的选择
2.1.3反应时间确定 设定反应时间分别为5、8、10、15 min,评估不同时间下校准品的回归曲线,结果见图1。随反应时间的延长,校准品各个浓度点的相对发光值也随之升高,升高到一定时间后基本达到平衡,为实现临床快速检测,因此反应时间选择10 min。

图1 不同反应时间下的校准品相对发光值
2.2试剂性能评价
2.2.2线性范围 接近线性范围上限的CEA高浓度标本和接近线性范围下限的CEA低浓度标本混合成5个稀释浓度(xi)(包括下限、中限及上限),即配制浓度为0.40、200.16、400.24、600.16、800.08、1 000.00 ng/mL的线性参考品,每个稀释浓度测试3次,分别求出测定结果的均值(yi)。以稀释浓度(xi)的对数为自变量,以测定结果均值(yi)的对数为因变量拟合线性,见图2,根据拟合的线性方程,结果表明本方法在0.4~1 000.0 ng/mL范围内的r为0.999 6,线性范围符合行业标准要求。
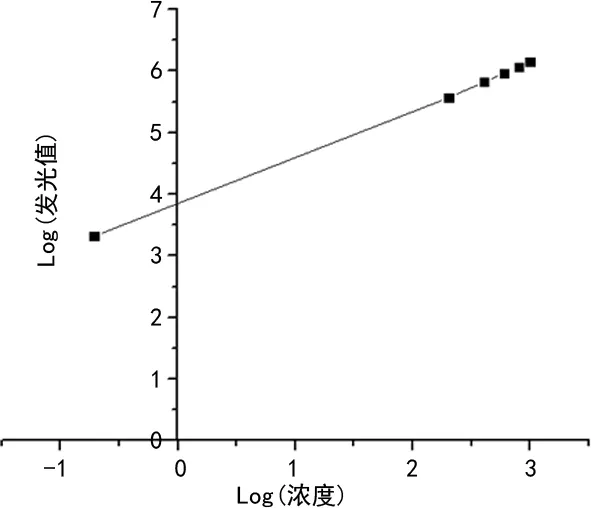
图2 线性范围实验结果
2.2.3准确度 取已知浓度的高浓度CEA标本(浓度记为Xs)和已知浓度的低值血清标本;将参考品与低值血清标本以1∶9的体积比进行混合,然后分别检测低值血清标本和混合标本,每个标本重复检测3次,计算检测结果的平均值X0和X。根据公式回收率(P)=(10X-9X0)/Xs×100%计算出P,本方法的P为102.70%,说明P在85.00%~115.00%范围内,符合准确度要求。
2.2.4精密度 配制预期浓度为100 ng/mL和10 ng/mL高、低两个浓度的样品,分别重复检测10次,计算高、低两个浓度的批内精密度,见表3。重复3次实验,分别统计高、低两个浓度的30次检测结果并计算高、低两个浓度的批间精密度,见表4,结果显示,本检测方法批内精密度分别为5.12%、5.17%,批间精密度分别为5.60%、5.52%,这一结果表明本检测方法的精密度均优于行业标准要求。

表3 批内精密度(n=10,ng/mL)

表4 批间精密度(n=30,ng/mL)
2.2.5HOOK效应 使用CEA,配制浓度为160 000、120 000、60 000、30 000、15 000、1 000 ng/mL的CEA高值标本。同时配制后的高值标本,制作浓度相对发光值曲线,见图3,分析曲线可知,当CEA浓度超过120 000 ng/mL时出现拐点,说明CEA浓度最高达到120 000 ng/mL时,未出现HOOK效应。

图3 HOOK效应浓度-RLU值曲线
2.2.6与雅培CEA检测系统比对 使用雅培CEA检测系统,与本方法同时测定200份临床血清标本CEA浓度,二者相关性见图4,相关性方程为Y=1.004 6X+0.073 4,r=0.994 9。通过分析这两种方法的标本检测结果比较,差异无统计学意义(P=0.468)。结果表明,本方法与雅培CEA检测系统临床标本结果的相关性较好。

图4 两种试剂盒测定结果的相关性
3 讨 论
化学发光免疫分析法是一种高灵敏度、高特异度的检测方法,即将高灵敏度的化学分析方法和高特异度的免疫学反应相融合的一项技术,符合临床检验需求。化学发光免疫分析法以其线性范围宽、灵敏度高、特异度高、精确定量等优势,逐步替代传统的酶联免疫吸附试验和定性产品,同时早期的微孔板式化学发光法也逐步被磁微粒化学发光技术所取代[6-7]。从目前化学发光法市场占有率和主流技术应用看,非酶参与的直接化学发光免疫分析法、电化学发光法占比高于酶促化学发光法,直接化学发光法标记物相对分子质量很小,便于对小分子物质进行标记,能检测的项目多于酶促化学发光法,在临床检验中应用更广泛。以吖啶酯标记的化学发光免疫分析法属于直接化学发光法,体系标记简单,无需酶催化和增强剂的作用,能明显降低化学发光背景值,提高信噪比,干扰作用少,同时,还表现出光释放集中迅速、发光强度和发光效率高的特点[8],此外,由于其相对分子质量较小,易与抗体结合,且对抗体构像影响小,标记后比较稳定,现如今在直接化学发光免疫分析法中成为主流。
在一般情况下,CEA能够通过胃肠道代谢作用,维持一种动态平衡,并处于较低浓度。在恶性肿瘤发生、发展过程中,血清中的CEA可进入血液循环,因此,在胰腺癌、肺癌、结肠腺癌、肝细胞癌和胃癌患者血清中CEA浓度明显升高[9]。CEA作为临床试验中的肿瘤标志物,已逐渐成为临床上诊断肿瘤的重要辅助指标之一,定量检测血清中的CEA浓度在恶性肿瘤手术后的疗效评估及预后观察中发挥重要作用[10-11],另外,CEA也可辅助检测用于部分癌症患者的靶向治疗[12]。目前,临床上用于检测CEA的手段方法多样,同时也有不少研究对CEA检测方法进行了报道。薛盼等[13]构建了基于辣根过氧化物酶(HRP)催化发光的CEA分析检测方法,该方法可基本满足医院检测,但是由于HRP不及碱性磷酸酶(ALP)稳定[14],目前大多数试剂厂家将HRP体系更换为更加稳定的ALP体系。李雪萌[15]构建了一种基于纳米材料的CEA荧光免疫检测方法,该方法的优势是设备更加小巧便携,操作更加灵活,但在准确度、灵敏度及抗背景干扰等性能方面不及化学发光法。周齐洋等[16]报道了基于链霉亲和素-生物素体系的CEA直接发光检测方法,该方法性能出色,各项技术指标均达到国家标准要求,但是该方法用的主要试剂均为进口试剂,且仪器为封闭系统。
本研究成功建立了基于磁微粒化学发光系统的CEA定量检测方法,并应用所建立的方法与雅培CEA检测系统同时检测200份临床血清标本。本方法性能评估结果显示,所建立方法的空白限、准确度、线性范围、批内精密度、批间精密度等性能指标均满足行业标准,与雅培CEA检测系统临床标本结果的相关性较好,说明本研究所研制的CEA定量检测方法达到了临床诊断的要求。本研究采购的大部分主要原料为国产试剂,生产成本较低,可降低检测费用。此外,本研究中CEA定量检测方法使用仪器为国产开放式全自动化学发光免疫分析仪,适宜国内临床推广,有助于推进国内诊断试剂国产化。

