早产低出生体重儿采用脐静脉置管的有效性及安全性分析
吴伟杰
广东省云浮市妇幼保健院新生儿科,广东云浮 527300
早产儿通常是指胎龄在28~37 周的新生儿,一般情况下新生儿娩出后正常体重应该在2500~4000 g,但早产儿娩出后其体重大多不足2500 g,早产是导致新生儿发生死亡的主要原因[1]。此类新生儿胎龄越小、体重越低,而低体重出生的早产儿并发其他症状的风险相对更高,存活率也会越低[2]。低体重出生的早产儿娩出后往往需要立即送入重症监护室(intensive care unit,ICU)接受抢救治疗,而静脉置管支持为目前临床用于维持患儿生命体征、改善其营养状况的主要治疗措施。目前,较为常见的置管方式为外周中心静脉置管(peripheral central venous catheter,PICC)[3],其可迅速建立患儿抢救及营养支持通道,但长期留置于患儿体内也极易发生感染等并发症状。为有效提高患儿生存质量,PICC 常需在短期内拔管,但早产儿由于各项器官发育未成熟,往往需要长期在ICU 接受治疗[4]。胎儿娩出早期脐带切断后,脐部静脉管径一般较成年人更大,更易实施穿刺。为充分满足低体重出生早产儿的临床治疗需求,将脐静脉血管作为其置管通路或可有效提升患儿的治疗效果[5]。本研究主要探讨早产低出生体重儿采用脐静脉置管(umbilical vein catheter,UVC)的有效性及安全性。
1 资料与方法
1.1 一般资料
选取2018年7月至2021年10月广东省云浮市妇幼保健院收治的50 例早产低出生体重儿作为研究对象,采用随机数字表法将其分为观察组和对照组,每组25 例。对照组中,男13 例(52.00%),女12 例(48.00%);日龄12~36 h,平均(24.31±8.69)h;孕龄27~36 周,平均(31.52±0.48)周;出生时体重800~1900 g,平均(1500.33±249.67)g。观察组中,男14 例(56.00%),女11 例(44.00%);日龄16~30 h,平均(23.87±8.13)h;孕龄27~36 周,平均(31.14±0.86)周;出生时体重900~1900 g,平均(1552.45±247.55)g。两组患儿的性别、日龄、孕龄、出生时体重等一般资料比较,差异无统计学意义(P>0.05),具有可比性。纳入标准:①所有患儿均为孕龄<37 周的早产儿;②出生时体重均<2000 g;③均符合静脉置管治疗相关适应证[6]。排除标准:①伴有先天性呼吸系统、心血管系统相关症状者;②伴有感染性疾病者;③伴有出血倾向或凝血机制异常者;④新生儿母体存在宫内感染等相关症状者;⑤依从性较差不愿配合者。本研究符合广东省云浮市妇幼保健院医学伦理会所提出的相关研究实施标准,入组患儿家属均已知悉此次研究并已签署相关知情同意书,均为自愿参与本研究。
1.2 方法
观察组采用脐静脉置管,新生儿娩出后于脐根部1 cm 处将脐带间断后进行常规消毒,将静脉导管置入后经X 线观察导管位置,以导管末端在纵隔上端0.5~1.0 cm 处为最佳置管位置,将脐带残端与静脉导管一同捆绑固定后再使用透明敷料结扎固定即可,导管固定后统一留置10 d 后观察效果。
对照组采用外周中心静脉置管,经外周血管实施穿刺后在距离穿刺点10 cm 处进行止血、结扎,穿刺可见回血后将插管鞘插入后前推导管,经X 线观察导管位置,带前推至适宜位置后即可拔出插管鞘并注入适量生理盐水即可,置管10 d 后统一观察效果。
1.3 观察指标及评价标准
比较两组患儿治疗前后的营养指标、治疗后的一次穿刺成功率、非计划拔管率发生情况,记录置管后体重增长情况及置管深度,并统计两组患儿治疗后的不良事件发生情况。①治疗前后营养指标(血浆白蛋白)参考值为35~55 g/L[7]。②护理人员经不同静脉血管穿刺1 次即准确找到血管位置且出现血液回流时即为一次穿刺成功[8],非计划拔管包括导管滑脱、导管堵塞等原因造成的提前拔管[9]。③以患儿置管前首次记录体重为基础,计算其每日体重变化情况,脐置管深度为脐部至右侧乳头连线长度+脐残端长度[8];经X线确定外周静脉导管起始端、末端位置,将左上肢穿刺点至右侧胸锁关节长度加4 cm 后记录为置管深度[10]。④本研究两组患儿置管后的不良事件主要有穿刺点感染、肠穿孔、脓毒血症、营养不良等,总发生率=(穿刺点感染+肠穿孔+脓毒血症+营养不良)例数/总例数×100%。
1.4 统计学方法
采用SPSS 26.0 统计学软件进行数据分析,正态分布的计量资料用均数±标准差(±s)表示,组内比较采用重复测量数据的方差分析,组间比较采用独立样本t检验;计数资料用频数或百分率(%)表示,组间比较采用χ2检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 两组患儿治疗前后营养指标的比较
两组患儿治疗前的营养指标比较,差异无统计学意义(P>0.05);两组患儿治疗后的营养指标高于治疗前,差异有统计学意义(P<0.05);观察组治疗后的血浆白蛋白水平高于对照组,差异有统计学意义(P<0.05)(表1)。
表1 两组患儿治疗前后营养指标的比较(±s)

表1 两组患儿治疗前后营养指标的比较(±s)
组别例数治疗前治疗后t 值P 值观察组对照组t 值P 值25 25 27.47±1.15 27.36±1.44 0.299 0.767 35.33±5.18 30.41±5.26 4.010<0.001 7.407 2.796<0.001 0.007
2.2 两组患儿一次穿刺成功率及非计划拔管率的比较
观察组的一次穿刺成功率高于对照组,非计划拔管率低于对照组,差异均有统计学意义(P<0.05)(表2)。

表2 两组患儿一次穿刺成功率及非计划拔管率的比较[n(%)]
2.3 两组患儿体重增长及置管深度的比较
观察组的体重增长值高于对照组,置管深度低于对照组,差异均有统计学意义(P<0.05)(表3)。
表3 两组患儿体重增长及置管深度的比较(±s)

表3 两组患儿体重增长及置管深度的比较(±s)
组别例数体重增长(g/d)置管深度(cm)观察组对照组t 值P 值25 25 17.24±1.14 12.33±1.45 13.310<0.001 9.02±1.25 20.45±2.82 18.992<0.001
2.4 两组患儿不良事件发生率的比较
观察组患儿的不良事件发生率为20.00%(5/25),低于对照组的40.00%(10/25),差异有统计学意义(P<0.05)(表4)。
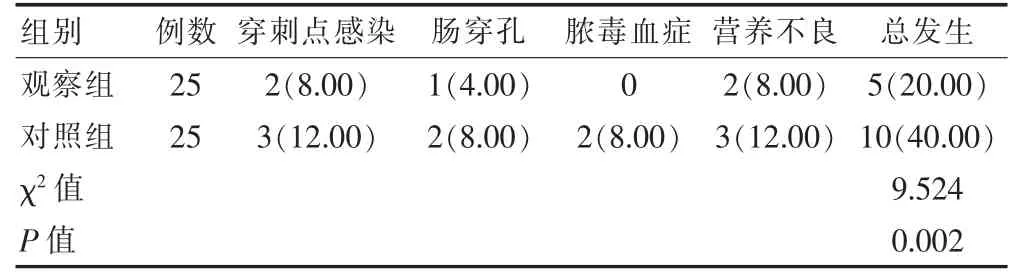
表4 两组患儿不良事件发生率的比较[n(%)]
3 讨论
目前的研究显示,早产儿多与母体宫内、全身感染或子宫结构异常等因素相关,若母体妊娠期伴有相关并发症等情况时其发生早产的风险也相对较高[11]。相较于足月分娩新生儿而言,早产儿胎龄过小,体重过轻,加之自身多种器官发育未成熟,其娩出后更易并发多种症状。早产儿临床一般存在不同程度的呻吟、发绀、呼吸困难、喂养困难等症状,此类新生儿娩出后往往需立即送入ICU 接受连续监测及积极治疗[12]。针对此类患儿,临床一般会通过留置静脉导管的方式对其进行必要的液体输注和营养支持。PICC 经患儿外周静脉血管置入可到达上腔静脉,经UVC 脐部静脉置入可到达下腔静脉,两者对改善患儿生命体征及预后均有重要意义[13]。
本研究结果显示,两组患儿经不同静脉通路置管后均取得一定治疗效果,两者置管后的营养状态均得到一定改善。但相比之下,观察组治疗后的血浆白蛋白营养指标水平高于对照组,差异有统计学意义(P<0.05)。早产儿由于机体发育未成熟,其静脉血管壁多较为薄弱,在实施导管穿刺时极易发生无回血而需再次穿刺的情况,加之小儿配合性较差,反复穿刺可能会增加患儿感染的风险。早产儿早期脐部血管管径较大,经脐部静脉穿刺可很大程度地提升其穿刺成功率[14-15]。本研究中,观察组治疗后的一次穿刺成功率高于对照组,差异有统计学意义(P<0.05)。脐部皮肤组织较为厚重,血管较为丰富,经此处实施静脉穿刺后,观察组的非计划拔管发生率低于对照组,差异有统计学意义(P<0.05);观察组置管后的导管稳定性更佳,在为患儿实施液体、营养剂注入治疗的效率更高,因此该组患儿治疗后的体重增长更快。观察组治疗后的单日体重增长值高于对照组,置管深度低于对照组,差异有统计学意义(P<0.05)。既往临床研究显示,PICC 虽然可对早产儿起到显著的治疗效果,但其置入外周中心静脉血管后发生感染、脓毒血症等严重并发症的风险较高,不利于患儿预后[16]。本研究中,观察组治疗后的不良事件发生率明显低于对照组,差异有统计学意义(P<0.05),提示相较于常规PICC 而言,UVC 的有效性及安全性均较高,这与李琳等[17-18]的研究结果基本一致。
综上所述,对早产低出生体重儿实施UVC 支持治疗可有效提高其治疗效果,促进其体征恢复,给患儿造成的不良事件发生风险更低,相较于常规PICC而言,其有效性及安全性均较高。

