非糖尿病绝经后女性胰岛素抵抗与骨代谢的相关性研究
林伊荷, 刘 芳, 牛亚丹, 李冬梅, 李宇宁, 徐冉行, 陈青山, 徐雷艇*
非糖尿病绝经后女性胰岛素抵抗与骨代谢的相关性研究
林伊荷1, 刘 芳1, 牛亚丹1, 李冬梅2, 李宇宁3, 徐冉行3, 陈青山4, 徐雷艇1*
(1.宁波大学 医学院, 浙江 宁波 315211; 2.宁波市鄞州区明楼街道社区卫生服务中心, 浙江 宁波 315040; 3.宁波市第六医院, 浙江 宁波 315040; 4.宁波市鄞州区东柳街道社区卫生服务中心, 浙江 宁波 315040)
为探讨胰岛素抵抗与骨代谢之间的相互关系, 采用双能X线吸收仪测量了262名非糖尿病绝经后女性腰椎L1-4和股骨颈(femoral neck, FN)的骨密度(bone mineral density, BMD), 并检测了其外周血骨转换标志物和糖代谢指标以及雌激素水平. 结果发现胰岛素和稳态模型评估的胰岛素抵抗(homeostasis model assessment of insulin resistance, HOMA-IR)指数与L1-4和FN BMD均呈正相关(<0.01), 但在控制体重指数(body mass index, BMI)与游离雌二醇(free estradiol, FE2)水平后相关性均消失(>0.05); 高HOMA-IR组(OR=0.59,=0.003)和中HOMA-IR组(OR=0.52,=0.044)的骨质疏松症患病风险显著低于低HOMA-IR组, 但校正BMI和FE2后差异消失(OR=0.81,=0.263和OR=0.68,=0.268); 高HOMA-IR组骨钙素水平显著低于低HOMA-IR组(=0.001), 即使校正BMI和FE2后差异仍有统计学意义(=0.027). 因此, 胰岛素抵抗不是非糖尿病绝经后女性骨质疏松症的独立保护或风险因素, 而骨钙素可能通过影响外周组织胰岛素敏感性参与糖代谢.
胰岛素抵抗; 骨质疏松症; 骨密度; 骨转换标志物
骨质疏松症(osteoporosis, OP)是一种常见的退行性骨代谢疾病, 其发生的关键是成骨细胞介导的骨形成和破骨细胞介导的骨吸收之间的代谢平衡稳态被打乱, 骨微观结构被破坏, 骨小梁稀松, 从而引起骨量减少、骨强度下降, 最终导致骨折风险增加[1]. 雌激素是保持骨重建平衡并维持骨量的关键因素[2]. 绝经后女性由于卵巢功能衰竭, 体内雌激素缺乏, 是OP的高危人群[3]. 胰岛素抵抗是由多种因素引起的胰岛素靶向组织对生理水平胰岛素反应性降低的一种病理状态, 与包括2型糖尿病(type 2 diabetes mellitus, T2DM)在内的许多代谢性疾病密切相关[4]. 胰岛素抵抗是T2DM发生、发展过程中最早出现的异常生理状态, 在糖尿病前期, 胰岛素(insulin, INS)水平增加, 以满足维持正常血糖水平的INS需求, 导致慢性高胰岛素血症和高血糖诱导的β细胞功能衰竭, 最终导致T2DM[5].
OP与T2DM均属增龄性疾病, 随着年龄增大, 发病率逐渐增加, 在老年人群中存在较高的共患率, 且女性显著高于男性[6-7]. 两者又同属代谢性疾病, 具有类似的遗传易感性和环境因素, 而且人体糖代谢和骨代谢平衡都受到共同调节因素的控制, 因此OP与T2DM之间可能存在着复杂的病理生理联系. 例如, 糖尿病是引起OP的主要危险因素之一, T2DM患者的骨折风险比非糖尿病患者增加2~7倍[7-8]. 细胞与动物研究也提示机体能量代谢与骨代谢可能存在双向调节关系[9]. 但针对糖代谢与骨代谢关系的人群研究多关注糖尿病患者, 且观察到的结果并不一致. 因此, 本研究试图通过检测非糖尿病绝经后女性胰岛素抵抗水平与骨密度(bone mineral density, BMD)和骨转换标志物(bone turnover markers, BTMs), 探讨糖代谢与骨代谢之间的相互关系, 为T2DM和OP共患病早期防治提供依据.
1 材料与方法
1.1 研究对象
研究对象来自2017—2020年在宁波市6家社区卫生服务中心和医院骨质疏松诊疗中心参加OP筛查的社区居民, 以电话访谈的方式了解其绝经史、主要病史及用药史, 并邀请初筛合格者参加本研究. 完成全部测试项目并通过本研究纳入与排除标准筛选的研究对象共262名, 所有研究对象均签署知情同意书. 纳入标准: (1)本市常住女性居民; (2)自然绝经时间大于一年; (3)未使用抗骨质疏松药物或停用两年以上. 排除标准: (1)合并严重心脑血管疾病、糖尿病以及肝肾功能不全者; (2)合并甲状腺功能亢进/减退、甲状旁腺疾病、类风湿性关节炎等疾病或有骨折史者; (3)近6个月内服用糖皮质激素2周以上者.
1.2 实验方法
1.2.1 一般资料收集
对纳入研究的对象采用统一的问卷调查收集人口学特征、既往疾病史、用药史等数据. 由专业护士对研究对象进行体格检查, 采用Haiborda电子身高体重仪测量其身高(m)和体重(kg), 取3次测量平均值并按体重与身高平方的比值来计算体重指数(body mass index, BMI).
1.2.2 BMD测量
由影像科专业医师使用双能X线吸收仪(dual- energy X-ray absorptiometry, DXA)对研究对象进行全身BMD扫描. 若在DXA扫描中发现研究对象检测部位存在异常钙化、陈旧性骨折、畸形或有假体植入, 则不纳入本研究. 骨测量指标包括全身、髋部和脊柱BMD, 本研究重点关注第1~4腰椎BMD (L1-4 BMD)和股骨颈骨密度(femoral neck bmd, FN BMD), 并采用世界卫生组织(WHO)推荐的OP诊断标准[10]:≤-2.5为OP, -2.5<<-1.0为骨量减少,≥-1.0为骨量正常, 其中,= (BMD实测值-同种族同性别正常青年人峰值骨密度)/同种族同性别正常青年人峰值骨密度的标准差.
1.2.3 BTMs、糖代谢指标与雌二醇检测
取研究对象清晨空腹外周静脉血, 分离血清后置-80℃保存待检. 采用罗氏Elecsys 2010电化学发光全自动免疫分析仪及原装配套试剂盒测定骨形成标志物骨钙素(osteocalcin, OCN)和I型前胶原氨基末端肽(type Ⅰ procollagen amino-terminal peptide, PINP)、骨吸收标志物β-异构化I型胶原羧基末端肽(beta-isomerized type I collagen carbox- terminal peptide, β-CTX)、INS以及性激素结合蛋白(sex hormone binding globulin, SHBG); 酶联免疫吸附法(IBL公司试剂盒)检测总雌二醇(total estradiol, TE2), 血清游离雌二醇(free estradiol, FE2)采用以下公式计算: FE2=TE2/(0.68×SHBG+ 1)[11], 式中FE2、TE2单位均为pmol·L-1, SHBG单位为nmol·L-1; 采用贝克曼库尔特公司AU5800全自动生化分析仪分析空腹血糖(fasting blood glucose, FBG), 并计算稳态模型评估的胰岛素抵抗(homeostasis model assessment of insulin resistance, HOMA-IR)指数: HOMA-IR=INS×FBG/ 22.5[12], 式中INS和FBG单位分别为μU·mL-1和mmol·L-1. 每次检测前均进行室内质控, 质控样本与检测样本平行操作. TE2测定的批内变异系数(CV)为1.99%, 批间CV为2.33%; 其他指标测定的批内CV均小于1%, 批间CV均小于3%.
1.3 统计分析
采用PASW Statistics 18.0软件分析数据. 正态分布数据以平均值±标准差表示, 非正态分布数据以中位数(四分位间距)表示, 并经自然对数转换后用于后续统计分析, 计数资料以例数(百分比)表示. 组间均数比较采用单因素方差分析, 多重比较采用LSD-检验, 各指标间的相关性采用Pearson相关分析, 多因素logistic回归用于比较各组OP患病风险.<0.05为差异有统计学意义.
2 结果
2.1 受试者基本资料特征
262名绝经后女性平均年龄(58.7±4.7)岁, 身高(159.1±5.2)cm, 体重(58.4±8.4)kg, BMI (23.0±3.0) kg·m-2; FE2 1.95 (0.78,4.56)pmol·L-1;糖代谢指标FBG (5.7±0.6)mmol·L-1, INS 7.0 (5.1,10.3)μU·mL-1, HOMA-IR 1.79 (1.27,2.66); 骨代谢指标OCN (26.6±11.8)ng·mL-1, PINP (50.3±25.9)ng·mL-1, β- CTX (401.5±228.1)pg·mL-1, L1-4 BMD (0.97±0.18) g·m-2, FN BMD (0.82±0.13)g·m-2; L1-4或FN BMD符合WHO诊断标准的OP患者76人, 骨量减少者98人, 骨量正常者88人.
2.2 糖代谢指标与人体测量学指标和雌激素的相关性
FBG仅与年龄呈正相关(<0.05), 而与身高、体重、BMI和FE2无相关性(>0.05); INS和HOMA-IR与体重、BMI和FE2均呈显著正相关(< 0.001), 而与年龄和身高无相关性(>0.05)(表1).

表1 糖代谢指标与人体测量学指标和雌激素的相关性(Pearson相关系数)
注: ln表示作自然对数转换,下表同; a)表示<0.001, b)表示<0.05.
2.3 骨代谢指标与人体测量学指标和雌激素的相关性
L1-4和FN BMD与年龄呈负相关(<0.01), 而与身高、体重、BMI和FE2呈正相关(<0.01);骨转换指标中PINP与所有指标无相关性(>0.05), β-CTX仅与年龄呈负相关(<0.05), OCN则与体重、BMI和FE2均呈负相关(<0.01)(表2).

表2 骨代谢指标与人体测量学指标和雌激素的相关性(Pearson相关系数)
注: a)表示<0.01, b)表示<0.05.
2.4 糖代谢与骨代谢指标的相关性
FBG仅与PINP呈负相关(<0.05), 而与BMD和其他BTMs无相关性(>0.05); INS和HOMA-IR与PINP和β-CTX均无相关性(>0.05), 而与L1-4 和FN BMD呈正相关(<0.01), 与OCN呈负相关(<0.01). 根据前述相关性分析结果控制BMI与FE2后做Pearson偏相关分析, 显示INS和HOMA- IR与L1-4 BMD、FN BMD和OCN的相关性均未达到显著性水平(>0.05)(表3).

表3 糖代谢与骨代谢指标的相关性
注:为Pearson相关系数,为校正BMI与FE2后的偏相关系数; a)表示<0.01, b)表示<0.05.
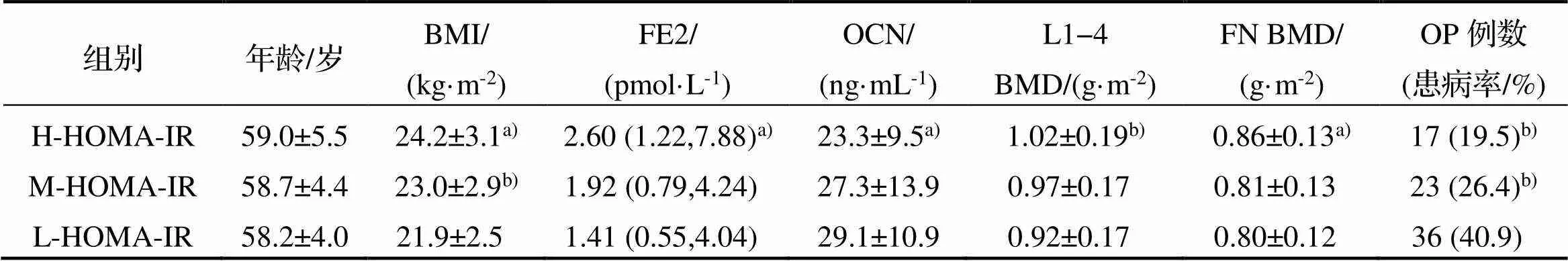
表4 H-HOMA-IR、M-HOMA-IR和L-HOMA-IR组各项指标比较
注: a)表示与M-和L-HOMA-IR组比较<0.05, b)表示与L-HOMA-IR组比较<0.05.
2.5 不同胰岛素抵抗水平组各项指标比较
以三分位法将研究对象按HOMA-IR水平分为高(H-HOMA-IR)、中(M-HOMA-IR)、低(L-HOMA- IR) 3组, 每组人数分别为87、87和88人, 3组各项指标见表4. 各组年龄比较无统计学意义(> 0.05); 由高到低3组BMI逐步降低, 且各组间两两比较均有统计学意义(<0.05); H-HOMA-IR组L1-4和FN BMD显著高于其他两组(<0.05), 但在校正BMI和FE2后差异消失(>0.05); 而H- HOMA-IR组OCN水平显著低于L-HOMA-IR组(=0.001), 校正BMI和FE2后差异仍有统计学意义(=0.027).
高、中、低3组OP病例数分别为17、23、36例, 患病率分别为19.5%、26.4%、40.9%. 多因素logistic回归显示H-HOMA-IR组(OR(95%CI)= 0.59(0.42,0.83),=0.003)和M-HOMA-IR组(OR (95%CI)=0.52(0.27,0.98),=0.044)患病风险显著低于L-HOMA-IR组, 但在校正BMI和FE2后差异消失(OR(95%CI)=0.81(0.55,1.18),=0.263和OR (95%CI)=0.68(0.34,1.35),=0.268).
3 讨论
骨细胞主要依靠糖酵解来产生细胞代谢所需的能量, 因此葡萄糖利用率的增加有可能上调成骨细胞和破骨细胞的代谢活性. 体外研究发现, 当暴露于高水平的葡萄糖时, 骨髓间充质干细胞和成骨细胞增殖增加[13-14]. 但也有研究报道高血糖可提高白细胞介素6和肿瘤坏死因子α等炎症因子和糖基化终末产物的水平, 从而触发细胞凋亡, 削弱成骨细胞的活性[15]. 此外, 高血糖还可通过增加RANK、RANKL等因子表达水平从而促进破骨细胞分化, 促进骨吸收[16-17]. 本研究发现FBG与骨形成时成骨细胞分泌的I型胶原代谢产物PINP呈负相关, 表明较高的血糖水平的确可能有抑制成骨细胞分化与活性进而抑制骨形成的作用, 从而对骨健康产生负性影响. 但也有研究报道, 在非糖尿病人群中FBG与BMD无相关性[18]. 本研究也未发现FBG与OCN、β-CTX和BMD之间存在相关性, 这可能是由于所纳入的研究对象的FBG均未达到糖尿病诊断水平, 其对破骨细胞功能与BMD的影响未达到可检测水平.
成骨细胞与破骨细胞均在胞膜上表达INS受体, 因此, INS信号通路可同时调节成骨细胞介导的骨形成和破骨细胞介导的骨吸收. 体外实验证实成骨细胞的INS受体为成骨细胞增殖和分化所必需[19]. 生理浓度的INS能提高成骨细胞增殖率, 促进胶原合成、碱性磷酸酶生成和葡萄糖摄取, 从而促进骨形成[19]. 然而, INS也通过降低骨保护素的表达从而促进破骨细胞形成, 有利于骨吸收[20]. 这说明INS可同时促进成骨和破骨细胞的分化及功能. Fu等[21]也证实血清INS水平与两种细胞相关基因的表达均呈正相关. 但是, INS缺乏大鼠模型表现为所有部位的骨形成缺失或减弱[22], INS绝对分泌不足的1型糖尿病患者BMD比非糖尿病对照组低且骨折风险增加[23], 提示INS的促骨形成作用相对占优势. 虽然本研究中INS与BMD呈正相关, 但在校正BMI和雌激素水平后相关性消失, 表明在非糖尿病绝经后女性中, INS对骨代谢无显著影响, 或因影响较弱而被体重和雌激素的作用所掩盖. 此外, 有研究显示血清INS水平与皮质骨BMD和厚度呈正相关, 而与松质骨BMD和微结构呈负相关[21], 因此, 本研究结果也不能排除是由于INS对不同部位骨代谢的不同影响相互抵消所造成.
胰岛素抵抗是否会影响及如何影响骨骼尚有争议. 小鼠模型研究发现, 在无高血糖的情况下, 高胰岛素血症和胰岛素抵抗有助于降低骨转换从而增加BMD[24]. 几乎所有关于骨和胰岛素抵抗关系的临床数据都来自于观察性研究. Abrahamsen等[18]报道, 在非糖尿病人群中, 高胰岛素抵抗者BMD较高. Shanbhogue等[25]也发现, 在非糖尿病绝经后白种女性中, 高HOMA-IR者具有较高的BMD和较健康的骨微结构, 且与体重无关, 但该研究未考虑激素的影响. 然而并非所有的研究都支持与胰岛素抵抗相关的高胰岛素血症具有促进骨形成作用. 一项涉及近1000名非糖尿病男性的横断面研究发现, HOMA-IR与桡骨远端小梁面积、桡骨和胫骨骨干的皮质骨面积及厚度呈负相关[26]. 另一项队列研究报告, 与非糖尿病患者相比, 新诊断为T2D的中年男性和女性的BMD更高, 其中女性的相关性更强, 但这种相关性在校正BMI后显著减弱或消失[27]. 在本研究中, 以HOMA-IR评价的胰岛素抵抗水平与BMD呈正相关, 但校正BMI和FE2后相关性消失. 多因素logistic回归也表明H-HOMA-IR组和M-HOMA-IR组OP患病风险显著低于L-HOMA-IR组, 但在校正BMI和FE2后差异也消失. 该结果提示高胰岛素抵抗及与之相关的高胰岛素血症可能通过BMI和激素间接影响BMD和OP发生风险. 一方面, 高BMI者体重较大, 而体重所代表的骨骼习惯性负荷是BMD重要决定因素, 低体重者的骨量与BMD往往低于正常体重者和超重者[28]. 另一方面, BMI较高者通常体脂含量较高, 脂肪组织可通过引起慢性低水平炎症、分泌脂肪因子、合成雌激素等机制间接调节骨代谢[29]. 由此可见, 胰岛素抵抗并非OP的独立保护或风险因素, 而伴有高胰岛素抵抗的T2DM患者骨折风险增加并非因为BMD的降低, 而可能是由于基质结构异常, 骨微结构被破坏, 骨骼脆性增加所致[30].
骨骼占人体总重量的15%左右并且代谢活跃. 有证据表明, 骨骼可以通过分泌一些激素样分子参与调节能量代谢, 其中成骨细胞分泌的OCN是研究热点[31]. 多项实验研究表明, OCN可作用于胰腺、脂肪、肌肉等器官, 引起胰岛素分泌和敏感性增加、能量消耗增加、血糖水平降低和内脏脂肪减少, 参与调节能量代谢[32], 但仍存在分歧. 例如, 最近的一项研究发现, 敲除基因的小鼠并未表现出血糖与胰岛素水平的异常[33]. 人群研究结果也并不一致, 在妊娠糖尿病患者中, 外周血OCN水平与INS分泌呈正相关[34], 中国绝经后女性血清OCN与血糖水平呈负相关[35]. Shea等[36]报道, 在老年男性和女性人群中, OCN与HOMA-IR呈负相关. 这些结果提示OCN可促进胰岛素分泌并增强外周组织胰岛素敏感性. 但是, 据Starup- Linde等[37]报道, 在健康人糖耐量试验中, OCN与血糖和INS水平无相关性. Lu等[38]在青年、中年和老年非糖尿病女性中也未发现OCN与血糖、INS和HOMA-IR具有相关性. 人群研究结果的不一致可能与研究对象的年龄、性别、种族差异, 是否患有糖尿病以及是否在统计分析中校正了混杂因素有关. 在本研究中, 虽然在校正BMI和FE2后非糖尿病绝经后女性OCN与INS的相关性消失, 但H- HOMA-IR组OCN水平仍显著低于L-HOMA-IR组, 该结果支持OCN可增强外周组织胰岛素敏感性的观点.
本研究结果表明, 在非糖尿病绝经后女性人群中, INS与胰岛素抵抗可能通过BMI和雌激素间接影响骨代谢和OP发生风险, 胰岛素抵抗并非OP的独立保护或风险因素, 而OCN可能通过影响外周组织胰岛素敏感性参与糖代谢.
[1] Anam A K, Insogna K. Update on osteoporosis screening and management[J]. The Medical Clinics of North America, 2021, 105(6):1117-1134.
[2] Xu L T, Wang Q, Wang Q J, et al. Concerted actions of insulin-like growth factor 1, testosterone, and estradiol on peripubertal bone growth: a 7-year longitudinal study[J]. Journal of Bone and Mineral Research, 2011, 26(9):2204- 2211.
[3] Consensus development conference: diagnosis, prophylaxis, and treatment of osteoporosis[J]. The American Journal of Medicine, 1993, 94(6):646-650.
[4] Lee S H, Park S Y, Choi C S. Insulin resistance: From mechanisms to therapeutic strategies[J]. Diabetes & Metabolism Journal, 2022, 46(1):15-37.
[5] Kahn S E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of type 2 diabetes[J]. Diabetologia, 2003, 46(1):3-19.
[6] Si Y, Wang C, Guo Y, et al. Prevalence of osteoporosis in patients with type 2 diabetes mellitus in the chinese mainland: a systematic review and meta-analysis[J]. Iranian Journal of Public Health, 2019, 48(7):1203-1214.
[7] Sato M, Ye W, Sugihara T, et al. Fracture risk and healthcare resource utilization and costs among osteoporosis patients with type 2 diabetes mellitus and without diabetes mellitus in Japan: Retrospective analysis of a hospital claims database[J]. BMC Musculoskeletal Disorders, 2016, 17(1):489.
[8] Räkel A, Sheehy O, Rahme E, et al. Osteoporosis among patients with type 1 and type 2 diabetes[J]. Diabetes & Metabolism, 2008, 34(3):193-205.
[9] Motyl K J, McCabe L R, Schwartz A V. Bone and glucose metabolism: A two-way street[J]. Archives of Biochemistry and Biophysics, 2010, 503(1):2-10.
[10] 中华医学会骨质疏松和骨矿盐疾病分会. 原发性骨质疏松症诊疗指南(2017)[J]. 中华骨质疏松和骨矿盐疾病杂志, 2017, 10(5):413-444.
[11] Wang Q J, Nicholson P H F, Suuriniemi M, et al. Relationship of sex hormones to bone geometric properties and mineral density in early pubertal girls[J]. The Journal of Clinical Endocrinology & Metabolism, 2004, 89(4):1698-1703.
[12] Kim S H, Choi Y J, Ahn M B, et al. Associations between sclerostin and anthropometric and metabolic parameters in children and adolescents[J]. Children, 2021, 8(9):788.
[13] Al-Qarakhli A M A, Yusop N, Waddington R J, et al. Effects of high glucose conditions on the expansion and differentiation capabilities of mesenchymal stromal cells derived from rat endosteal niche[J]. BMC Molecular and Cell Biology, 2019, 20(1):51.
[14] Freude T, Braun K F, Haug A, et al. Hyperinsulinemia reduces osteoblast activityvia upregulation of TGF-β[J]. Journal of Molecular Medicine (Berlin, Germany), 2012, 90(11):1257-1266.
[15] Araújo R, Martin V, Ferreira R, et al. A newmodel of the bone tissue response to the hyperglycemic environment - The embryonic chicken femur organotypic culture in high glucose conditions[J]. Bone, 2022, 158: 116355.
[16] Wang X, Feng Z, Li J, et al. High glucose induces autophagy of MC3T3-E1 cells via ROS-AKT-mTOR axis [J]. Molecular and Cellular Endocrinology, 2016, 429:62- 72.
[17] Qu B, Gong K, Yang H, et al. SIRT1 suppresses high glucose and palmitate-induced osteoclast differentiation via deacetylating p66Shc[J]. Molecular and Cellular Endocrinology, 2018, 474:97-104.
[18] Abrahamsen B, Rohold A, Henriksen J E, et al. Correlations between insulin sensitivity and bone mineral density in non-diabetic men[J]. Diabetic Medicine, 2000, 17(2):124-129.
[19] Fulzele K, Riddle R C, DiGirolamo D J, et al. Insulin receptor signaling in osteoblasts regulates postnatal bone acquisition and body composition[J]. Cell, 2010, 142(2): 309-319.
[20] Lecka-Czernik B. Diabetes, bone and glucose-lowering agents: Basic biology[J]. Diabetologia, 2017, 60(7):1163- 1169.
[21] Fu C, Zhang X, Ye F, et al. High insulin levels in KK-Ay diabetic mice cause increased cortical bone mass and impaired trabecular micro-structure[J]. International Journal of Molecular Sciences, 2015, 16(4):8213-8226.
[22] Thrailkill K M, Lumpkin C K Jr, Bunn R C, et al. Is insulin an anabolic agent in bone? Dissecting the diabetic bone for clues[J]. American Journal of Physiology Endocrinology and Metabolism, 2005, 289(5):E735- E745.
[23] Janghorbani M, van Dam R M, Willett W C, et al. Systematic review of type 1 and type 2 diabetes mellitus and risk of fracture[J]. American Journal of Epidemiology, 2007, 166(5):495-505.
[24] Huang S, Kaw M, Harris M T, et al. Decreased osteoclastogenesis and high bone mass in mice with impaired insulin clearance due to liver-specific inactivation to CEACAM1[J]. Bone, 2010, 46(4):1138- 1145.
[25] Shanbhogue V V, Finkelstein J S, Bouxsein M L, et al. Association between insulin resistance and bone structure in nondiabetic postmenopausal women[J]. The Journal of Clinical Endocrinology & Metabolism, 2016, 101(8): 3114-3122.
[26] Verroken C, Zmierczak H G, Goemaere S, et al. Insulin resistance is associated with smaller cortical bone size in nondiabetic men at the age of peak bone mass[J]. The Journal of Clinical Endocrinology & Metabolism, 2017, 102(6):1807-1815.
[27] Dennison E M, Syddall H E, Aihie Sayer A, et al. Type 2 diabetes mellitus is associated with increased axial bone density in men and women from the Hertfordshire Cohort Study: evidence for an indirect effect of insulin resistance? [J]. Diabetologia, 2004, 47(11):1963-1968.
[28] Wang L, You X, Zhang L, et al. Mechanical regulation of bone remodeling[J]. Bone Research, 2022, 10:16.
[29] Aguirre L, Napoli N, Waters D, et al. Increasing adiposity is associated with higher adipokine levels and lower bone mineral density in obese older adults[J]. The Journal of Clinical Endocrinology & Metabolism, 2014, 99(9):3290- 3297.
[30] Sanches C P, Vianna A G D, Barreto F C. The impact of type 2 diabetes on bone metabolism[J]. Diabetology & Metabolic Syndrome, 2017, 9:85.
[31] Zhou R, Guo Q, Xiao Y, et al. Endocrine role of bone in the regulation of energy metabolism[J]. Bone Research, 2021, 9:25.
[32] Fernandes T A P, Gonçalves L M L, Brito J A A. Relationships between bone turnover and energy metabolism[J]. Journal of Diabetes Research, 2017, 2017: 9021314.
[33] Diegel C R, Hann S, Ayturk U M, et al. An osteocalcin-deficient mouse strain without endocrine abnormalities[J]. PLoS Genetics, 2020, 16(5):e1008361.
[34] Winhofer Y, Handisurya A, Tura A, et al. Osteocalcin is related to enhanced insulin secretion in gestational diabetes mellitus[J]. Diabetes Care, 2010, 33(1):139-143.
[35] Jiajue R, Liu S, Pei Y, et al. Associations between osteocalcin, calciotropic hormones, and energy meta- bolism in a cohort of Chinese postmenopausal women: Peking vertebral fracture study[J]. International Journal of Endocrinology, 2021, 2021:5585018.
[36] Shea M K, Gundberg C M, Meigs J B, et al.-Carboxylation of osteocalcin and insulin resistance in older men and women[J]. The American Journal of Clinical Nutrition, 2009, 90(5):1230-1235.
[37] Starup-Linde J, Westberg-Rasmussen S, Lykkeboe S, et al. Glucose tolerance tests and osteocalcin responses in healthy people[J]. Frontiers in Endocrinology, 2018, 9:356.
[38] Lu C, Ivaska K K, Alen M, et al. Serum osteocalcin is not associated with glucose but is inversely associated with leptin across generations of nondiabetic women[J]. The Journal of Clinical Endocrinology & Metabolism, 2012, 97(11):4106-4114.
Association between insulin resistance and bone metabolism in non-diabetic postmenopausal women
LIN Yihe1, LIU Fang1, NIU Yadan1, LI Dongmei2, LI Yuning3, XU Ranxing3, CHEN Qingshan4, XU Leiting1*
( 1.School of Medicine, Ningbo University, Ningbo 315211, China; 2.Minglou Community Health Service Center, Ningbo 315040, China; 3.Ningbo No.6 Hospital, Ningbo 315040, China; 4.Dongliu Community Health Service Center, Ningbo 315040, China )
The current study was aimed to investigate the relationship between insulin (INS) resistance and bone metabolism, the bone mineral density (BMD) of lumbar spine L1-4 and femoral neck (FN) in 262 non-diabetic postmenopausal women who were diagnosed by dual-energy X-ray absorptiometry. Bone turnover markers, glucose metabolism and estrogen levels in peripheral blood were measured. The results showed that INS and homeostasis model assessment of insulin resistance (HOMA-IR) index were positively correlated with L1-4 and FN BMD (<0.01). However, the correlation did not hold after controlling body mass index (BMI) and free estradiol (FE2) levels (>0.05). OP risk in the high HOMA-IR group (OR=0.59,=0.003) and middle HOMA- IR group (OR=0.52,=0.044) was significantly lower than that in the low HOMA-IR group. However, the difference was no longer existing after adjusting for BMI and FE2 (OR=0.81,=0.263 and OR=0.68,=0.268, respectively). The osteocalcin (OCN) level in the high HOMA-IR group was significantly lower than that in the low HOMA-IR group (=0.001) and the difference was still statistically significant even after adjusting for BMI and FE2 (=0.027). Therefore, INS resistance was not an independent protective or risk factor for OP in non-diabetic postmenopausal women. OCN may be involved in glucose metabolism by influencing peripheral tissue INS sensitivity.
insulin resistance; osteoporosis; bone mineral density; bone turnover markers
2022−02−27.
宁波大学学报(理工版)网址: http://journallg.nbu.edu.cn/
浙江省自然科学基金(LY16H070001).
林伊荷(1995-), 女, 浙江舟山人, 在读硕士研究生, 主要研究方向: 骨质疏松症队列研究. E-mail: 5321798@qq.com
通信作者:徐雷艇(1973-), 男, 浙江舟山人, 博士/副研究员, 主要研究方向: 骨质疏松症人群与基础研究. E-mail: xuleiting@nbu.edu.cn
R592
A
1001-5132(2022)03-0063-07
(责任编辑 韩 超)

