过表达花生ABA途径抗逆基因AhLOS5提高转基因烟草的耐盐性研究
武晓亮,焦娟,张连,张利民,张艳艳,赵瑞仝,李文金
(泰安市农业科学院,山东 泰安 271000)
目前我国土壤次生盐渍化现象日趋严重,盐碱地总面积3600万hm2,其中盐碱耕地920万hm2[1]。选育耐盐作物品种能够有效开发并利用盐碱地,提高资源利用率。
花生(Arachis hypogaeaL.)是我国单产、总产和出口创汇额最高的油料作物,对保障我国食用油供给安全、改善和提高我国城乡居民营养水平具有重要意义。花生属中等耐盐作物,以其扎根深、能够充分利用所吸收的少量水分、适应性强成为适应盐碱旱薄地的优势农作物[2]。在全球范围内,70%的花生作物种植于相对盐碱旱薄地区[3,4]。因此加强花生耐盐性研究,发展盐碱地花生生产,在提高盐碱地区资源利用率方面具有重要作用。
脱落酸(abscisic acid,简称ABA)是高等植物中普遍存在的一种植物调节激素,具有促进叶片和果实脱落,促进芽休眠和抑制萌发,抑制生长、促进衰老等作用。Bueno等[5]最早在烟草中发现过氧化物酶(POD)的活性在ABA处理后明显升高,缓解了过氧化氢对烟草植株的伤害。盐胁迫下,ABA处理可通过减少玉米活性氧(ROS)的产生提高抗逆性[6]。2002年,研究人员发现ABA处理可通过提高植物体内抗氧化酶[超氧化物歧化酶(SOD)、谷胱甘肽还原酶(GR)和抗坏血酸过氧化物酶(APX)]的活性提高抗逆性[7]。目前ABA被公认为能够诱导植物产生对不良环境的抗性,是植物的“抗逆诱导因子”。
ABA生物合成途径的关键基因包括编码玉米黄质环氧化酶的ZEP基因、编码9-顺式环氧类胡萝卜素双加氧酶的NCED基因和编码钼辅因子硫酸化酶的LOS5基因等[8-11]。Park等[8]在拟南芥中过表达AtZEP基因,盐胁迫条件下转基因植株生长更旺盛。Aswath等[12]将豇豆VuNCED1基因转化匍匐剪股颖,盐胁迫时可增加内源ABA的含量,提高转基因植株的存活率。Zhang等[13]将拟南芥LOS5基因转入玉米后,改善了根细胞离子通道和叶片含水量,耐盐性得以提高;将LOS5基因分别转入甘薯和黄瓜后,转基因植株醛氧化酶活性显著提高,ABA积累增多,耐盐性增强[14,15];LOS5基因转入水稻和大豆后,转基因植株均表现出良好的抗逆性[16,17]。因此,ABA生物合成相关基因在植物逆境胁迫中起着重要的调控作用,可能具有重要的育种应用价值。
为了探究花生ABA途径抗逆基因AhLOS5的耐盐性功能,本研究以野生型(WT)三生烟、T1代AhLOS5过表达以及RNAi转基因烟草株系为研究对象,进行了耐盐性生物学功能分析,以期为进一步研究AhLOS5基因的功能,并指导花生耐盐育种奠定基础。
1 材料与方法
1.1 试验材料
试验于2020年4月在泰安市农业科学院生物工程研究所进行。三生烟(Nicotiana tabacumL.cv.Samsun)温室常规管理。转基因烟草株系为本实验室前期获得:AhLOS5基因过表达株系和RNAi株系分别通过携带AhLOS5基因相关片段的pBI121正义表达载体和反义表达载体,农杆菌介导法转化三生烟叶片获得。其中正义表达载体携带AhLOS5基因全长cDNA;反义表达载体携带与烟草中LOS5基因同源性达84.07%的269 bp片段,该片段位于1288~1557 bp,最长的完全一致序列长度为28 bp,符合RNAi要求。本试验所用转基因株系为T1代正义转基因株系LOS5-9和反义转基因株系LOS5-R-7。
1.2 RNA提取
采用RNA simple总RNA提取试剂盒(QIAGEN公司)提取,用1.2%琼脂糖凝胶电泳检测RNA的完整性。
1.3 Northern blot检测
将经6%聚丙烯酰胺凝胶电泳分离的RNA转移至尼龙膜上,65℃杂交箱预杂交12 h;以α-32P-dCTP标记的目标基因片段为探针,65℃过夜杂交;杂交后的膜于2×SSC(含0.1%SDS)及0.2×SSC(含0.1%SDS)洗液中清洗2次;将尼龙膜与X-光片紧密贴合,置于X射线曝光暗盒中,放置在-80℃冰箱中放射自显影48 h。在暗室中经显影、停影和定影,观测Northern blot检测结果。
1.4 转基因烟草耐盐性测定
幼苗根长测定:将野生型与正义和反义转基因植株的T1代种子分别播种于1/2MS培养基上,置于25℃光照培养箱(16 h光照/8 h黑暗)。萌发后,选择生长一致的烟草苗各20株,分别置于含有100 mmol/L NaCl的1/2MS液体培养基(NaCl)和正常1/2MS液体培养基(CK),7 d后测量根长。
叶片萎蔫症状检测:将生长至6叶期的野生型和正义以及反义转基因烟草各20株带根部取出,自来水洗净土壤,浸入含100 mmol/L NaCl溶液的1/2MS液体培养基。以正常1/2MS液体培养基处理为对照(CK)。盐胁迫处理4 d后观察植株叶片萎蔫程度。
1.5 转基因烟草理化指标的测定
将种子用75%乙醇清洗3 min,用含50 mL Tween-20、有效氯2.6%的NaClO消毒10 min,无菌ddH2O(含100 mL Tween-20)清洗2次。将消毒后的烟草种子播于筛选培养基(1/2MS培养基,含卡那霉素100 mg/L,羧苄青霉素250 mg/L)上,4℃培养3 d,转到28℃培养7 d。7 d后选择根系发达、叶色浓绿的幼苗进行移栽,室温生长7 d后进行理化指标测定。叶绿素含量、丙二醛含量(MDA)、相对电导率、抗氧化酶活性(APX、POD、SOD、CAT)、抗氧化物质含量(GSH和ASA)、脯氨酸(proline)及内源ABA含量测定方法参照《植物生理生化实验原理和技术》[18],重复3次。
1.6 数据处理
采用Sigma Plot进行数据处理,用SPSS 21.0进行差异显著性分析(P<0.05)。
2 结果与分析
2.1 转烟草植株AhLOS5基因的表达量
Northern blot检测结果(图1)显示,转正义AhLOS5基因的烟草植株中AhLOS5基因过量表达,转反义AhLOS5基因的烟草植株成功抑制了AhLOS5基因的表达。

图1 烟草植株Northern blot检测结果
2.2 转基因烟草植株耐盐性
正常条件下,WT、LOS5-9与LOS5-R-7烟草幼苗平均根长分别为4.0、3.8、3.9 cm,差异不显著。盐胁迫条件下,WT和转基因烟草幼苗根长都较正常条件下的短,其中LOS5-9平均根长为2.9 cm,显著大于WT的1.7 cm和LOS5-R-7的1.4 cm(图2)。

图2 不同处理烟草幼苗根长
结果(图3)显示,盐胁迫下,转基因和WT烟草植株叶片均出现不同程度的萎蔫。LOS5-9转基因植株萎蔫症状轻微,WT和LOS5-R-7烟草植株均出现明显的萎蔫症状。

图3 植株叶片萎蔫程度检测
2.3 过表达AhLOS5转基因植株耐盐机制
2.3.1 盐胁迫下烟草植株的细胞膜完整性 盐胁迫下,植物会受到过氧化伤害,导致叶绿素生物合成降低、分解加速,表现为MDA含量和相对电导率上升,叶绿素含量下降。结果(图4)表明,正常生长条件下,转基因与WT烟草植株MDA含量、相对电导率和叶绿素含量无显著差异。盐胁迫下转基因和WT烟草植株的MDA含量、相对电导率均显著升高,叶绿素含量显著降低。LOS5-9转基因植株MDA含量和电导率升幅最小,WT烟草植株次之,LOS5-R-7转基因植株升幅最大。LOS5-9转基因植株叶绿素含量降幅最小,WT烟草植株次之,LOS5-R-7转基因植株降幅最大。表明过表达AhLOS5转基因植株细胞膜受盐胁迫的伤害较小。
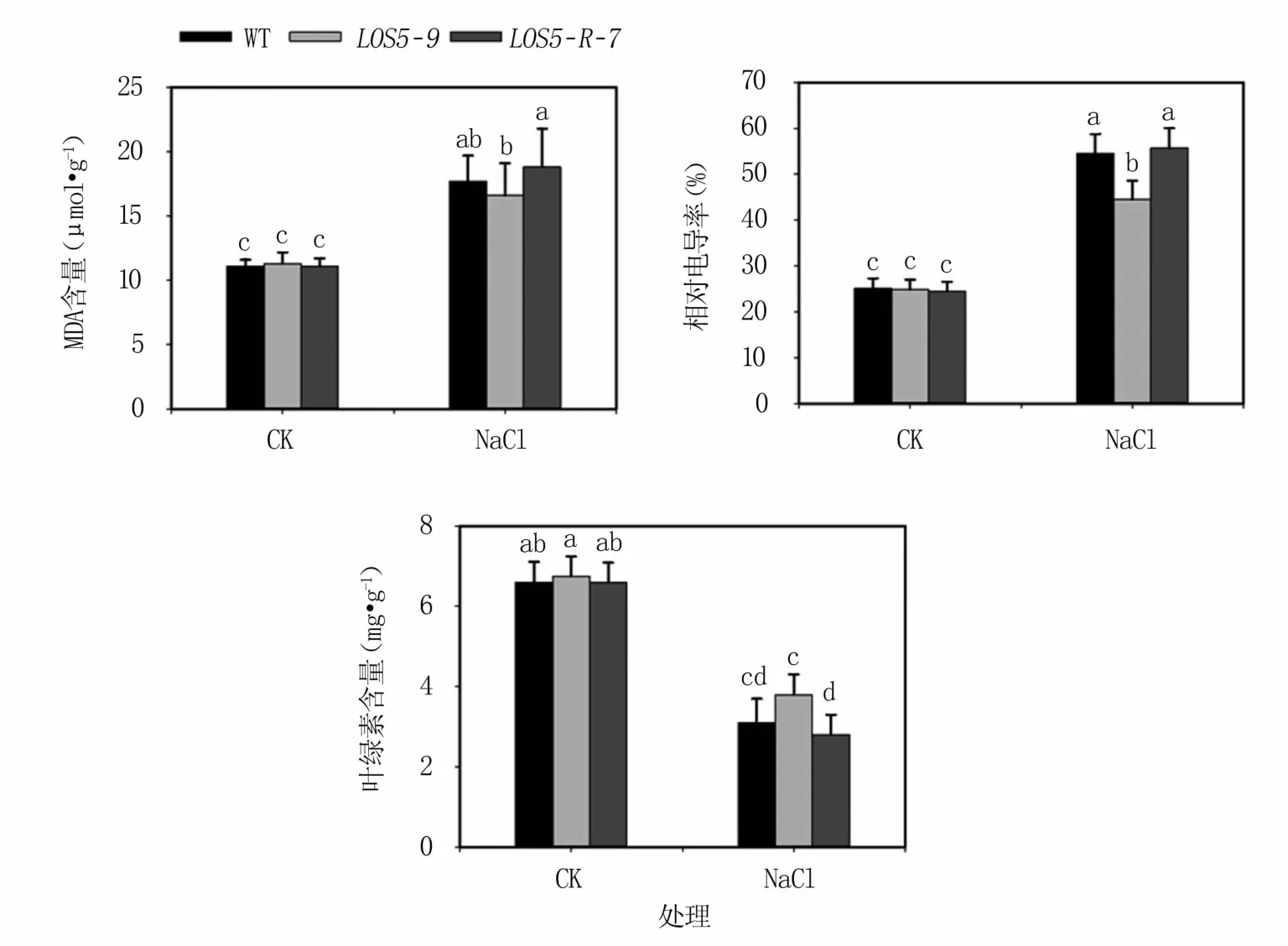
图4 盐胁迫下转基因烟草植株电导率、MDA和叶绿素含量变化
2.3.2 盐胁迫下烟草植株抗氧化酶活性和抗氧化物质含量 SOD、POD、APX和CAT是植物体内4种重要的抗氧化酶。SOD是活性氧清除系统中第一个发挥作用的抗氧化酶,在活性氧大量生成的部位催化超氧离子的歧化反应;POD、APX和CAT也是清除植物活性氧的关键酶。GSH和ASA可以清除由盐胁迫诱导的过量活性氧;ASA还是维持APX活性的重要物质[19]。
结果(图5)表明,正常生长条件下,转基因与WT烟草植株4种抗氧化酶活性以及两种抗氧化物质含量均无显著差异。盐胁迫下转基因和WT烟草植株的抗氧化酶活性和抗氧化物质含量均显著升高,其中LOS5-9转基因植株抗氧化酶活性和抗氧化物质含量升幅最大,WT烟草植株次之,LOS5-R-7转基因植株升幅最小。
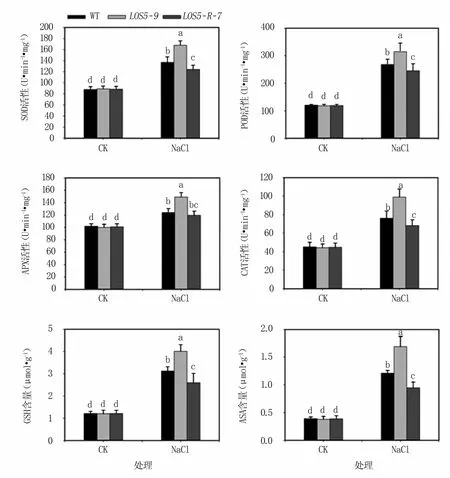
图5 盐胁迫下烟草植株抗氧化酶活性和抗氧化物质含量变化
2.3.3 盐胁迫下烟草植株内源ABA和脯氨酸含量 ABA是植物内源合成的重要激素之一,盐胁迫下ABA增加可引起气孔关闭,减少水分蒸腾,还可通过促进植物根的生长并抑制茎的生长实现对盐胁迫的应答。脯氨酸是一种重要的渗透调节物质,可以保护植物在遇到逆境时免受进一步的伤害。由图6可知,正常生长条件下,植物体内源ABA和脯氨酸的含量均较低,野生与转基因植株间无显著差异。盐胁迫条件下,烟草植株体内的ABA及脯氨酸含量急剧增加,LOS5-9转基因植株的升幅最大,WT植株次之,LOS5-R-7转基因植株升幅最小。其中LOS5-9转基因植株的内源ABA和脯氨酸含量比WT烟草植株分别高35.26%和40.97%,比LOS5-R-7转基因植株分别高72.87%和1.38倍。

图6 盐胁迫下烟草植株内源ABA和脯氨酸含量变化
2.4 盐胁迫相关调控基因的表达分析
为明确过表达AhLOS5基因提高转基因烟草耐盐性的作用机理,对其他抗逆相关基因在转基因烟草中的表达模式进行了Northern blot检测,包括P5CS、RD22和DREB2B。根据前人研究,DREB2B编码一个与DRE顺式作用元件结合的反式作用因子,通过调控DRE基因提高植物抗逆性,是不依赖ABA的抗逆途径[20]。RD22的启动子中具有胁迫应答转录因子MYC和MYB顺式结合位点,是依赖ABA抗逆途径中的重要基因[21,22]。P5CS是催化脯氨酸生物合成的关键酶,参与依赖ABA的抗逆胁迫途径[23]。
结果(图7)显示,在WT烟草植株中,P5CS、RD22和DREB2B基因在正常条件下都有较低水平的表达,盐胁迫可以诱导3个基因的超表达,说明3个基因都参与了植物抗盐反应。在LOS5-9转基因植株中,P5CS和RD22两个基因受胁迫诱导表达的程度明显高于WT烟草植株,而DREB2B基因的诱导表达程度则与WT植株无显著差异。LOS5-R-7转基因植株中,盐胁迫仅显著诱导DREB2B基因的超表达。说明AhLOS5与P5CS和RD22相同,都属于ABA途径相关的抗逆基因。

图7 盐胁迫下抗逆相关基因在烟草中的表达
3 讨论与结论
植物抵御逆境胁迫的途径可分为两类,即依赖内源ABA的抗逆途径和不依赖ABA的抗逆途径。依赖ABA的抗逆途径可引起内源ABA的积累,且对外源施加的ABA发生显著的生物学效应,这一信号传导途径称为依赖ABA的信号传导途径[22,24]。逆境胁迫时,外源喷施ABA可以增强抗氧化酶活性,降低活性氧含量,防止叶绿素降解,增大叶片相对含水量,减小质膜透性及丙二醛含量,增强PSⅡ的修复功能。在盐胁迫下,植物体内ABA含量迅速增加,可降低叶片伸展率,调整保卫细胞离子通道;抑制气孔开放、促进气孔关闭,保持正常生命活动[25,26]。
在转ABA生物合成相关基因的转基因植株中,内源ABA积累是一个共性特征,包括转AtZEP基因的拟南芥,转NCED基因的番茄、拟南芥、烟草[8-10,27]。Xiong等[28]在2002年发现非生物胁迫下内源ABA的生物合成机制:首先渗透压的改变诱导了NCED的表达,启动了逆境胁迫ABA生物合成的第一步;ABA含量的波动引起随后一系列ABA生物合成相关基因的表达,包括AAO、LOS5以及ZEP等基因,更增加了ABA的生物合成;这种多基因互作的协同效应最终使植株内源ABA积累量迅速增加。与本试验结果一致。转基因植株ABA通过调控许多受内源ABA诱导的胁迫应答基因,启动了更多的生物合成,使得植物的抗逆性进一步增强。这也可以解释本试验中正义转基因烟草在盐胁迫下根长更长、胁迫耐受性更强的现象。
活性氧是植物盐胁迫环境下产生的有害物质,可损坏细胞膜,造成膜脂过氧化,同时引起MDA在细胞中积累和相对电导率升高,影响细胞中蛋白质的合成。胁迫产生的ABA信号同时会激活细胞内多种抗氧化酶活性,包括SOD、POD、CAT和APX,这些过氧化物酶可以清除细胞中的活性氧,以保护细胞免受过氧化伤害[7]。本试验结果显示,在盐胁迫下,转基因植株和非转基因植株都出现了MDA积累和相对电导率增加的现象;而正义转基因植株的抗氧化酶活性更高,MDA含量和相对电导率更低。
为进一步证明过表达AhLOS5转基因烟草耐盐性是由盐胁迫诱导产生的内源ABA调控的,本试验选取了另外3个胁迫相关基因,研究其在不同烟草植株中的表达模式。结果显示,在正义转基因植株中,4个抗逆基因都受到盐胁迫的诱导而超表达;而在反义转基因植株中,盐胁迫只能诱导不依赖ABA途径的DREB2B基因的超表达,却不能诱导ABA途径的P5CS和RD22的过量表达。证明了LOS5基因的抗逆途径与DREB2B不同,而与P5CS、RD22相同,都属ABA途径的抗逆基因,过表达AhLOS5基因的转基因烟草植株获得的耐盐性是由胁迫诱导产生的内源ABA调控的。本研究为进一步探索AhLOS5基因在花生抗逆育种中的应用提供了理论基础。

