植物对盐碱胁迫响应机制的研究进展
魏嘉,蔡勤安,李源,尚丽霞,卜显锋,于志晶,马瑞
(1.吉林省农业科学院农业生物技术研究所/吉林省农业生物技术重点实验室,吉林 长春 130033;2.吉林省农业技术推广总站,吉林 长春 130033)
盐碱和干旱等非生物胁迫严重限制作物产量[1]。在非生物胁迫中,高盐碱胁迫是最为严重的一种环境胁迫,它损害全球至少20%灌溉土地的作物生产。中国盐碱化土壤总面积约1亿hm2,约占世界盐碱地面积10%,耕地中盐渍化面积高达920.9万hm2,占全国耕地面积6.62%[2,3]。伴随工业排污,农业生产中不合理的灌溉方式等原因,生态系统遭到破坏,土壤盐碱化日益加重,次生盐碱地面积逐年扩大。盐碱土的综合治理和植物耐盐性的提高已成为农业可持续发展和环境改善的重要内容。为了应对盐碱胁迫,植物已经在细胞、器官和整个植株水平上进化出复杂的盐碱响应信号和代谢过程。对植物耐盐碱机制的研究,可为提高植物耐盐碱能力和作物品种改良提供重要的科学参考和理论依据。
1 盐碱胁迫对植物的危害
盐碱胁迫对植物产生很多危害,主要形成离子危害、渗透胁迫和氧化胁迫,除此之外,碱胁迫会导致根际土壤pH升高形成高pH胁迫,多种胁迫的积累会影响植物根系对矿质元素的吸收,阻碍植物的各种生理代谢活动,抑制植物正常生长,从而导致植物早衰甚至死亡(图1)[4,5]。

图1 盐碱胁迫对植物的危害
1.1 离子毒害
植物需要从土壤中吸收多种矿物元素来维持正常生长,通常定位在植物细胞膜的离子转运蛋白通过调节其净流量以适应细胞需求,从而建立起体内离子动态平衡。盐碱化使土壤各离子间动态失衡,导致植物根系吸收离子不均衡进而产生离子毒害作用。盐胁迫主要以NaCl形式为主,植物对Na+和K+的吸收机制类似,两种阳离子的吸收存在竞争关系[6],根际过量的Na+抑制植物对K+的吸收,导致植物体内酶合成受阻;此外,Na+的过量积累会减少植物对Ca2+的吸收,从而破坏细胞膜和细胞壁结构的稳定性以及干扰信号传导[7]。因此,重新建立细胞离子稳态对于植物适应盐环境、维持代谢功能和生长至关重要。
1.2 渗透胁迫
植物细胞的水分获取以渗透吸水为主,其主要动力来源为渗透压。正常情况下,植物细胞的渗透压高于土壤溶液,植物细胞则通过高渗透压吸收土壤中的水分和矿物元素。盐碱胁迫会使土壤盐浓度高于植物体生长所需的盐浓度,导致植物对水分的吸收能力减弱甚至外渗,产生渗透胁迫[8]。研究表明,渗透胁迫属于植物响应盐碱胁迫的初级胁迫,反应迅速且持续时间短,影响植物从土壤中吸收维持正常生长所需的养分及矿物质,严重时造成植物生理干旱,蒸腾作用降低、气孔关闭,抑制叶片的光合作用[9,10]。
1.3 活性氧胁迫
活性氧(reactive oxygen species,ROS)是植物有氧代谢的副产物,正常环境情况下,ROS的产生与清除处于动态平衡状态,而当植物遭受严重的盐碱胁迫后,伴随形成的离子胁迫以及渗透胁迫导致气孔关闭、光合速率降低以及叶绿体光化学反应改变,打破其动态平衡,导致植物细胞器(叶绿体、过氧化物酶体等)过度积累ROS,产生氧化胁迫[11]。氧化胁迫对细胞的几乎所有组分都有影响,表现为DNA片段氧化作用,RNA降解,脂质和蛋白质的氧化、修饰和破坏,最终导致植物生长发育和生产力下降[12,13]。
1.4 高pH胁迫
前人研究认为盐胁迫是中性盐形成的胁迫,碱胁迫是碱性盐形成的胁迫[14]。碱胁迫与盐胁迫的比较揭示了碱胁迫附加的高pH胁迫,即盐胁迫和碱胁迫都是以渗透胁迫和离子伤害为基础,然而碱胁迫在盐胁迫形成的有害因素基础上还形成高pH胁迫。碱胁迫引起的高pH胁迫可以破坏根的细胞结构,导致根的正常生理功能丧失[15,16],抑制Cl-、NO-3、H2PO-4等离子的吸收,从而严重影响K+和Na+的代谢,破坏植物代谢稳态[17]。
2 植物响应盐碱胁迫的生理机制
植物为了应对盐碱胁迫,通过长期进化形成了复杂的适应机制,包括渗透调节、选择性离子吸收/排斥、有毒离子的区室化、光合和能量代谢的调节、抗氧化酶的积累、激素的调节、相容产物的合成和细胞结构的修饰等。
2.1 渗透调节物质的合成
盐胁迫可以制约植物的生长和发育。第一个制约因素是渗透压力(外部水势的降低),损害植物吸收水分的能力。为了解决这个问题,植物通常通过两种主要途径实现渗透调节:其一是通过增加对无机离子的吸收,在40~60 min内,根中大部分细胞膨压被恢复,生长得以恢复,尽管速度降低[18];其二,植物通过在细胞中合成有机渗透调节物质,提高溶质浓度,从而从外界吸收水分。渗透调节能力的提高是植物耐盐碱的重要生理机制。有机渗透调节物质包括脯氨酸(proline,Pro)、可溶性糖、甘氨酸甜菜碱(glycine betaine,GB)和有机酸等。
在植物正常的生理pH范围内,游离脯氨酸不带净电荷,对植物生理代谢无毒无害,是一种有效的有机渗透调节物质,其在植物适应盐碱胁迫过程中发挥重要作用。张天俊等[19]发现,在不同强度盐碱胁迫条件下,菊芋幼苗不同部位的脯氨酸含量主要呈上升趋势。蓝果忍冬(Lonicera caeruleaL.)的正常生长对土壤要求不严:苏雅等[20]对蓝果忍冬进行盐胁迫后发现,随着Na+浓度的增加,其体内脯氨酸、可溶性糖含量均呈上升趋势;伴随盐胁迫形成的ROS积累,导致“蓝精灵”品种发生生理代谢紊乱,但其仍然可以通过合成并积累渗透调节物质维持细胞保水力,从而提高对NaCl胁迫引起的渗透胁迫的适应程度。
甜菜碱(betaine)广泛存在于植物体内,是具有稳定蛋白质四级结构和高度有序的次生代谢产物,其生物合成途径比较简单,由胆碱(choline)在胆碱单氧化酶(choline monooxygenase,CMO)和甜菜碱醛脱氢酶(betaine aldehyde dehydrogenase,BADH)的氧化作用下产生。研究表明,过量表达BADH基因,提高植物细胞中甜菜碱含量,从而提高植物抗逆能力[21]。盐碱胁迫期间,甜菜碱除了通过调节渗透压参与渗透调节作用,还可以通过影响植物体内离子分布、稳定蛋白质结构、保护光合系统进而缓解胁迫伤害[22]。此外,体外添加甜菜碱可以通过调节其光合作用、能量代谢、抗氧化酶活性等生理过程,缓解氧化损伤,从而提高植物抗盐性,这也为证明甜菜碱与植物耐盐性相关提供了有力证据[23,24]。
2.2 离子的吸收转运调节
盐碱胁迫植物存在过量的Na+,为了防止发生离子毒害,Na+从根中排除、根冠运输的调节以及Na+的细胞区室化是提高植物耐盐性的几个重要方面[25]。
非盐生植物的耐盐响应机制通常表现为根系对Na+的限制性吸收,并且选择性降低地下部向地上部尤其是向叶片和籽粒的运输,而选择性地增加对K+的运输,从而维持叶片中较低的Na+浓度。沙枣(Elaeagnus angustifoliaLinn.)适应盐胁迫的机制:一方面是提高根系对Na+的积累与限制作用以及根冠对Na+的忍耐,另一方面是通过提高根、茎和叶片对K+、Ca2+的选择性运输能力以限制器官中Na+浓度,从而缓解盐害[26]。
盐生植物受到盐胁迫时,通常将Na+从细胞质和细胞器中转移并分隔至液泡中,调节细胞中的离子浓度以维持其相对稳态,缓解盐胁迫,这种现象称为盐的离子区域化。Munns等[27]通过量化Na+和Cl-在植物中运输的调节,以及根中有机溶质渗透调节的成本,显示:在高盐度下生长的植物中,因为有机渗透物质的合成具有非常高的碳成本,使用这种策略的植物能够在胁迫条件下存活,但可能生长不良。通过无机离子吸收进行渗透调节的碳成本比通过有机渗透电解质合成低一个数量级,在Na+毒性解决的情况下通常前者是优选。盐生植物就是这种情况[28],在无机渗透剂中,K+在细胞中最丰富,因此无毒是优选。然而,在盐胁迫条件下吸收K+有额外的成本,而Na+以高浓度存在于土壤中,可以被动吸收。因此,盐生植物依靠Na+作为“廉价的渗透物质”来维持细胞膨压,然后通过增加有机渗透物质的积累来调节胞质的渗透势,使之与液泡的渗透势相匹配。碱蓬[Suaeda salsa(Bunge)Bunge]是一种典型的盐生植物,通过最大程度地将Na+转移并集中于液泡中,以维持细胞内的离子平衡,从而适应盐胁迫;目前已从盐地碱蓬中克隆的相关基因有:SeNHX1、SeVHA-A、SeVP1和SsSOS1,分别编码Na+/H+转运蛋白、V-H+-ATPase酶、VH+-PPase酶和Na+/H+逆向转运蛋白,它们在其液泡盐离子区域化中发挥重要作用[29-32]。
2.3 活性氧清除机制
正常生长条件下,植物体内ROS的产生和清除处于动态平衡中,且对植物无害。然而,在盐碱胁迫下,植物线粒体和叶绿体中电子传递链的过度还原产生大量ROS引起氧化胁迫。这时,为了维持ROS平衡,缓解盐碱胁迫损害,植物体内进化出活性氧清除系统,主要为两类物质:一类是由超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(aseorbateperoxidase,APX)、谷胱甘肽过氧化物酶(glutathione peroxidase,GPX)等组成的酶类清除系统;另一类是由谷胱甘肽(L-glutathione,GSH)、抗坏血酸(ascorbate acid,AsA)、类胡萝卜素(carotenoid,Car)、维生素E等抗氧化还原物质组成的非酶类系统[33]。
SOD是活性氧清除系统中第一个发挥作用的抗氧化酶。植物在逆境胁迫时,ROS在SOD的催化歧化反应作用下生成H2O2和O2,避免或减轻氧化胁迫对植物细胞产生的伤害[34]。盐胁迫条件下,耐盐番茄(Lycopersicon pennellii)根系细胞中过氧化物酶体出现脂质过氧化和H2O2水平降低,SOD、APX和CAT活性增强[35]。在植物中,CAT的主要功能是专一性地清除光呼吸、线粒体电子传递和脂肪酸氧化等过程中产生的过量H2O2,以防止过多ROS积累所形成的氧化胁迫对植物造成伤害[36]。SOD、POD、CAT是反映植物抗氧化水平的重要因素,并且三者在植物活性氧清除系统中共同参与ROS清除反应。对景天三七(Sedum aizoonL.)幼苗进行不同盐浓度胁迫处理,通过观察其生长情况,以及生理生化指标的测定发现,0.4%以下盐浓度胁迫可以促进其生长,体内SOD、CAT及POD活性提高,从而增强植物抗盐性[37]。李志刚等[38]通过比较不同生境牧草的抗氧化酶活性发现,在活性氧清除系统中,盐生牧草主要通过SOD和CAT发挥作用,沙生牧草主要通过POD发挥作用。
GPX途径通常被认为是针对氧化膜损伤的主要酶防御系统[39]。GPX可以通过GSH和/或其它还原等价物将H2O2还原成相应的羟基化合物。胡杨(Populus euphraticaOlicv.)是中国西北盐碱地区域天然进化形成的森林树种,具有极强的抗盐碱能力。将胡杨PeGPX基因转入烟草(Nicotiana tabacumL.),在盐胁迫条件下,与野生型相比,转基因烟草的净光合速率受到的胁迫影响程度显著降低,GPX活性显著提高,说明过表达PeGPX基因显著调高烟草的耐盐性[40]。此外,谷胱甘肽硫转移酶(glutathione S-transferases,GSTs)具有GPX活性,可以利用GSH将脂肪酸和核酸的有机氢过氧化物还原成相应的单羟基醇。GSTs在防止有机氢过氧化物降解为细胞毒性醛衍生物方面起着关键作用,因此,它们可以保护植物免受盐胁迫形成的氧化损伤[41]。GSHAsA循环是清除细胞质、线粒体、叶绿体和过氧化物酶体中产生的H2O2的最重要抗氧化保护系统之一,在这个循环中,H2O2被APX在AsA为电子供体条件下还原成H2O。
2.4 外源物质的调节
外源物质可以通过调节植物代谢活动从而减缓盐害,利用外源物质提高植物耐盐性已逐步成为研究植物耐盐胁迫机理的有效方式。其中外源物质如一氧化氮(nitric oxide,NO)、硫化氢(hydrogen sulfide,H2S)、过氧化氢(hydrogen peroxide,H2O2)、脱落酸(abscisic acid,ABA)、水杨酸(salicylic acid,SA)等作为信号分子在逆境信号转导过程中扮演重要角色,在调控植物体内一系列的生理代谢过程中发挥重要作用。
NO是一种化学性质非常活泼的气体分子,是细胞间的通讯物质,参与调节植物生长代谢的许多过程,还可作为重要的信号分子参与植物对胁迫的响应。NO的作用取决于其细胞浓度:低水平时,它充当信号分子,而在高水平时,它触发硝基氧化应激。张菊平等[42]发现,外源NO显著提高盐胁迫辣椒(Capsicum annuumL.)幼苗叶片中的叶绿素、脯氨酸、可溶性蛋白质以及可溶性糖含量,有效缓解盐胁迫危害。在盐胁迫条件下,NO和SA之间的相互作用涉及不同的信号分子和调节因子,参与调节植物的生长[43]。SA主要通过诱导植物产生更多的脯氨酸、甜菜碱、可溶性糖等渗透调节物质,以及提高植物光合能力,来调节抗氧化系统成分等生理过程,从而改善植物的盐毒性症状[44-47]。ABA可诱导植物体内脯氨酸的大量积累,从而维持细胞膜结构的稳定性,提高保护酶活性。适度配比的SA和ABA复合使用,有利于最大程度地保护膜系统稳定性,更有助于玉米幼苗在高盐胁迫的适应性[48]。外源H2O2可以调节毛白杨(Populus tomentosa)可溶性蛋白、脯氨酸含量以及抗氧化酶活性等生理响应,从而显著缓解盐碱胁迫[49]。H2S可以促进非生物胁迫下的H2S-Cys循环平衡,并增强其在调节抗氧化系统、替代呼吸途径和重金属螯合剂合成中的作用。H2S还可以通过影响气体信号分子、活性氧和一氧化氮的产生或竞争下游信号的调节来直接响应胁迫[50]。Huang等[51]发现,H2S通过调节Na+、K+平衡来提高植物对盐胁迫的耐受性。
3 植物响应盐碱胁迫的分子机制
植物对盐碱胁迫的响应中,各种基因的表达水平上调,其产物直接或间接参与植物保护。植物响应盐碱胁迫的一般途径为:(1)质膜上的受体接收感应胁迫信号—(2)信号转导—(3)转录调控—(4)耐盐碱相关基因的表达,继而通过一系列的生理反应适应盐碱胁迫环境(图2)。由于其复杂性,植物耐盐性的遗传调控机制尚未完全了解。事实上,植物对高盐胁迫的敏感性或耐受性是多个胁迫响应基因的协同作用,这些基因也与胁迫信号转导途径的其它成分相互作用。参与植物响应非生物胁迫的蛋白主要分为两类:一类是功能蛋白,能够直接发挥作用;另一类是调节蛋白,如转录因子(WRKY、MYB、NAC、bZIP等)和某些激酶,能够通过感受和传递胁迫信号来参与逆境胁迫。一些重要的编码渗透物合成、离子通道、信号因子和盐响应酶的蛋白质的基因已经被克隆和表征,揭示了相关基因/蛋白质在植物对盐碱的响应和适应中的基本功能[52,53]。
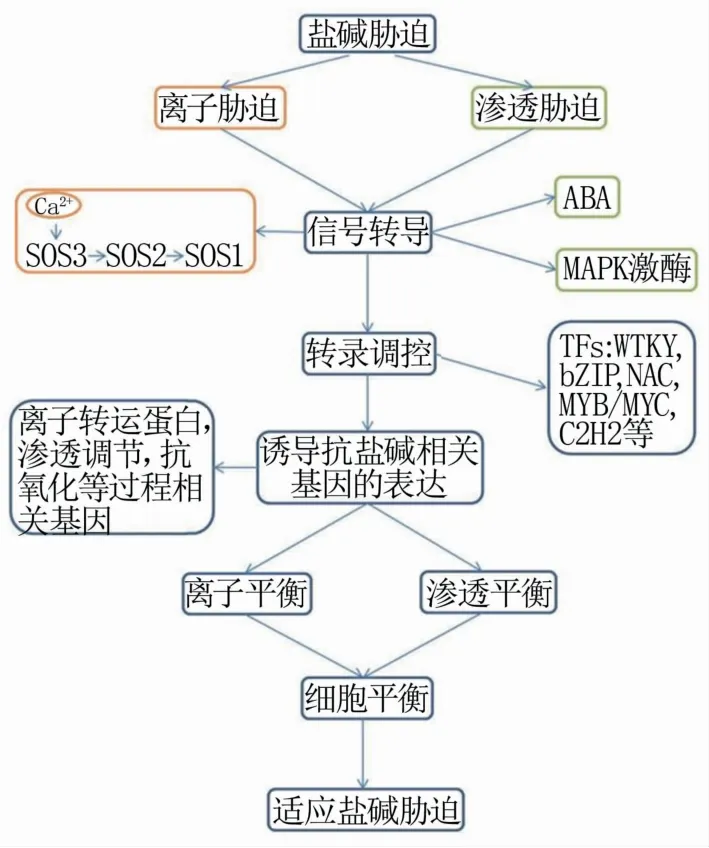
图2 盐碱胁迫信号转导分子机制
3.1 盐碱胁迫信号转导
植物盐碱胁迫信号转导途径主要包括ABA途径、蛋白激酶途径、SOS途径。植物中建立的第一个非生物胁迫信号途径是SOS途径,主要涉及离子胁迫信号转导途径[54]。SOS途径的主要过程为:SOS3(EF钙结合蛋白)感应盐胁迫介导的Ca2+信号,与SOS2(丝氨酸/苏氨酸蛋白激酶)相互作用并激活SOS2,激活的SOS2磷酸化后激活SOS1。SOS1是一种定位在根表皮细胞和木质部薄壁细胞的质膜Na+/H+逆向转运蛋白,被激活的SOS1可以将根系中过量的Na+排出,以及装载Na+进入木质部并通过长距离运输至叶片[55]。在植物中,Ca2+-SOS3-SOS2信号途径被广泛使用。
ABA是保护细胞和根组织中负责盐和渗透胁迫信号的主要植物激素,调节生长、发育和代谢。ABA信号转导途径是植物响应盐胁迫的核心,PYL蛋白家族是ABA的受体,Ca2+通道OSCA1可能参与渗透信号的传感,产生的Ca2+信号可能激活CPKs和CBLs-CIPKs,从而激活SnRK2s,进而产生ABA的积累。此外ABA还可以诱导NO和PA等信号分子,以及激活MAPK途径。
蛋白激酶在渗透胁迫的信号转导中发挥重要作用。植物具有由庞大家族成员组成的MAP激酶途径,其中丝裂原活化蛋白激酶(mitogen-acticated protein kinase,MAPK)级联途径在多逆境胁迫和多信号转导中发挥作用。Wang等[56]在水稻中发现了盐诱导的MAPKK转录本,osmkk1突变体与野生型相比显著对盐敏感,并靶向OsMPK4,表明OsMKK1和OsMPK4共同构成调控水稻响应盐胁迫的一个信号通路。
3.2 耐盐碱相关基因的表达
盐碱胁迫条件下,植物中基因的表达水平通常会出现一些复杂变化,其中一些正常基因的表达会受到抑制,但同时一些抗逆相关基因的表达会受到诱导。植物的耐盐碱性是由多个抗逆基因共同表达调控的,这些基因编码合成不同功能的蛋白质,参与不同的生理代谢过程,从而提高植物的耐盐碱性,缓解盐碱胁迫对植物的危害。这些基因根据不同的功能主要分为四类:(1)离子转运蛋白基因;(2)渗透调节相关基因;(3)抗氧化相关基因;(4)信号传导相关基因。SOS1是最先在拟南芥中发现的一种质膜Na+/H+逆向转运蛋白,利用H+梯度驱动Na+外排从而降低细胞质Na+浓度[55]。对水稻SOS1的研究进一步支持了SOS1在将Na+从木质部薄壁细胞输出到木质部导管中,促进Na+在茎中积累,从而进行渗透调节方面的作用[57]。HKT1离子转运蛋白广泛存在于单子叶和双子叶植物中,其在根细胞中起重要作用,组织特异性表达,有助于植物耐盐性[32]。HKT1参与植物体内Na+的长距离运输,调节Na+浓度,以维持植物细胞离子平衡[58]。在盐胁迫下,植物液泡膜Na+/H+逆向转运蛋白NHX可以调控体内离子平衡从而提高植物耐盐性。研究表明,在多种植物如拟南芥(Arabidopsis thaliana)[59]、水稻[60]、烟草[61]、大豆(Glycine max)[62]以及虎耳草(Saxifraga stoloniferaCurt.)[63]中过量表达AtNHX5,都在一定程度上提高转基因植株的耐盐能力。AtRbohD/AtRbohF在盐胁迫耐受性中的积极作用的潜在机制已被多项研究揭示。盐诱导的AtRbohD/AtRbohF产生的ROS促进K+进入胞质溶胶的运动,从而降低Na+/K+的比率[64]。将Cu/Zn-SOD基因转入水稻中,提高转基因水稻中活性氧的解毒能力,缓解盐胁迫伴随的氧化损伤,从而提高水稻对盐胁迫的耐受性[65]。近20年来,植物耐盐性研究的一个重要进展是盐过度敏感基因的鉴定。通过拟南芥突变体筛选,分离出几个盐过敏突变体,命名为sos突变体,并鉴定了这些SOS基因的分子特征。在这些SOS基因中,SOS1、SOS2和SOS3编码构成SOS信号通路的蛋白质[66]。Ca2+作为重要的第二信使,在植物信号转导中扮演着重要角色。周非凡等[67]发现钙依赖蛋白激酶基因OsCPK12参与激素的信号转导并对水稻抗逆有正调控作用。
此外,水通道蛋白CrPIP2.3主要通过介导水稳态,影响植物在高盐/高碱胁迫下的生理过程,从而提高转基因拟南芥耐受性[68]。过表达GmPKS4的转基因拟南芥和大豆毛状根通过提高的脯氨酸含量以及抗氧化酶活性,一定程度上提高了拟南芥的耐盐碱性[69]。过量表达AtPHB2的转基因拟南芥,耐盐碱和抗氧化胁迫能力增强。AtPHB2通过提高K+/Na+比以及参与ROS降低机制,影响植物对盐胁迫的耐受性[70]。
3.3 转录因子调控响应
转录因子(transcription factor,TF)是一种特定蛋白质,可以接受上游信号,调控下游目的基因的表达。盐碱胁迫条件下,植物体内信号接收器接收胁迫信号后发生一系列信号转导过程,最终调控抗性相关基因的表达,在此过程中,转录因子起着至关重要的开关作用。目前与盐碱胁迫相关的转录因子有:WRKY、MYB、NAC、bZIP、C2H2等。植物锌指蛋白家族WRKY可直接调控参与盐碱胁迫应答,缓解高盐引起的伤害[71]。小麦(Triticum aestivum)TaWRKY46可以提高烟草耐盐性[72]。将玉米转录因子基因ZmWRKY101在拟南芥中过量表达,转基因植株的抗氧化酶活性显著增强,抗胁迫相关的基因表达水平也显著提高,说明其通过调控抗氧化系统的信号转导提高植株的耐盐性[73]。研究表明,将来自拟南芥[74]、草莓[75]、水稻[76]、大豆[77]等植物中的MYB基因转入拟南芥,都提高了转基因拟南芥植株的耐盐性。此外,将拟南芥AtMYB44基因转入栽培大豆,与在拟南芥中观察到的相似,转基因大豆表现出增强盐/碱胁迫的耐受性[78]。Li等[79]研究在盐胁迫下,通过过量表达以及CRISPR-Cas/9系统结合发现,GmNAC06可能通过调控植物体内脯氨酸和甘氨酸含量,以及Na+/K+比例提高植株耐盐性。Yang等[80]发现,大豆bZIP家族基因GmbZIP2在拟南芥和大豆毛根中的过表达可以提高植物对干旱和盐胁迫的抗性。张福臻等[81]发现,拟南芥中过表达类受体蛋白激酶基因OsRPK2,导致转基因植株对逆境信号的传导能力下降,降低拟南芥的抗逆性。
4 展望
由于全球气候变化,环境压力愈发频繁,非生物胁迫严重制约了植物生长、发育和作物产量。作为固着生物,植物已经进化出复杂的系统来承受非生物胁迫。关于植物适应盐碱胁迫的研究是当下国内外学者们的研究热门,目前的蛋白质组学为研究植物中复杂的分子网络提供了一种高通量的方法。近年来,通过基因组学、代谢组学和蛋白组学多组学挖掘植物抗盐碱相关基因已取得很大进展[82-84],但为了了解盐碱胁迫信号转导途径的复杂性,揭示由盐碱胁迫诱导的基因的功能机制、每个产物及其相互作用,还需要科研人员进一步深入研究,以便为提高植物抗盐碱性提供理论依据,以及为育种改良提供新的途径,从而培育出更能适应非生物胁迫的作物品种,提高作物产量和质量。

