辣椒油树脂的纯化工艺及成分分析
戴雄泽,张可欣,弓志青,王文亮
(1.湖南农业大学园艺学院,湖南 长沙 410128;2.山东省农业科学院农产品加工与营养研究所,山东 济南 250100;3.山东农业大学食品科学与工程学院,山东 泰安 271018)
辣椒油树脂(Capsicum oleoresin)是一种从辣椒中提取、浓缩制得的具有强烈辛辣味的油状液体,主要用于生产食品添加剂、调味料等。其主要成分是辣椒素,该物质具有抗氧化、抑菌和抗肿瘤等重要作用[1];此外,还含有少量的蛋白质、果胶、脂肪酸、多糖等活性成分[2]。Kim等[3]研究发现辣椒提取物中含有丰富的辣椒红素和β-胡萝卜素,有助于降低氧化应激引起的疾病风险。中国辣椒资源丰富,其深加工产品辣椒油树脂具有良好的市场发展潜力[4]。但目前我国市场上的辣椒油树脂由于存在过多杂质而颜色较深[5]、质地粘稠、流动性和分散性差且带有异味,用食用油稀释后出现较多沉淀,限制了其应用。因此,辣椒油树脂精制、纯化研究对扩大其应用和满足市场需求具有重要意义。
针对上述问题,本试验选取辣度较高的辣椒品种为原料,用95%食用乙醇超声提取辣椒油树脂粗品,然后以得率和辣椒素含量为指标,利用单因素和正交试验考察95%食用乙醇用量、萃取次数、萃取温度对辣椒油树脂纯化的影响,确定最佳纯化工艺。油脂的脂肪酸成分及理化性质与其功能、加工和贮藏联系密切,是评定油脂质量的重要指标[6]。因此,本试验利用GC-MS技术比较分析了纯化前后辣椒油树脂的脂肪酸种类、含量及相关理化指标,进一步验证最佳纯化工艺的纯化效果,以期为辣椒及辣椒油树脂的利用提供技术参考依据。
1 材料与方法
1.1 材料与仪器
辣椒品种H21,湖南省疏菜研究所提供;食用油(市售大豆色拉油);95%食用乙醇、丙酮、乙醚(优级纯)、石油醚(优级纯),国药集团化学试剂有限公司;脂肪酸标准品(色谱纯),Sigma公司;无水乙醇(色谱纯)、甲醇(色谱纯)、正己烷(色谱纯),上海阿拉丁生化科技股份有限公司。
恒温水浴加热装置,江苏金怡仪器科技有限公司;Thermo Trace 1310 ISQ气相色谱-质谱联用仪,赛默飞世尔科技(中国)有限公司。
1.2 试验方法
1.2.1 辣椒油树脂粗品制备 参考范三红等[7]的方法。干辣椒经过清洗、挑选、去蒂后置于烘干箱中70℃烘干至恒重,粉碎后过40目筛,放入密封袋备用。取一定质量的辣椒粉末,按1∶10料液比加入相应体积的95%食用乙醇,45℃超声提取35 min,经4000 r/min离心10 min后收集上清液,90℃旋蒸至溶剂挥发完全,得辣椒油树脂粗品。
1.2.2 辣椒油树脂纯化及工艺优化 参照何志芳等[8]的方法并进行改进。称取一定质量的辣椒油树脂粗品,以1∶10料液比加入食用油,在一定温度下搅拌并静置使其分层,弃去下层杂质,在油层中加入95%食用乙醇萃取,一定温度下搅拌并静置使其分层,利用旋转蒸发器浓缩处理上层有机溶剂相,得到纯化后的辣椒油树脂,计算其得率及辣椒素含量。
单因素试验:称取2.0 g辣椒油树脂粗品,以辣椒素含量和纯化辣椒油树脂得率为指标,固定部分试验条件,考察不同95%食用乙醇用量(料液比1∶2、1∶3、1∶4、1∶5、1∶6)、萃取次数(1、2、3、4、5)、萃取温度(35、40、45、50、55℃)对两种指标的影响。考虑到辣椒素为辣椒油树脂的重要成分,以辣椒素含量为主要指标,以得率为次要指标。
正交试验:在单因素试验基础上,通过正交试验设计(表1)确定最优萃取温度、95%食用乙醇用量和萃取次数。

表1 正交试验设计因素及水平
1.3 测定指标及方法
1.3.1 辣椒素含量 辣椒粉末中辣椒素含量:参考厉志伟[9]、韩晓岚[10]等的方法。将辣椒在50℃下烘干至恒重,粉碎过筛,称取2.5 g样品(精确到0.0001 g)于50 mL离心管中,加入甲醇25 mL,超声提取30 min,4000 r/min离心5 min,将上清液转移至50 mL容量瓶中。滤渣中加入甲醇20 mL,超声提取20 min,4000 r/min离心5 min。合并上清液,用甲醇定容至50 mL,经0.22 μm有机滤膜过滤后进行色谱分析。
辣椒油树脂中辣椒素含量:精确称取1.0 g辣椒油树脂样品(精确到0.0001 g)于25 mL容量瓶中,用甲醇定容至刻度线,充分摇匀,经0.22 μm有机滤膜过滤后进行色谱分析。
色谱条件:色谱柱为ZORBAX SB-C18(5 μm,4.6 mm×250 mm),流动相为甲醇+水(V∶V=65∶35),流速为1 mL/min,柱温为30℃,检测波长为280 nm,进样量为10μL。以峰面积外标法定量。
1.3.2 纯化辣椒油树脂得率 分别称取辣椒油树脂纯化前后的质量,根据以下公式计算得率:

1.3.3 脂肪酸种类及含量 参考《GB 5009.168—2016食品安全国家标准 食品中脂肪酸的测定》并稍作修改。称取适量样品,加入约100 mg焦性没食子酸和几粒沸石,再加入2 mL 95%乙醇和10 mL盐酸溶液,70~80℃水浴中水解40 min,水解后的试样加入95%乙醇10 mL后转移到分液漏斗中,加入乙醚-石油醚混合液50 mL,将醚层提取液收集到烧瓶中,烘干后得到脂肪提取物。
在脂肪提取物中加入2%氢氧化钠-甲醇溶液2 mL,85℃水浴30 min,加14%三氟化硼-甲醇溶液3 mL后再85℃水浴30 min。降至室温,在离心管中加入正己烷1 mL,振荡萃取2 min,静置1 h,分层。取上层清液100μL,正己烷定容到1 mL。用0.45μm滤膜过滤后上机测试。
气相色谱条件:色谱柱为HP-88 Agilent(100 m×0.25 mm×0.20μm),进样口温度290℃,载气为He,流速1.0 mL/min,不分流。
质谱条件:离子源温度280℃,传输线温度280℃,溶剂延迟5 min,扫描范围为30~400 amu;离子源为EI源,70 eV。
升温程序:初始温度100℃保持13 min,以10℃/min升温至180℃保持6 min,以1.5℃/min升温至192℃保持6 min,再以3.5℃/min升温至240℃保持4 min。
1.3.4 色价 采用《GB 1886.34—2015食品添加剂辣椒红》的方法。准确称取一定量的试样(视试样色价高低进行适当调整,精确至0.0002 g),用丙酮稀释至100 mL容量瓶中,再精确吸取10 mL稀释至100 mL,用分光光度计在460 nm波长处、用丙酮作参比液、于1 cm比色皿中测定其吸光度。根据以下公式计算其色价。
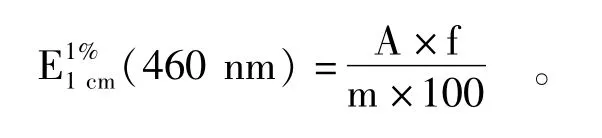
式中:A为实测试样溶液的吸光度;f为稀释倍数;m为试样质量(g);100为换算系数。试样结果以平行测定结果的算术平均值表示。
1.3.5 相关理化指标 对纯化前后的辣椒油树脂分别进行相关理化指标测定。总酚含量按照福林酚法测定;碘值按照《GB/T 5532—2008动植物油脂碘值的测定》进行;酸值按照《GB5009.229—2016食品中酸价的测定》进行;皂化值按照国标《GB/T 5534—2008动植物油脂皂化值的测定》进行;过氧化值按照国标《GB5009.227—2016食品中过氧化值的测定》进行。
1.4 数据处理与分析
采用Microsoft Excel 2016软件进行数据分析和绘图。
2 结果与分析
2.1 单因素试验结果分析
2.1.1 95%食用乙醇用量的确定 如图1所示,随着95%食用乙醇用量增加,纯化辣椒油树脂得率呈先上升后下降趋势,在95%食用乙醇用量(料液比)为1∶4时得率最高,为83.84%,这可能是因为溶剂增大了传质效率而提高得率[11],但过多溶剂会溶出更多杂质而降低得率。辣椒素含量随95%食用乙醇用量的增加也呈先升高后降低趋势,在料液比为1∶3时含量最高,为36.36 g/kg。考虑到料液比为1∶3和1∶4时得率相差不大,且辣椒素含量为辣椒油树脂的重要指标,故选择最佳95%食用乙醇用量(料液比)为1∶3。
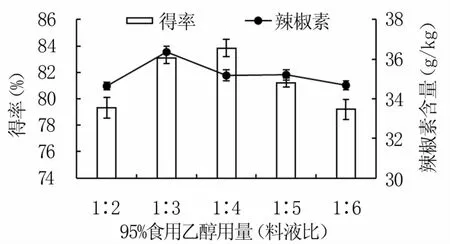
图1 95%食用乙醇用量对纯化辣椒油树脂得率 和辣椒素含量的影响
2.1.2 萃取次数的确定 如图2所示,随着萃取次数增加,纯化辣椒油树脂得率及辣椒素含量均呈先上升后下降趋势,均在萃取4次时最高,分别为83.67%、37.15 g/kg。故选择最佳萃取次数为4次。
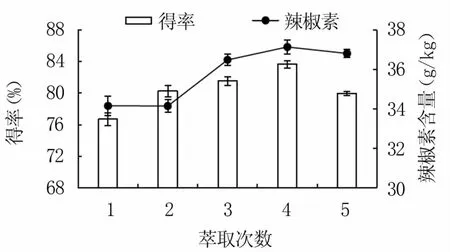
图2 萃取次数对纯化辣椒油树脂得率 和辣椒素含量的影响
2.1.3 萃取温度的确定 如图3所示,随着萃取温度升高,纯化辣椒油树脂得率呈先上升后降低趋势,在45℃时最大,为84.68%,这可能是因为萃取温度升高有利于增强油脂在流体中的溶解度,提高得率[12]。辣椒素含量也随萃取温度升高先升后降,45℃时最高,为37.77 g/kg,这可能是因为温度升高加快分子运动,而升温到一定程度时分子运动达到平衡[13]。故选择最佳萃取温度为45℃。
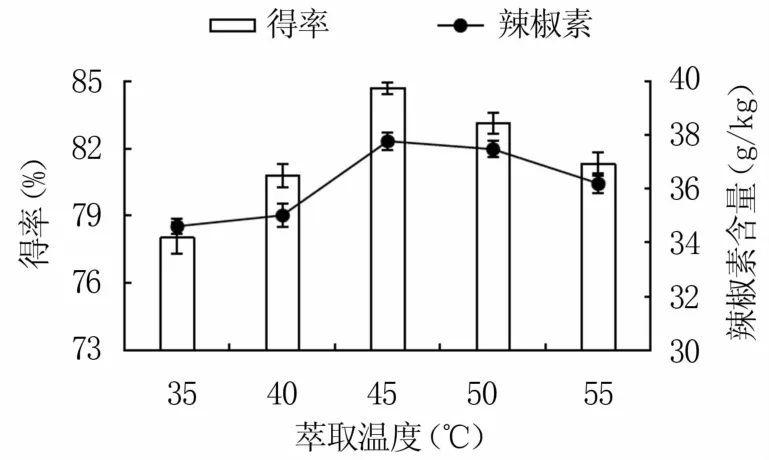
图3 萃取温度对纯化辣椒油树脂得率 和辣椒素含量的影响
2.2 正交试验结果分析
由表2可知,各因素对纯化辣椒油树脂得率的影响为萃取温度>95%食用乙醇用量>萃取次数,对辣椒素含量的影响为95%食用乙醇用量>萃取温度>萃取次数。由方差分析(表3、表4)可知,萃取温度对得率具有极显著性影响(P<0.01),95%食用乙醇用量对得率和辣椒素含量都具有显著影响(P<0.05)。由正交试验K值可知,得率和辣椒素含量的最优组合都为A3B2C2,即选择萃取温度50℃,95%食用乙醇用量(料液比)1∶3,萃取4次,在此条件下验证试验,最终结果为:得率为85.89%,辣椒素含量为38.61 g/kg。但主要指标辣椒素含量低于A3B2C1组合,因此最终选择A3B2C1为最佳组合,即选择萃取温度50℃,95%食用乙醇用量1∶3,萃取3次。在此条件下,得率为85.75%,辣椒素含量为39.9147 g/kg。
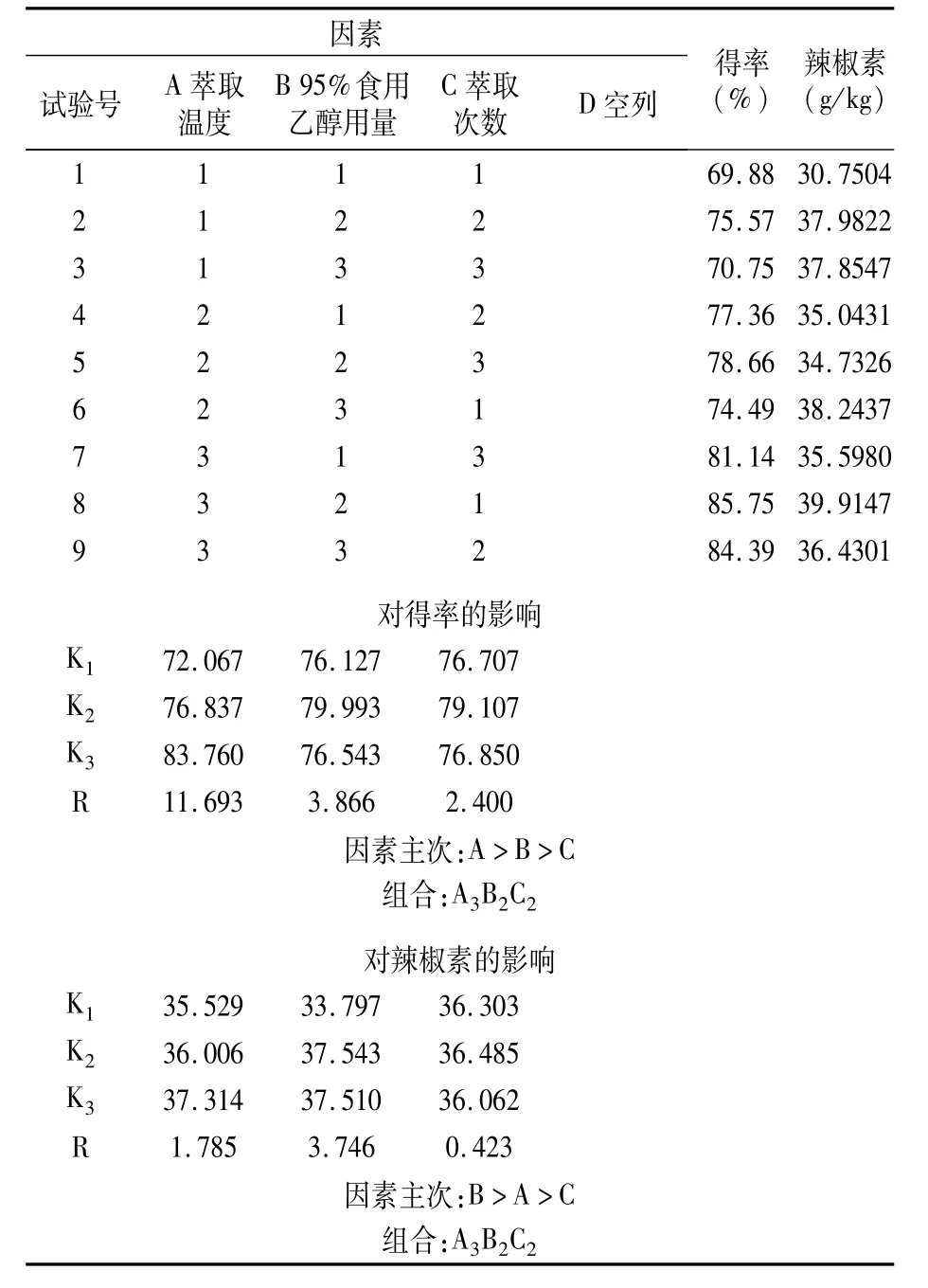
表2 正交试验结果

表3 得率方差分析
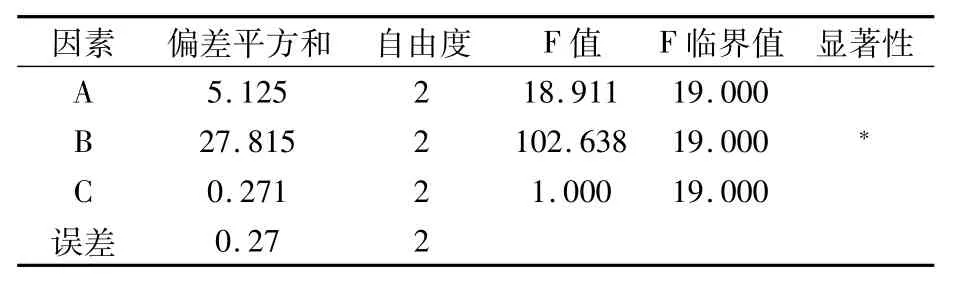
表4 辣椒素方差分析
2.3 辣椒素含量对比
本试验选取的自培育辣椒品种H21辣椒素含量为16.81 g/kg,辣度高达259264.82 SHU(表5),远超常用加工辣椒品种,如小米椒(50000 SHU)、朝天椒(40000 SHU)、角椒(12000 SHU)、黄皮尖椒(12000 SHU)、线椒(10000 SHU)[14]、四川二荆条(6000 SHU)[15]等;辣椒油树脂粗品辣度达到454294.79 SHU,经纯化后辣椒素含量和辣度均有所提高。

表5 辣椒原料及辣椒油树脂中辣椒素含量对比
2.4 脂肪酸含量对比
2.4.1 脂肪酸标准品的GC-MS分析 图4显示,混合标准品中各种脂肪酸甲酯分离良好,各组分之间相互不干扰,达到定量分析的要求[16]。
图4 脂肪酸甲酯混合标准总离子流GC-MS图谱
2.4.2 样品中脂肪酸GC-MS测定结果 如表6所示,纯化前的辣椒油树脂所含9种主要脂肪酸中亚油酸(C18∶2n6c)的含量最多,为56.973 g/kg,其次为棕榈酸(C16∶0),为12.189 g/kg。纯化后的辣椒油树脂所含9种主要脂肪酸中亚油酸(C18∶2n6c)的含量最多,为221.948 g/kg;其次为油酸(C18∶1n9c),为69.752 g/kg。说明纯化后的辣椒油树脂不饱和脂肪酸含量增多,包括单不饱和脂肪酸(MUFA)和多不饱和脂肪酸(PUFA)[17,18],因此营养价值更高。
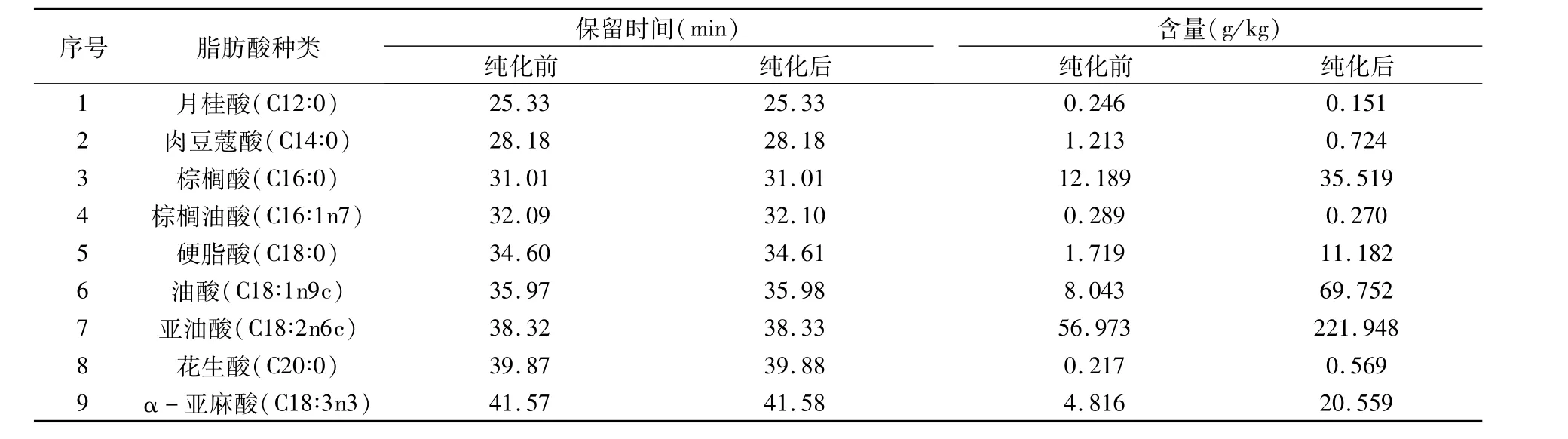
表6 纯化前后的辣椒油树脂中脂肪酸含量测定结果
2.5 理化指标对比
由表7可知,纯化后的辣椒油树脂色价减小,总酚、过氧化值、皂化值、酸价和碘价升高,但均在《GB2716—2018食品安全国家标准植物油》范围内。辣椒油树脂经过纯化去杂后颜色变浅、澄清透亮,色价变小,这与邢学辉[19]的研究结果一致。酸价能间接表明油脂中游离脂肪酸含量高低,是评价油脂品质优劣的重要指标[20],也是后续油脂精炼脱酸中确定加碱量的主要依据。过氧化值是评价植物油脂氧化酸败的重要指标[21],是油脂氧化初期常采用的评价手段,通常过氧化值越高,油脂氧化酸败越严重,油脂品质越差。本试验结果表明,纯化前后辣椒油树脂的酸价和过氧化值分别为1.37±0.08、1.81±0.04 mg/g和0.17、0.96 g/kg,均符合《GB2716—2018食品安全国家标准植物油》的质量要求。
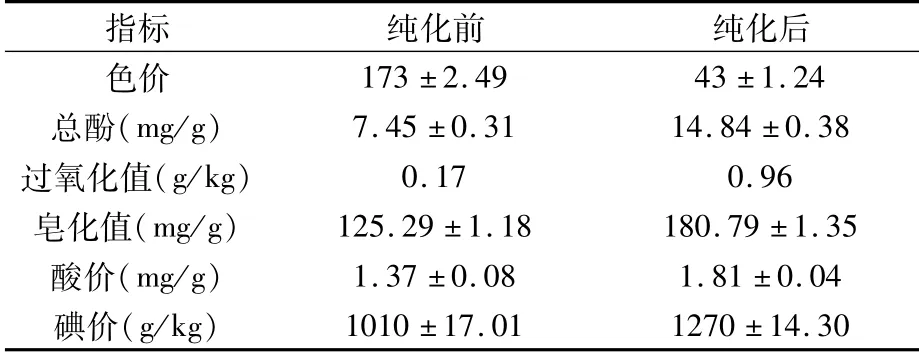
表7 纯化前后的辣椒油树脂理化性质对比
3 讨论与结论
本研究选取辣度较高的辣椒品种提取辣椒油树脂,利用食用油和95%食用乙醇萃取的方法进行纯化,通过单因素和正交试验确定最佳纯化工艺为:95%食用乙醇用量(料液比)1∶3、萃取温度50℃、萃取3次,纯化辣椒油树脂得率为85.75%,辣椒素含量为39.9147 g/kg。纯化后的辣椒油树脂产品色泽较浅、透亮,流动性好,色价降低,辣椒素含量和辣度提高,总酚含量增多,过氧化值、皂化值等都在食品安全国家标准范围内。
纯化后的辣椒油树脂中不饱和脂肪酸尤其是油酸、亚油酸含量增多。亚油酸为必需脂肪酸[22],可维持血脂的代谢平衡[23],用于预防和治疗动脉粥样硬化、高血压、心肌梗死等疾病[24],还具有降胆固醇[25]、提高人体免疫力等功能[26],可调节心脏功能,增强记忆力和思维能力[27],延缓衰老和免疫功能衰退等[28]。说明纯化后的辣椒油树脂具有更好的保健作用和食用价值。但纯化工艺对辣椒油树脂中多不饱和脂肪酸的提升机制需要进一步研究。
本试验可为开发辣椒及辣椒油树脂功能性食品、食品添加剂、食品调味料等提供理论基础,促进辣椒资源的可持续开发利用。

