一株细菌素产生菌的分离鉴定及其所产新型细菌素的结构特性研究
*刘哲 王金泽 黄一刚 任婷 金文刚 裴金金
(陕西理工大学 生物科学与工程学院 陕西 723000)
食品行业非常需要能够防止腐败或致病细菌污染的试剂。然而,由于大多数消费者担心常用食品防腐剂的安全性,人们对天然和安全的防腐剂替代品的需求很高[1]。细菌素是一种对人体具有低口服毒性的低分子量多肽[2],这些化合物作为生物防腐剂在食品工业中显示出良好的应用前景。根据Cotter,Hill,Ross[3],细菌素分为两大类:I类,以羊毛硫氨酸为基础的细菌素;II类,非羊毛硫氨酸细菌素。II类细菌素分为4个亚类:IIa类、IIb类、IIc类和IId类[7]。虽然已经发现了大量细菌素,但除了少数I类和IIa类细菌素的作用机制外,它们发挥抗菌作用的相应机制尚不清楚。
康普茶作为中国南方的一种功能性饮料已有数千年的传统,最近,它因其多种功能特性而受到欢迎。从康普茶中分离到的乳杆菌主要有球状乳杆菌、嗜热链球菌和植物乳杆菌,大多数研究都集中在康普茶的真菌区系上。在过去的几年里,研究人员将重点放在从康普茶中分离出的功能性乳酸菌。在这项研究中,从中国汉中市的传统康普茶中分离的植物乳杆菌#SLG10的无细胞上清液(CFS)中筛选并纯化了一种名为植物乳杆菌#SLG10的新型细菌素。随着证明该肽的分离,我们还阐明了其抗菌作用机制。
1.材料和方法
(1)产细菌素乳酸菌的筛选及鉴定
①乳酸菌的分离
康普茶购自陕西省汉中市。将1g康普茶发酵剂压碎并浸入10mL无菌蒸馏水中。琼脂培养基上进行培养(MRS,Solarbio,北京,中国),37℃下培养48h。根据Liu等人[4]的方法获得无细胞上清液(CFS)。使用琼脂孔扩散法定量CFS对金黄色葡萄球菌CICC10384和大肠杆菌CICC10302指示菌株的抗菌活性。如果在琼脂孔周围没有观察到抑制区,则将抑制记录为阴性。用抑菌活性(Log)和抑菌圈直径构建标准曲线。抗微生物活性表示为每毫升任意单位(AU),一个AU定义为显示明显生长抑制区的最高稀释度的倒数。
②细菌素产生菌菌株鉴定
用7F和1540R引物进行16SrRNA基因序列分析,鉴定菌株的基因型(5′-CAGAGTTTGATCCTGGCT,3′-AGGAGG TGATCCAGCCGCA)[6]。用Ezup柱状细菌基因组DNA纯化试剂盒提取植物乳杆菌#SLG10的DNA。PCR产物用SanPrep柱DNA凝胶提取试剂盒纯化。通过与NCBI数据库进行比较来执行序列的相似性搜索。
(2)细菌素的纯化
①生物色谱制备
根据Tang等人使用的方法的稍微修改版本进行生物色谱设置。用20%(v/v)盐酸活化二氧化硅8h,然后用去离子水洗涤至中性,在120℃下干燥。2g蛋黄磷脂酰胆碱(EYPC)和1g 1,2-二肉豆蔻酰基-sn-gly-蜡油磷脂酰甘油(钠盐)(DMPG)(2:1,w/w)溶于CHCl3/CH3OH(2:1,v/v),与20g 活性二氧化硅混合,并在恒温(4℃)条件下混合120min,通过旋转蒸发仪除去溶剂,用N2吹扫干燥的残余物并真空干燥过夜。脂质膜包被的多孔硅胶在磷酸盐缓冲盐水(PBS)中浸泡12h,在4℃下5000×g离心20min,然后用10mM、pH7.2的PBS缓冲液冲洗3次,作为250×4.6mm玻璃柱的填充物。
②细菌素的筛选纯化
色谱柱用PBS(10mm,pH7.2,50mM NaCl)洗脱,植物乳杆菌#SLG10的CFS在25℃下以PBS为流动相(0.5mL/min流速)洗脱,洗脱用分光光度法在215nm处监测重复20次。蛋白质含量用Bradford法测定。收集馏分并冷冻干燥,并筛选抗金黄色葡萄球菌CICC10384的抗菌活性,然后使用梯度洗脱对最有效的部分进行反相高效液相色谱(RP-HPLC)(Symmetry C18柱,250×4.6mm,5μm,Waters,Dublin,Ireland)。将B相(100%乙腈)与A相(0.05%(v/v)三氟乙酸(TFA))混合40min,使B相(100%乙腈)的含量从5%增加到100%,从而改变流动相的含量,A相的进样体积为1mL,流速为0.5mL/min,温度保持在恒定水平(25℃)。
(3)细菌素结构表征
分离的植物乳杆菌#SLG10的一级结构通过N-氨基酸分析仪确定,然后在NCBI数据库中进行同源性搜索。
(4)抗菌活性
细菌素对敏感细菌的最低抑菌浓度(MIC)根据临床和实验室标准研究所(CLSI)的程序[6]进行测定。
CICC:中国工业菌种收藏中心;
MIC:能抑制指示菌株生长的细菌素的最低浓度;
MBC:杀灭99.9%(下降三个数量级)的受试微生物所需的最低细菌素浓度。
2.结果与讨论
(1)细菌素产生菌的分离鉴定
从康普茶中分离出的7株菌株是潜在的LAB活性菌株。其中,菌株SLG10是唯一能够同时作用于革兰氏阳性菌和革兰氏阴性菌(金黄色葡萄球菌CICC10384和大肠杆菌CICC10302)的菌株。在排除了菌株SLG10抑菌效果与有机酸含量有关的可能性后,选择菌株SLG10作为细菌素产生菌。基于菌株 SLG10 16S rDNA序列的系统发育树推测菌株SLG10为植物乳杆菌。因此,我们将菌株SLG10命名为植物乳杆菌#SLG10。
过去几年,研究人员对康普茶的真菌成分非常关注。同时,康普茶也可以被认为是功能性乳酸菌的潜在丰富来源。如今,植物乳杆菌、益生菌菌株普遍被认为是安全的[8]。植物乳杆菌#SLG10作为一种植物乳杆菌,不仅可以用作产生细菌素的菌株,而且还具有作为发酵食品发酵剂的潜力。
(2)细菌素的纯化
生物色谱洗脱如图1A所示,仅获得一种洗脱液,抗菌活性试验表明该洗脱液为细菌素部分,结果表明生物色谱法对细菌素的鉴定具有良好的特异性。合并洗脱液并使用反相高效液相色谱法进一步分离,主峰如图1B所示,保留时间为21.3min。

图1 细菌素SLG10的纯化
在本研究中,生物色谱法能够从植物乳杆菌#SLG10的无细胞上清液(CFS)中快速筛选和分离细菌素。
(3)植物乳杆菌#SLG10的结构特性
质谱分析显示,一个与质量为1422Da的物种有关的特征峰。该化合物的一级结构为十肽,序列为ASN-IleVal-Trp-Gln-Leu-Ile-Gly-Leu-Pro-Ala-Gln-Ala(NIVWQLIGLPAQA)。BLAST分析表明,该序列与NCBI数据库中已知的细菌素序列不同,因此分离出的多肽是一种新的细菌素,命名为植物乳杆菌#SLG10。植物乳杆菌#SLG10属于Ⅱ类细菌素,因为它不含羊毛硫氨酸或YGNGVXC。
CD谱表明植物乳杆菌#SLG10呈现不规则的螺旋结构,预测的植物乳杆菌#SLG10的三个结构分区表明它呈现不规则的线性形成。植物乳杆菌#SLG10的理论质量是1422.26Da,这与MS测试的结果一致。
在结构上,植物乳杆菌#SLG10类似于其他具有无规卷曲但具有明确构象的小而疏水的细菌素,这些结构特征可能会增加细菌素在复杂环境中的稳定性。
(4)植物乳杆菌#SLG10的稳定性
在本研究中,植物乳杆菌#SLG10在加热处理后仍保持其抗菌活性,在37℃储存14天,甚至在4℃储存2个月后仍保持其抑制活性(图2B)。植物乳杆菌#SLG10在pH2.0-7.0范围内稳定,但在pH8.0及以上时活性下降(图2C)。这些结果表明植物乳杆菌#SLG10在食品加工过程中将保持显著的稳定性。有趣的是,植物乳杆菌#SLG10对胰蛋白酶和胃蛋白酶不敏感(图2A),缺乏敏感性可能归因于肽的小尺寸。
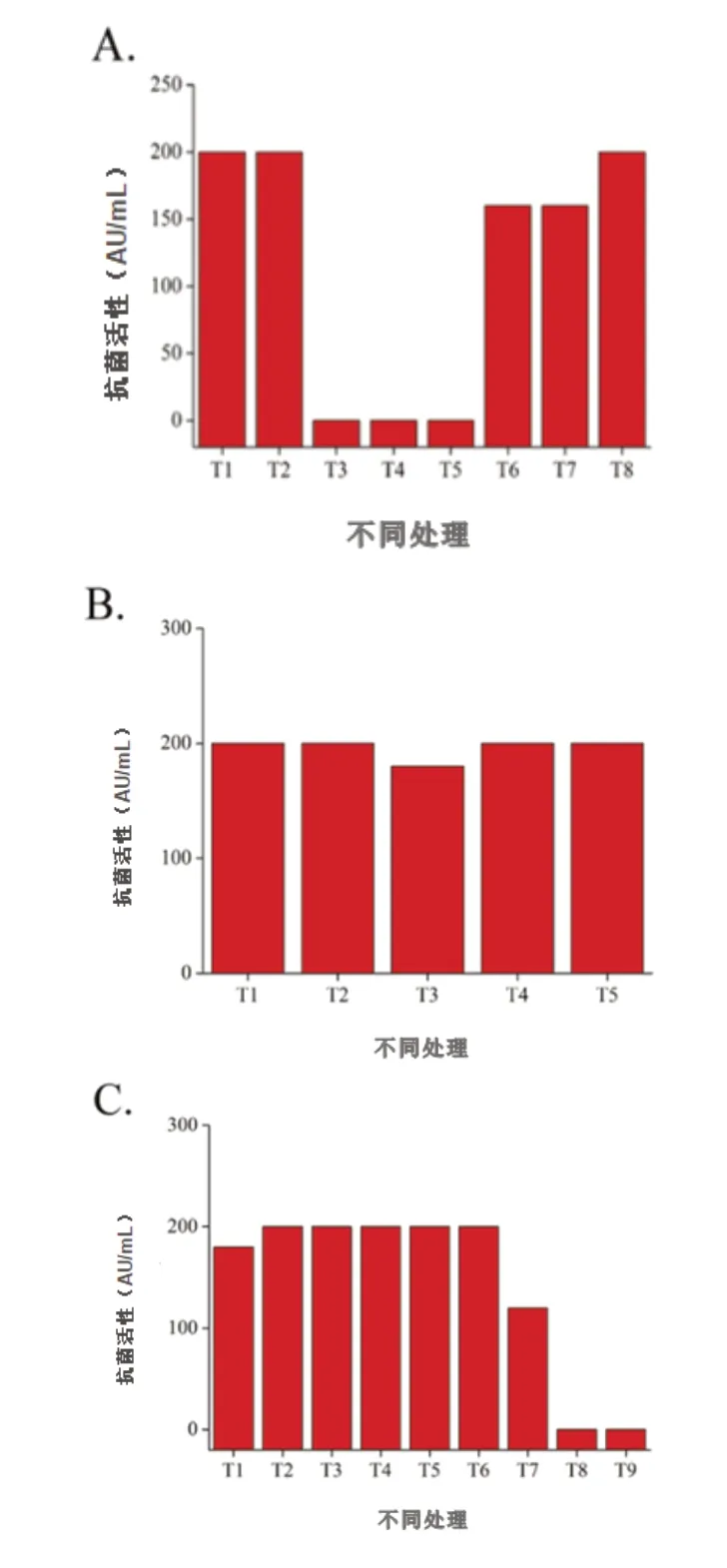
图2 酶、温度和pH对细菌素SLG10的影响
A:T1-脂肪酶;T2-a-淀粉酶;T3-蛋白酶K;T4-木瓜蛋白酶;T5-a-胰凝乳蛋白酶;T6-胰蛋白酶;T7-胃蛋白酶;T8-过氧化氢酶;B:T1-60℃;T2-80℃;T3-100℃;T4-37℃持续14天;T5-4℃持续两个月;C:T1-pH2;T2-pH3;T3-pH4;T4-pH5;T5-pH6;T6-pH7;T7-pH8;T8-pH9;T9-pH10。三个重复相同,因此没有标准偏差。
(5)抗菌活性
植物乳杆菌#SLG10的抗菌活性如表1所示,植物乳杆菌#SLG10对革兰氏阳性菌和革兰氏阴性菌均有抑制作用,重要的是,植物乳杆菌#SLG10对耐甲氧西林金黄色葡萄球菌也有活性。这种活性可能是因为细菌素的作用方式与抗生素不同。值得注意的是,植物乳杆菌#SLG10也对革兰氏阴性菌大肠杆菌有活性,根据敏感细菌的不同,植物乳杆菌#SLG10的MIC值为16~32μg/mL(表1)。
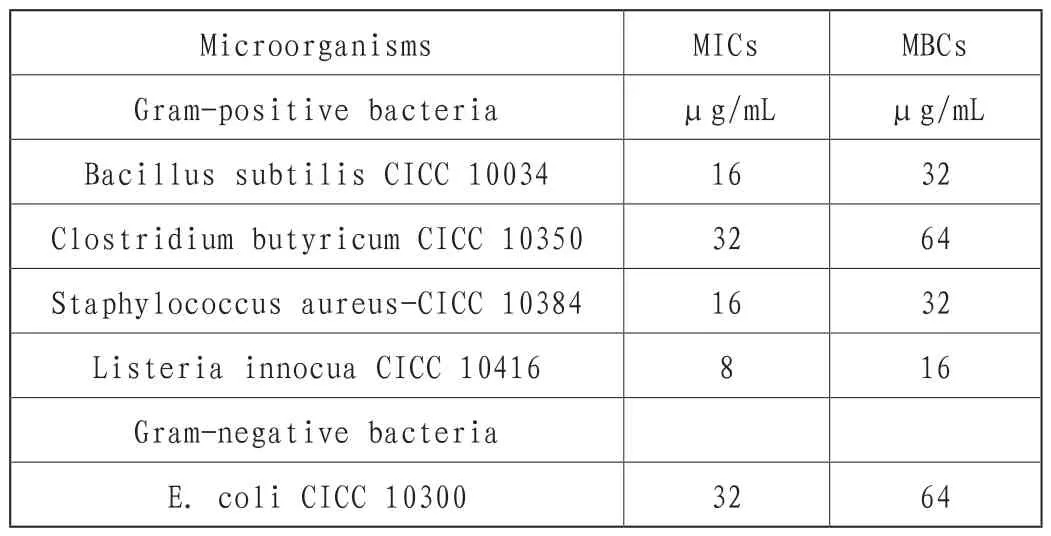
表1 细菌素SLG10的抗菌活性
3.结论
综上所述,SLG10菌株经鉴定为植物乳杆菌(Lactobacillus Plantarum),是从我国南方传统的康普茶中分离到的。采用生物层析和反相高效液相色谱(RP-HPLC)联用的方法,从SLG10菌株的CFS中分离纯化植物乳杆菌#SLG10。这种新的Ⅱ类细菌素对G+和G-细菌均有抗菌活性。本文发现的新型细菌素是一种很有前途的抗菌剂,在食品保鲜或制药工业中具有潜在的应用前景。

