不同海拔条件下烤烟成熟期根际土壤真菌群落结构及生态特征分析
高卫锴 李茂森 李超 黄纯杨 刘福童 冯炼 冯小芽 任天宝 李宙文





摘要:为探究不同海拔条件下植烟土壤真菌群落结构特征,以及驱动真菌群落的主要生态因子,选取3个不同海拔高度ZL(800 m)、ZS(1 000 m)、ZH(1 200 m)的烤烟成熟期根际土壤,采用18S rRNA高通量测序对土壤真菌进行分析。结果表明,中低海拔土壤pH值和速效养分含量显著高于高海拔;中低海拔土壤真菌α多样性显著低于高海拔土壤;3个海拔条件下土壤优势菌门为子囊菌门、担子菌门和毛霉菌门等,其中,1 200 m海拔担子菌门的丰度较800 m海拔提高了100.00%;1 000 m海拔捕虫霉门的相对丰度相较于1 200 m海拔提高了238.26%;聚类热图分析结果表明,担子菌门、Aphelidea与微生物量氮含量呈显著或极显著正相关,与速效钾含量和土壤温度呈显著负相关;芽枝霉门与pH值呈显著正相关,与微生物量碳氮比呈极显著正相关;捕虫霉门与碱解氮含量呈显著负相关;FUNGuild分析结果表明,1 000 m海拔土壤腐生營养型真菌相对丰度最高,达30.79%;1 200 m海拔病理营养型真菌丰度最高,达4.45%。烤烟成熟期根际土壤真菌多样性在不同海拔条件下表现出显著差异,土壤温度、速效钾含量和微生物量氮含量是引起土壤真菌群落结构及多样性变异的主要生态因子。
关键词:植烟土壤;海拔;真菌群落;环境因子;营养类群
中图分类号: S154;S572.061 文献标志码: A
文章编号:1002-1302(2022)08-0221-07
海拔是烤烟种植区域类型选择的重要影响因素之一[1-2],海拔高度的变化常常会导致环境发生显著变化,光、温、水、土等资源也会随之改变,影响土壤的发育和理化性质[3-4]。真菌是土壤微生物的重要组成部分,其多样性和群落结构与土壤养分转化[5]、土传病害[6]与植物健康[7]有着直接的关系。研究真菌在土壤中的结构组成,驱动了土壤微环境的改良,物种多样性的维持,以及对保持生态平衡具有重要意义[8-10]。贵州省遵义烟区是我国主要的烤烟种植区之一,海拔一般在800~1 300 m之间[11],土壤微生物与气候、植被类型及土壤性质等密切相关,而海拔变化往往在较短范围内引起温度、降水、植被类型和土壤性质等生物和非生物因子的显著变化[12-15]。近年来,随着测序技术的高速发展,不同海拔高度条件下土壤微生物变化规律已有大量的研究,且研究结果更加的多元化。李敏等对土壤真菌的研究发现,1 500 m与1 800 m的松根围土壤真菌群落结构存在显著差异,且土壤因子可以显著影响真菌群落结构[16]。Murugan等对阿尔卑斯山的研究发现,高海拔土壤中的真菌数量高于低海拔土壤[17]。人类活动也会影响微生物的海拔分布状况[18]。张倩研究发现,自然条件土壤与水稻土真菌群落组成存在显著差异[19]。袁雅威研究发现湖南省张家界烟区土壤真菌数量随着海拔的升高有降低的趋势,高海拔地区植烟土壤的生物活性明显降低[20]。
土壤微生物是生态系统过程中必不可少的参与者,控制着陆地生物圈中最大有机质库的周转[15]。基于高通量测序的微生物组学技术极大地推动了对土壤中未知微生物类群及功能的认识,尤其是根际微生物多样性、菌落结构和功能,对植物营养元素吸收机制研究发挥了重要的作用[6]。烤烟成熟期是影响烟叶质量的关键时期,其中根际微生物群落结构是重要的影响因素之一。因此,研究不同海拔条件下真菌群落时空特征对烟株的生长发育和物质代谢具有重要的意义。本研究通过高通量测序技术结合FUNGuild数据库分析贵州省遵义烟区不同海拔梯度上的土壤真菌群落结构和营养类群,通过研究真菌群落结构和营养类群受气候、环境因子的调控机制,进一步明确对土壤微生物群落结构海拔格局的认识,有助于更好地预测和解析作物成熟期土壤微生物群落的功能属性或多样性,也为不同海拔梯度下植烟土壤微生态调控提供理论参考。
1 材料与方法
1.1 试验区概况
2020年在贵州省遵义市播州区下辖鸭溪镇鸭溪基地单元进行取样,该地区年平均气温14.6 ℃,无霜期280 d,年降水量为1 043.4 mm,年平均相对湿度为82%。地形以低山丘陵、岗前缓坡为主,海拔在800~1 200 m之间,土壤以水稻土、山地黄壤为主。主栽烤烟品种为云烟87,在4月中旬进行移栽。3个海拔处理的烤烟大田生育期基本相同。取样地点共有3处,分别为鸭溪镇江北咀(海拔 819 m,106°42′51″E,27°27′17″N);乐山镇新华村(海拔1 022.32 m,106°36′47″E,27°36′49″N);乐山镇新土村(海拔1 220 m,106°38′13″E,27°41′3″N)。
1.2 测定项目与方法
1.2.1 供试土壤与样品采集
2020年9月1日,在遵义市鸭溪基地单元沿着海拔高度,按200 m高度差进行采样,共3个样地,分别为海拔800 m(ZL)、1 000 m(ZS)、1 200 m(ZH)。根据5点取样法确定取样点,将取得的样品混匀后,送往上海美吉生物公司,对采集的土壤样品进行真菌多样性检测,剩余土壤风干后研磨,进行土壤基础理化性质分析。
1.2.2 土壤理化性质检测
参照《土壤农业化学分析方法》[21]分析土壤理化性质,对样品做3次平行测定。采用三氯甲烷熏蒸-硫酸钾浸提法测定微生物量碳氮(MBC、MBN)含量[22]。
1.2.3 土壤真菌多样性检测
土壤DNA提取和PCR扩增:使用 E.Z.N.A.Soil DNA Kit试剂盒(OMEGA公司)对土壤进行总DNA提取,利用NanoDrop 2000超微量分光光度计(赛默飞世尔科技公司)检测DNA纯度,检测合格后用338F和806R引物对 V3~V4 可变区进行PCR扩增[9]。
IlluminaMiseq测序:使用琼脂回收盒回收PCR产物,混合后送往IlluminaMiSeq平台进行基因序列测定[9]。
1.3 数据分析及统计
采用Excel 2016分析数据,方差分析采用最小显著性差异法用DPS 16.0软件分析,热图分析根据物种丰度的相似性进行聚类,用R软件的vegan包绘图。
2 结果与分析
2.1 不同海拔条件下植烟土壤理化指标
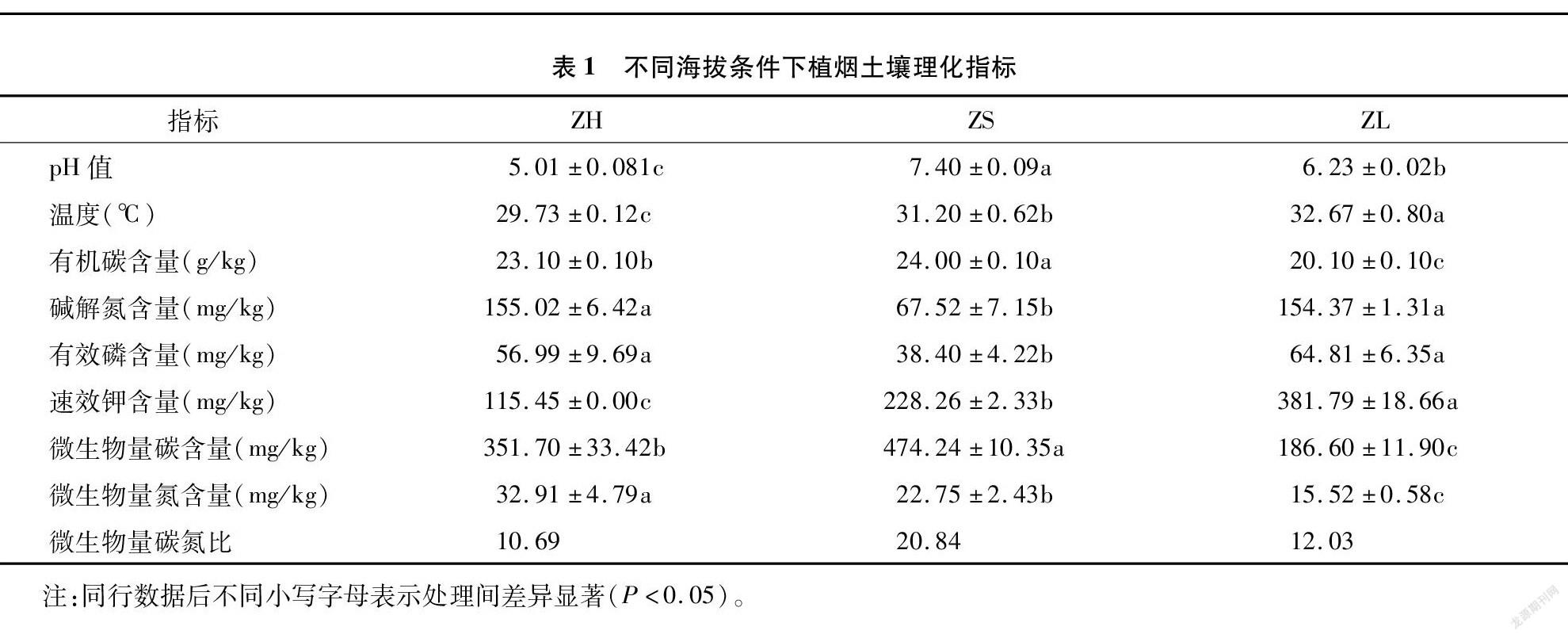
从表1可以看出,ZS处理土壤pH值和有机碳含量显著高于其他2个处理;低海拔土壤(ZS、ZL)温度显著高于高海拔(ZH);土壤碱解氮含量随着海拔的升高表现为先降低后升高的趋势,ZL、ZH处理之间无显著差异;ZS处理土壤有效磷含量显著低于ZL和ZH处理,分别降低32.62%和40.75%。土壤速效钾含量随着海拔的升高显著降低,微生物量氮含量随着海拔的升高而显著升高,土壤微生物量碳含量随着海拔的升高表现出先升高后降低的趋势,均达到显著差异,土壤微生物量碳氮比变化与其一致。
2.2 不同海拔条件下土壤真菌α多样性
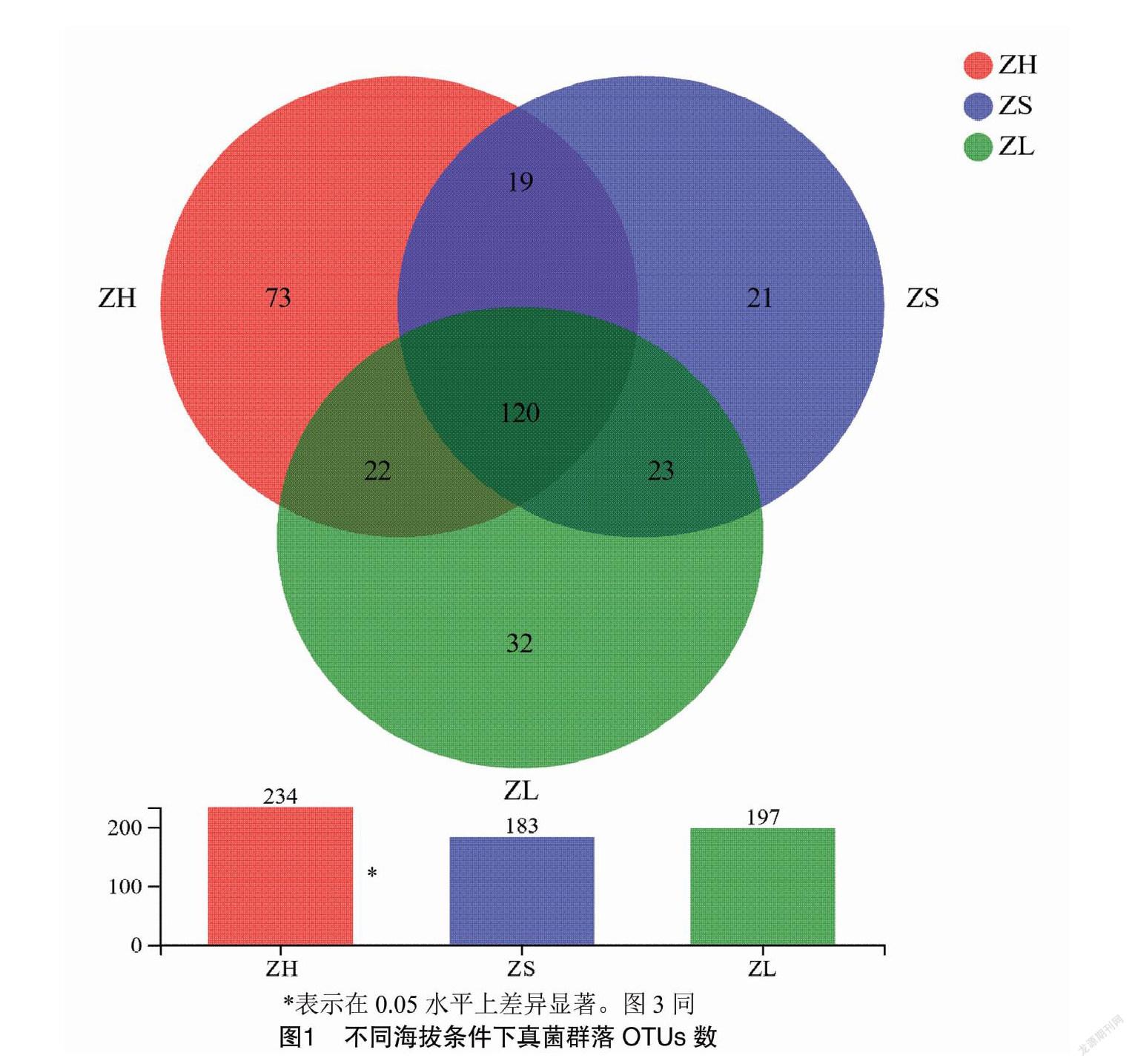
对9个土壤样本進行检测,共获得519 700条有效序列,所有样本平均OTU数为204个,3个海拔处理的共有OTU数为120个,高海拔处理OTU数量显著高于低海拔处理(图1)。
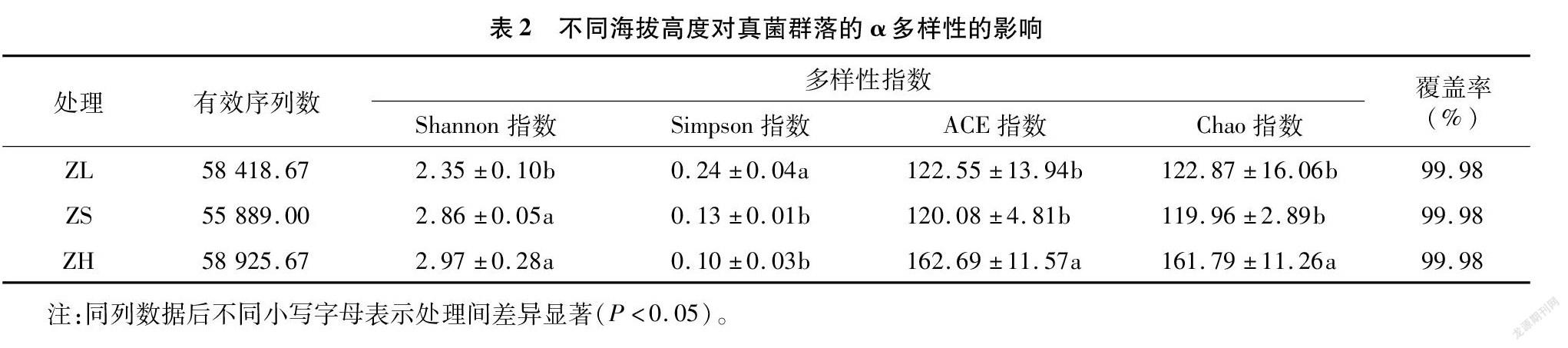
从表2可以看出,Simpson指数、Shannon指数、ACE指数和Chao指数均在ZL处理和ZH处理之间表现出显著性差异,其中ZH处理的Shannon、ACE和Chao指数显著大于ZS处理,而Simpson指数呈相反的表现。ZS处理Shannon指数显著高于ZL处理,而ACE和Chao指数无显著性差异。
2.3 土壤真菌群落结构分析
2.3.1 不同海拔条件下门水平真菌群落相对丰度 研究结果表明,共获得27 个门水平真菌菌群,将平均相对丰度<1%类群归为其他,得到 8 个类群(图2)。其中相对丰度较高的菌门分别为子囊菌门、担子菌门、毛霉菌门、一种未分类的超类群和捕虫霉门。
不同海拔高度门水平上土壤真菌丰度表现出差异(图3),子囊菌门在3个海拔高度下表现出显著差异性,其相对丰度以ZL处理最高,相较于ZS处理提高了7.41%;ZH处理担子菌门丰度较ZL处理提高了100.00%;ZS处理的捕虫霉门的相对丰度相较于ZH处理提高了238.26%。
2.3.2 不同海拔条件下土壤真菌β多样性
从图4-a可以看出,对样本距离矩阵进行聚类分析,构建样本层级聚类树后高海拔地区样本单独聚在一起,中低海拔样本具有一定的重叠,表明海拔条件在一定区域内改变了植烟土壤真菌群落结构。由图4-b可以看出,PC1 轴和 PC2 轴的贡献值分别为57.77%和24.18%。ZL处理样本点距 ZS处理样本点较近,说明ZL与ZS处理的土壤真菌群落结构具有一定的相似性,ZL处理与ZH处理的距离较远,说明海拔条件显著影响了真菌群落结构,且随着海拔的高度差变大,影响也随之变大。
2.4 土壤真菌群落与环境因子的相关性分析
从图5可以看出,在门水平上相对丰度前20名的真菌门类与环境因子之间的相关关系。微生物量氮含量、pH值、温度和速效钾含量对不同海拔条件下真菌群落结构表现出显著性影响。其中一种未分类的真核生物与温度和速效钾含量呈显著或极显著正相关,与微生物量氮含量呈极显著负相关;担子菌门则与温度和速效钾含量呈显著负相关关系,与微生物量氮含量呈极显著正相关;Aphelidea与速效钾含量呈显著负相关关系,与微生物量氮含量呈显著正相关;芽枝霉门与pH值和微生物量碳氮比分别呈显著或极显著正相关,捕虫霉门与碱解氮含量呈显著负相关。
2.5 不同海拔条件下土壤真菌营养类型
从图6可以看出,土壤中可鉴定真菌共存在6种营养类型。其中病理-腐生-共生过渡型丰度在全部样本中占比最高,达到19.45%~47.50%。ZS处理腐生营养型真菌相对丰度最高,达到30.79%,较ZL、ZH处理海拔分别升高了186.77%、8.04%;ZH处理海拔病理营养型真菌丰度最高,达4.45%,相较于ZL、ZS处理分别升高了18.76%、56.61%。
3 讨论与结论
真菌是土壤微生物的主要成员之一[23],具有广泛的生物多样性。真菌具有高度的可塑性,并且能够适应各种不利条件。不仅具备生产多种胞外酶的能力,也能够分解各种有机物质、土壤成分,从而调节土壤碳氮的平衡[24-26],同时,土壤真菌也是土壤主要病害来源,土壤中约70%的病害均来源于土壤真菌[27]。因此,改变土壤真菌多样性在改善土壤质量和提高农业生态系统生产力的潜在应用方面是非常有前途的发展方向。海拔驱动微生物群落发生变化的规律及成因一直以来都是重要的研究方向,土壤真菌多样性和群落结构随海拔的变化呈现多种模式。本研究中,3个不同海拔高度的土壤真菌Simpson指数、Shannon指数、ACE指数和Chao指数均表现出显著性差异,其中高海拔真菌Shannon指数、ACE指数和Chao指数均高于低海拔,Simpson指数低于低海拔。这与李敏等研究结果[16]一致,与盛玉钰等在神农架的研究结果[28]相反,这可能是由于人类活动引起的真菌多样性的变化。目前,众多研究表明,海拔高度驱动了真菌群落结构及多样性的变化,本试验中,聚类树图和PCA分析均表明,高海拔土壤真菌群落结构与中低海拔之间存在着较大的差异。研究发现,子囊菌门和担子菌门均为3个海拔高度下植烟土壤的优势菌群,这与熊涵的研究结果[29]一致。研究表明,子囊菌门多数为腐生菌,主要作用是分解植物凋落物和降解土壤中的有机质,本试验中子囊菌门之所以能占比最大,可能是因为其无性繁殖能力很强,能产生大量的分生孢子,增长迅速,使其在数量上占优势。本研究发现,中海拔地区土壤腐生营养型真菌相对丰度较高,而高海拔地区土壤病理营养型真菌相对丰度较高,这可能是土壤真菌参与了土壤的有机质、动植物分解过程,真菌能够分解纤维素、化合物以及参与土壤的氨化作用,对于植物来说是重要的氮素来源[29]。真菌群落组成与土壤有效养分具有亲密的关系,土壤 pH 值作为影响植物群落组成的主要因素,可以通过改变植物群落结构调控真菌群落结构。土壤pH值和养分含量的变化规律被认为是土壤真菌群落的主要调节者。王媛媛等研究吉林省的玉米土壤发现,土壤真菌群落多样性与pH值显著相关[30]。本研究发现担子菌门、Aphelidea与微生物量氮含量有显著或极显著正相关关系,与速效钾含量呈显著负相关关系;芽枝霉门与pH值表现出显著的正相关关系,捕虫霉门与碱解氮含量呈显著负相关关系。孙海等研究发现,担子菌门、子囊菌门等与土壤pH值、速效钾含量、总氮含量、微生物量氮含量等有显著关系[31]。董林林等对人参根际真菌群落的研究发现,pH值与座囊菌纲和Alatospora的丰度显著相关,速效钾含量与座囊菌纲、Alatospora、毛霉目的丰度显著相关,土壤总氮含量与粪壳菌纲、毛霉目的丰度显著相关[32]。
作为烤烟种植区域的重要影响因素之一,海拔高度对植烟土壤的理化性质及微生态环境有显著影响。本研究发现,海拔升高引起了土壤速效钾含量的降低,同时造成了土壤微生物量碳氮比的失衡,土壤病理营养型真菌相对丰度升高,这些因素可能给烤烟生长带来不利的影响。生物炭作为一种土壤改良剂,在土壤微生态调控、固碳培肥等方面具有良好的效应。冯慧琳等研究发现,施加生物炭可以显著提高土壤速效养分含量,提升土壤碳氮比,显著降低致病菌的相对丰度,减少烤烟病害[9,33]。Tianvao等研究表明,通过施用生物炭改善土壤理化特性从而构建土壤真菌群落结构[34-35]。目前,这些研究大多在同一海拔梯度上进行,而关于施加生物炭对不同海拔梯度下植烟土壤理化性质和微生态环境的影响有待于进一步研究。
不同海拔梯度下植烟土壤真菌群落结构表现出一定的差异,高海拔真菌多样性显著高于低海拔;相关性分析结果表明,土壤温度、速效钾和微生物量氮含量是驱动真菌群落结构在海拔梯度上变化的主要驱动因子;海拔高度的变化引起了环境因子的变异,进而构建了不同的土壤真菌群落结构,本试验为不同海拔梯度条件下土壤微生态调控提供了理论参考。
参考文献:
[1]李 强,张芸萍,解 燕,等. 曲靖植烟土壤pH分布特征及其影响因素研究[J]. 核农学报,2020,34(4):887-895.
[2]彭玉龙,郑梅迎,刘明宏,等. 遵义烟田土壤pH的空间分布与演变特征[J]. 中国烟草科学,2019,40(3):47-54.
[3]刀静梅,刘少春,张跃彬,等. 不同海拔蔗区土壤有机质、全氮含量和pH值特征[J]. 土壤与作物,2017,6(4):298-303.
[4]张 春,周冀衡,杨荣生,等. 云南曲靖不同海拔烟区土壤和烟叶硼含量的分布状况及相关性[J]. 中国烟草学报,2010,16(6):48-53.
[5]徐丽慧,曾 蓉,高士刚,等. 土壤真菌多样性对土传病害影响的研究进展[J]. 上海农业学报,2017,33(3):161-165.
[6]Rime D,Nazaret S,Gourbiere F,et al. Comparison of sandy soils suppressive or conducive to ectoparasitic nematode damage on sugarcane[J]. Ecology and Population Biology,2003,93(11):1437-1444.
[7]Perez P A,Edel H V,Alabouvette C,et al. Response of soil microbial communities to compost amendments [J]. Soil Biology& Biochemistry,2006,38(3):460-470.
[8]陈志芳. 戴云山不同森林类型土壤微生物群落多样性特征的研究[D]. 福州:福建农林大学,2014:40-43.
[9]馮慧琳,何欢辉,徐 茜,等. 生物炭与氮肥配施对植烟土壤微生物及碳氮含量特征的影响[J]. 中国土壤与肥料,2021(6):48-56.
[10]阎海涛,殷全玉,丁松爽,等. 生物炭对褐土理化特性及真菌群落结构的影响[J]. 环境科学,2018,39(5):2412-2419.
[11]汪卫平,熊 伟,陈余明. 贵州省日最高气温气候特征分析[J]. 贵州气象,2013,37(1):7-10.
[12]马进鹏,庞丹波,陈 林,等. 贺兰山不同海拔植被下土壤微生物群落结构特征研究[J]. 生态学报,2022,42(2):1-10.
[13]周煜杰,贾 夏,赵永华,等. 秦岭火地塘真菌群落海拔分布格局[J]. 应用生态学报,2021,32(7):2589-2596.
[14]王晓彤,靳振江,周军波,等. 龙脊稻作梯田土壤细菌群落结构和功能类群及影响因子分析[J]. 农业资源与环境学报,2021,38(3):365-376.
[15]〗周煜杰,贾 夏,赵永华,等. 基于文献计量的土壤微生物海拔分布规律研究[J]. 生态与农村环境学报,2021,37(10):1281-1291.
[16]李 敏,闫 伟. 海拔对乌拉山油松根围真菌群落结构的影响[J]. 菌物学报,2019,38(11):1992-2006.
[17]Murugan R,Djukic I,Keiblinger K,et al. Spatial distribution of microbial biomass and residues across soil aggregate fractions at different elevations in the Central Austrian Alps[J]. Geoderma,2019,339:1-8.
[18]Chang E H,Chen T H,Tian G L,et al. The effect of altitudinal gradient on soil microbial community activity and structure in moso bamboo plantations[J]. Applied Soil Ecology,2016,98:213-220.
[19]张 倩. 云和梯田不同海拔土壤微生物多样性及硝化作用差异研究[D]. 杭州:浙江大学,2019:62-73.
[20]袁雅威. 张家界烟区不同海拔高度植烟土壤肥力状况研究[D]. 长沙:湖南农业大学,2014:40-42.
[21]鲁如坤. 土壤农业化学分析方法[M]. 北京:中国农业科学出版社,1999:25-151.
[22]周 桦,宇万太,马 强,等. 氯仿薰蒸浸提法测定土壤微生物量碳的改进[J]. 土壤通报,2009,40(1):154-157.
[23]马 强,夏冬双,武志华,等. 内蒙古西部地区土壤真菌的多样性分析[J]. 科学技术与工程,2020,20(35):14447-14454.
[24]Frc M,Hannula S E,Beka M,et al. Fungal biodiversity and their role in soil health.[J]. Frontiers in Microbiology,2018(9):707.
[25]Lucia ,Tom V,Adina H,et al. Microbial activity in forest soil reflects the changes in ecosystem properties between summer and winter[J]. Environmental Microbiology,2016,18(1):288-301.
[26]劉 震,徐玉鹏,王秀领,等. 黑龙港苜蓿根际土壤真菌群落结构及多样性分析[J]. 江苏农业科学,2021,49(10):197-201.
[27]商鸿生. 现代植物免疫学[M]. 北京:中国农业出版社,2013:40-62.
[28]盛玉钰,丛 静,卢 慧,等. 神农架国家公园林线过渡带土壤真菌多样性[J]. 生态学报,2018,38(15):5322-5330.
[29]熊 涵. 不同海拔对马缨杜鹃土壤真菌、根际真菌和根内生真菌群落结构的影响[D]. 贵阳:贵州师范大学,2021:4-9.
[30]王媛媛,王继岩,焉 莉,等. 吉林省玉米种植区土壤真菌群落多样性特征研究[J]. 中国土壤与肥料,2021(1):34-43.
[31]孙 海,王秋霞,张春阁,等. 不同树叶凋落物对人参土壤理化性质及微生物群落结构的影响[J]. 生态学报,2018,38(10):3603-3615.
[32]董林林,牛玮浩,王 瑞,等. 人参根际真菌群落多样性及组成的变化[J]. 中国中药杂志,2017,42(3):443-449.
[33]冯慧琳,付 兵,任天宝,等. 生物炭对青枯病烟株的根际土壤微生物群落结构调控机制分析[J]. 农业资源与环境学报,2022,39(1):173-181.
[34]Tianvao R,Weikai G,Chensheng X,et al. Novel approaches of regulating soil micro-ecological environment based on modified biochar in plastic greenhouse[J]. Environmental Technology & Innovation,2021,23(PtA):101740.
[35]于小彦,杨艳芳,张平究,等. 不同水分条件下生物质炭添加对湿地土壤微生物群落结构的影响[J]. 生态与农村环境学报,2019,35(9):1163-1171.

