艾比湖湿地黏细菌的分离鉴定及其抗菌活性
王月娥 牛艳慧 钟镇涛 胡文革 李杨



摘要:为了探究艾比湖湿地可培养黏细菌多样性及该地区黏细菌菌株对病原微生物的拮抗作用。通过传统的黏细菌分离方法对采自艾比湖湿地15份样品中的黏细菌进行分离,结合形态学观察、生理生化特征和16S rDNA序列分析,确定菌株的分类地位,并通过平板对峙法分析其抗菌活性。试验结果表明,从采集的15份样品中共分离纯化出22株疑似菌株,经鉴定将其归类为黏球菌属,其中6株为橙色黏球菌(Myxococcus fulvus),14株為变绿黏球菌(M. virescens),2株只鉴定到属(Myxococcus sp.)。抗菌活性分析显示,22株黏细菌表现出不同的抗菌活性,其中14株可以抑制金黄色葡萄球菌(Staphylococcus aureus)的生长,14株黏细菌均可抑制沙门氏菌(Salmonella typhimurium)和大肠杆菌(Escherichia coli)的生长,15株对枯草芽孢杆菌(Bacillus subtilis)的生长表现出抑制作用,17株可以抑制酿酒酵母菌(Saccharomyces cerevisiae)的生长,11株能够抑制链格孢菌(Alternaria alternata)的生长。艾比湖湿地可培养黏细菌多样性不高,且黏球菌属为该地区可培养黏细菌的优势种属。初步筛选出的2株黏细菌菌株WCX_LG-5和TF_YJC-1,具有广谱的抗菌活性,是一类极具开发潜力的微生物资源。
关键词:艾比湖湿地;黏细菌;病原微生物;抗菌活性
中图分类号:S182 文献标志码: A
文章编号:1002-1302(2022)08-0234-09
植物病害是影响国家粮食安全和作物生产力的主要因素之一,对作物的生长发育和产量有较大的影响,造成巨大的经济损失[1],其中70%~80%的病害由病原真菌所致[2-3],其生物防治的研究具有很大的现实意义。研究表明,芽孢杆菌(Bacillus)、假单胞菌属(Pseudomonas)、溶杆菌属(Lysobacter)、木霉属(Trichoderma)和腐霉属(Pythium)等病菌产生的毒素、抗生素及蛋白质类物质等代谢产物能够抑制植物病原菌的生长,其中枯草芽孢杆菌等已被开发为微生物菌剂,应用于农业生产中病害的控制[4-6]。然而,次级代谢产物的产生受到环境因素的影响,这使得拮抗菌株在田间的防治效果较差[7]。目前,大量研究表明在动物病害及虫害的防治过程中,利用其天敌和捕食关系进行病害防治,可达到较好的防治效果[8-9]。然而,微生物中也存在大量的捕食者,如蛭弧菌属(Bdellovibrio)、拟杆菌门(Bacteroidetes)、溶杆菌属(Lysobacter)和黏细菌目(Myxococcales)等[10-12]。其中,黏细菌对病原微生物的捕食特性使其在植物病害防治方面具有较大的潜力,被视为新型的生防微生物类群[13]。
黏细菌是一类能够滑行运动、具有复杂多细胞行为的革兰氏阴性菌[14],主要分布于中性或偏碱性土壤中[15]。然而,在海洋、沙漠、盐碱地和湿地等特殊生境中也发现了大量的黏细菌资源[16-19],在这些生境中黏细菌具有良好的稳定性和抗逆性[20]。目前,对于黏细菌生物活性产物及其在生物防治应用领域的研究日渐突出[21]。迄今为止,从黏细菌中分离获得的活性代谢产物达到600多种[22],这些产物种类多样、结构新颖[23],具有抗真菌、抗细菌和抗肿瘤等生物活性[24]。研究表明,黏细菌产生的活性产物对植物病原菌生长具有较强的抑制作用,且其在土壤中的定殖效果较好[25]。因此,黏细菌是一类极具开发潜力的生物防治因子[26]。然而,获得大量的黏细菌种质资源是其被开发和利用的关键。
新疆艾比湖湿地地处阿拉山口大风通道处,位于准噶尔盆地西南边缘(82°36′~83°50′E,44°30′~45°09′N),是我国温带干旱区内陆湖泊的典型代表[27],总面积2 670.85 km2。艾比湖湿地内分布有沼泽、湖泊、沙漠和盐漠等不同地理区域,区域内土壤盐碱化严重(土壤电导率为1~12 mS/cm;pH值范围为8.0~9.0)。盐角草、柽柳、盐节木、梭梭、花花柴、芦苇和胡杨等植物是艾比湖湿地盐碱环境中的建群植物,具有较强的耐盐能力,对艾比湖湿地生态环境的恢复具有重要作用。目前,有关湿地盐碱环境中耐盐植物群落区黏细菌的分布、多样性及其活性产物的研究较少。因此,对新疆艾比湖湿地盐碱地中建群植物根际土壤中可培养黏细菌菌株的分离及其抗菌特性的研究很有必要。
基于传统的黏细菌分离纯化方法,以艾比湖湿地建群植物根际土壤作为主要研究对象,对该地区可培养黏细菌多样性及其抗菌特性进行研究,这对认识艾比湖湿地可培养黏细菌的种属分类,以及探究该地区黏细菌的代谢产物提供了科学基础。
1 材料与方法
1.1 研究区概况
艾比湖湿地位于准噶尔盆地西南边缘(82°36′~83°50′E,44°30′~45°09′N),地处新疆阿拉山口大风通道下,为典型的大陆性气候,平均降水量为105.17 mm,蒸发量为1 315 mm。由于艾比湖湿地特殊的地理位置,形成了独特的湿地生态环境,生长有多种不同盐生、水生和旱生类植被群落,如盐角草(Salicornia europaea)、芦苇(Phragmites australis)和胡杨(Populus euphratica)等,湿地内土壤多为沙质土壤和黏质土壤,且土壤盐碱化较为严重。
1.2 样品采集与处理
于2018年7月至新疆艾比湖湿地国家自然保护区进行采样。本试验共采集新疆艾比湖湿地15份土壤样品(14份植物根际土壤和1份朽木样品)。采集土壤样品时,去除土壤表面的杂质和表层土后进行取样。利用无菌刷子轻轻将附着在植物根系的土壤刷落,作为该植物群落区根际土壤。将样品迅速带回实验室,立即自然风干、过筛,置于4 ℃冰箱保存备用,于2018年9月进行试验。采样地具体信息见表1。
1.2.1 培养基[17] WCX培养基:CaCl2·2H2O 0.1%,4-羟乙基哌嗪乙磺酸(HEPES)0.48%,琼脂1.5%,pH值7.2。培养基灭菌后,加入终浓度为25 μg/mL的放线菌酮溶液;培养基凝固后用活的大肠杆菌在其表面画线。
ST21CX培养基:A液,K2HPO4 0.1%,酵母抽提物0.002%,琼脂1.5%,蒸馏水670 mL;B液,KNO3 0.1%,MgSO4·7H2O 0.1%,MnSO4·7H2O 0.01%,CaCl2·2H2O 0.1%,FeCl3·6H2O 0.02%,蒸馏水330 mL。高压蒸汽灭菌后将A、B等2个溶液混合,加入放线菌酮溶液(终浓度为25 μg/mL)。为分离嗜纤维素黏细菌,可在培养基表面放置灭过菌的滤纸。
VY/2培养基:安琪酵母0.5%,CaCl2·2H2O 0.1%,MgSO4·7H2O 0.05%,琼脂1.5%,pH值7.6。高压蒸汽灭菌后加入VB12溶液(终浓度为 0.5 μg/mL)和放线菌酮溶液(终浓度为25 μg/mL)。
CAS液体培养基:酪蛋白胨0.3%,MgSO4·7H2O 0.1%,pH值7.2。
VY/4培养基:安琪酵母0.25%,CaCl2·2H2O 0.1%,琼脂1.5%,pH值7.2。
1.2.2 试验菌株 大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、酿酒酵母菌(Saccharomyces cerevisiae)均由笔者所在实验室提供;金黄色葡萄球菌(Staphylococcus aureus)、沙门氏菌(Salmonella typhimurium)和链格孢菌(Alternaria alternata)分别由石河子大学动物科技学院和农学院提供。以上菌株用于测定黏细菌的抗菌活性。
1.3 试验方法
1.3.1 黏细菌菌株的分离 利用兔粪诱导法[28]、大肠杆菌划线诱导法和滤纸诱导法[29]对艾比湖湿地可培养黏细菌进行分离。取适量样品置于已灭菌的培养皿内,于58 ℃烘箱内处理1~2 h,以除去样品中不耐热的杂菌及变形虫[30]。用100 μg/mL的放线菌酮溶液浸泡样品过夜。次日,倒掉废液,取黄豆粒大小的样品接种于WCX大肠杆菌划线培养基、ST21CX滤纸诱导培养基及ST21CX兔粪诱导培养基中,封口。30 ℃恒温培养7 d,持续观察子实体的形成情况。每组试验设置3个重复。
1.3.2 黏细菌的纯化和验纯 用无菌竹签挑取兔粪表面及大肠杆菌周围的子实体,采用直接纯化法、反复转接纯化法、加热纯化法(58 ℃)和冷冻纯化法(-80 ℃)进行纯化。挑取纯化后的菌株接种于CAS液体培养基中,摇床过夜培养。若培养基澄清则说明该菌株已纯;若培养基浑浊,则在VY/2固体培养基上继续纯化。将已纯菌株用25%的甘油于-80 ℃进行长期保存。
1.3.3 黏细菌的形态学分类 利用荧光显微镜对菌株的菌落形态、子实体形态、营养细胞及黏孢子形态进行观察[16-17,31]并拍照。参考《Bergeys manual of systematic bacteriology》[31]和《The prokaryotes》(第2版)[32]的分类标准,对获得的纯菌株进行初步鉴定。
1.3.4 菌株生理生化测定 根据《伯杰细菌鉴定手册》(第8版)中对黏细菌理化特征的描述,对菌株进行LB液体培养、明胶液化、吐温-80利用、脲酶利用、硝酸盐还原、刚果红试验、纤维素降解、过氧化氢反应、淀粉水解与牛奶胨化等试验。
1.3.5 黏细菌16S rDNA系统发育分析 采用十六烷基三甲基溴化铵(CTAB)法提取菌株的基因组DNA,利用细菌16S rDNA通用引物27F[33]和1495R[34]对黏细菌16S rDNA序列进行扩增。扩增产物送至北京华大基因研究中心有限公司进行测序。将测序所得的序列在NCBI网站上进行BLAST序列比对,再用MEGA 5.0软件(Neighbor-Joining法)构建系统发育树,对艾比湖湿地可培养黏细菌多样性进行分析。本研究的测序序列已提交至GeneBank数据库。
1.3.6 黏细菌抗菌活性分析 将黏细菌菌株接种在VY/2固体培养基上培养7 d,待其长满平板后,用灭过菌的打孔器打孔,制备黏细菌菌饼若干。
黏细菌抗细菌及抗酿酒酵母菌活性分析将试验菌株:大肠杆菌、金黄色葡萄球菌、沙门氏菌和枯草芽孢杆菌分别接种至牛肉膏蛋白胨液体培养基内,将酿酒酵母菌接种至马铃薯葡萄糖琼脂(PDA)液体培养基内,37 ℃、180 r/min振荡培养至菌液吸光度(D600 nm)为0.5。各取一定量的菌液,分别均匀涂布至牛肉膏蛋白胨固体培养基和PDA固体培养基上,晾干。用灭过菌的竹签扎取黏细菌菌饼倒扣在涂有试验菌株的培养基的一侧,另一侧放置同样大小的无菌的VY/2琼脂块作为空白对照,封口。37 ℃恒温培养7 d,观察抑菌圈大小。每组试验设置3个重复。
黏细菌抗链格孢菌活性分析:用灭过菌的竹签扎取2~3块黏细菌菌饼,将其倒扣在VY/4固体培养基上[35],在超净台内放置1夜。次日,在离黏细菌菌饼约1 cm处的位置放置1块相同大小的链格孢菌菌饼,另一侧放置同样大小的无菌的VY/2琼脂块作为空白对照,封口。30 ℃恒温培养7 d,观察抑菌圈大小。每组试验设置3个重复。
2 结果与分析
2.1 不同样品中黏细菌的分离与纯化
试验分析了不同样品中黏细菌的分离情况。利用传统的黏细菌分离方法,从新疆艾比湖湿地采集的15份样品中共分离出60株疑似黏细菌菌株,经纯化得到22株纯菌株,纯菌率为36.7% (表2)。研究結果表明,胡杨、芦苇和盐角草样品中均能诱导出球形(或卵球形)、肉粉色(或橘红色)的子实体,且从胡杨根际土壤中分离到的黏细菌菌株数最多;朽木、盐角草和芦苇样品中均能诱导出黄色(或黄绿色)、椭圆形或形状不规则的子实体,且盐角草根际土壤中诱导出的该类黏细菌是最多的;花花柴根际土壤中仅诱导出单个分布的圆形或近圆形的黄色子实体。然而,其余土壤样品中未诱导纯化出黏细菌菌株,这可能与各群落区的土壤类型、根系分泌物及土壤理化因子等有关。
2.2 黏细菌菌株的鉴定
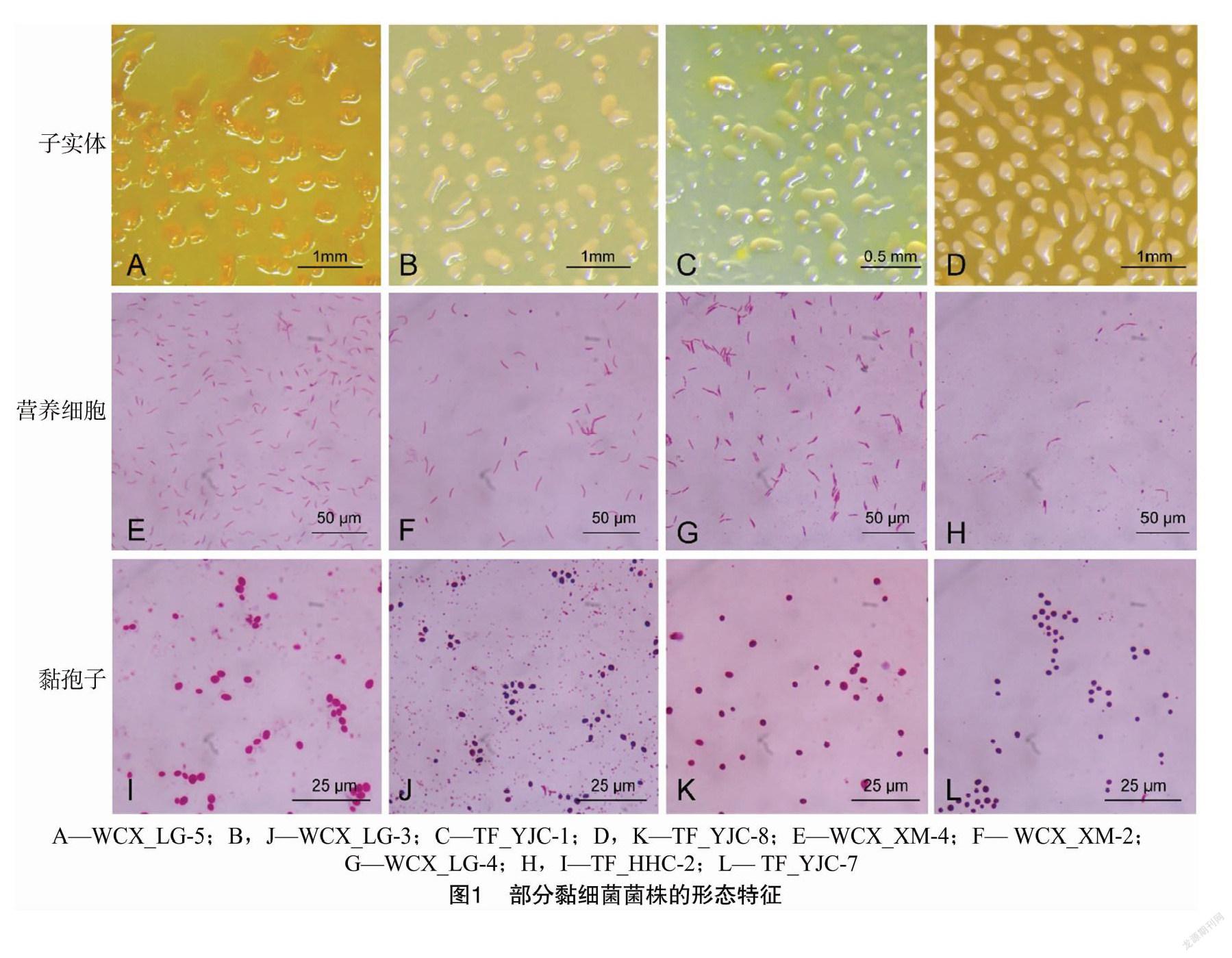
2.2.1 菌株的形态特征 根据菌株的子实体形态、菌落形态、营养细胞及黏孢子形态,将22株疑似黏细菌菌株分为3类,结果如表3所示。这些菌株形态各异,种类多样,在VY/2固体培养上可形成不同形状的菌落,呈圆形(或同心圆)扩展或呈放射状波纹,同时在菌落边缘可形成薄而半透明的膜;子实体肉眼可见,以粉红色、黄色和金黄色为主,形状主要为球形或卵圆形,能产生大量的黏液;其营养细胞为细长杆状、两端稍尖、可弯曲,大小一般为(0.6~1.0) μm×(2~10) μm,为Ⅰ型营养细胞;黏孢子主要为椭圆形、卵圆形或圆形。部分菌株形态特征如图1所示。
2.2.2 菌株的生理生化特征 对22株菌株进行理化性质检测,发现所有菌株均不能在LB液体培养基中生长,且能够利用吐温-80、吸附刚果红、可使硝酸盐还原、淀粉水解、牛奶胨化;菌株WCX_LG-5对滤纸有轻微地降解作用,其余菌株均不能使滤纸降解。所有菌株理化特征与《伯杰氏细菌手册》中对黏球菌属特征的描述相符,进一步结合形态特征,初步认定22株纯菌株为黏球菌属菌株。
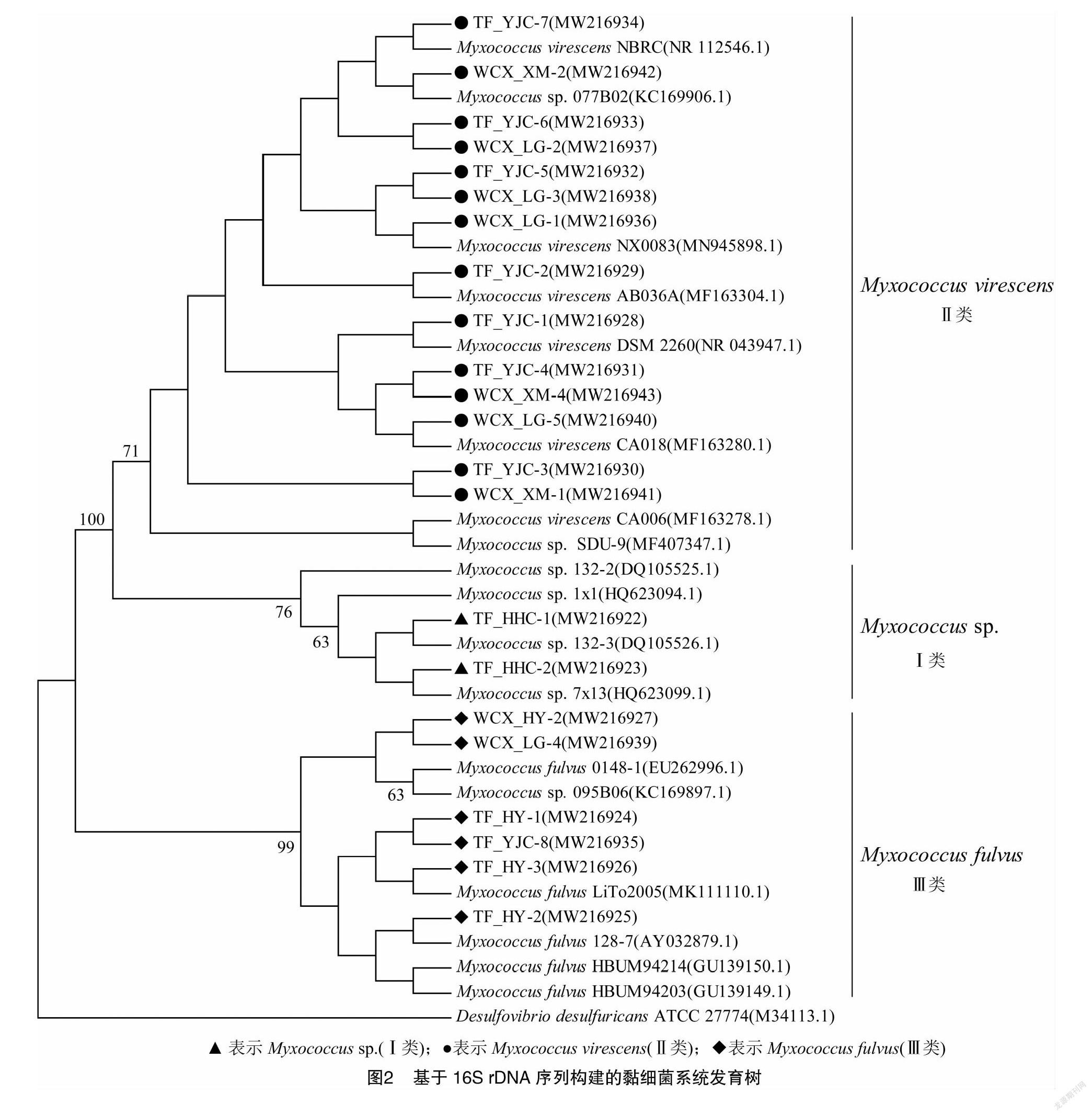
2.2.3 菌株16S rDNA系统发育分析 通过形态鉴定并结合菌株理化性质,初步认定22株菌株为黏球菌属菌株。为进一步确定其分类,通过CTAB法提取了22株菌株的基因组DNA,利用细菌通用引物对菌株的16S rDNA序列进行PCR扩增,并将扩增产物送至华大基因公司进行测序。将测序后所得序列在NCBI上进行BLAST序列比对,利用MEGA 5.0软件中的Neighbor-Joining 法构建系统发育树,对其进行系统发育分析。由图2可看出,以脱硫弧菌(Desulfovibrio desulfuricans)作为外群菌株,22株菌株分为3个分支。Ⅰ类菌株的分支属于黏球菌属(Myxococcus sp.,2株);Ⅱ类菌株的分支属于黏球菌属中的变绿黏球菌(Myxococcus virescens,14株);Ⅲ类菌株的分支属于黏球菌属中的橙色黏球菌(Myxococcus fulvus,6株)。然而,这3类菌株均属于黏球菌属(Myxococcus),这与菌株的形态鉴定结果相一致。由此可以看出,黏球菌属为艾比湖湿地可培养黏细菌的优势种属,且该地区可培养黏细菌多样性不高,这可能与该地区特殊的土壤环境、植被类型和气候等因素有很大关系。
2.3 黏细菌菌株的抗菌特性分析
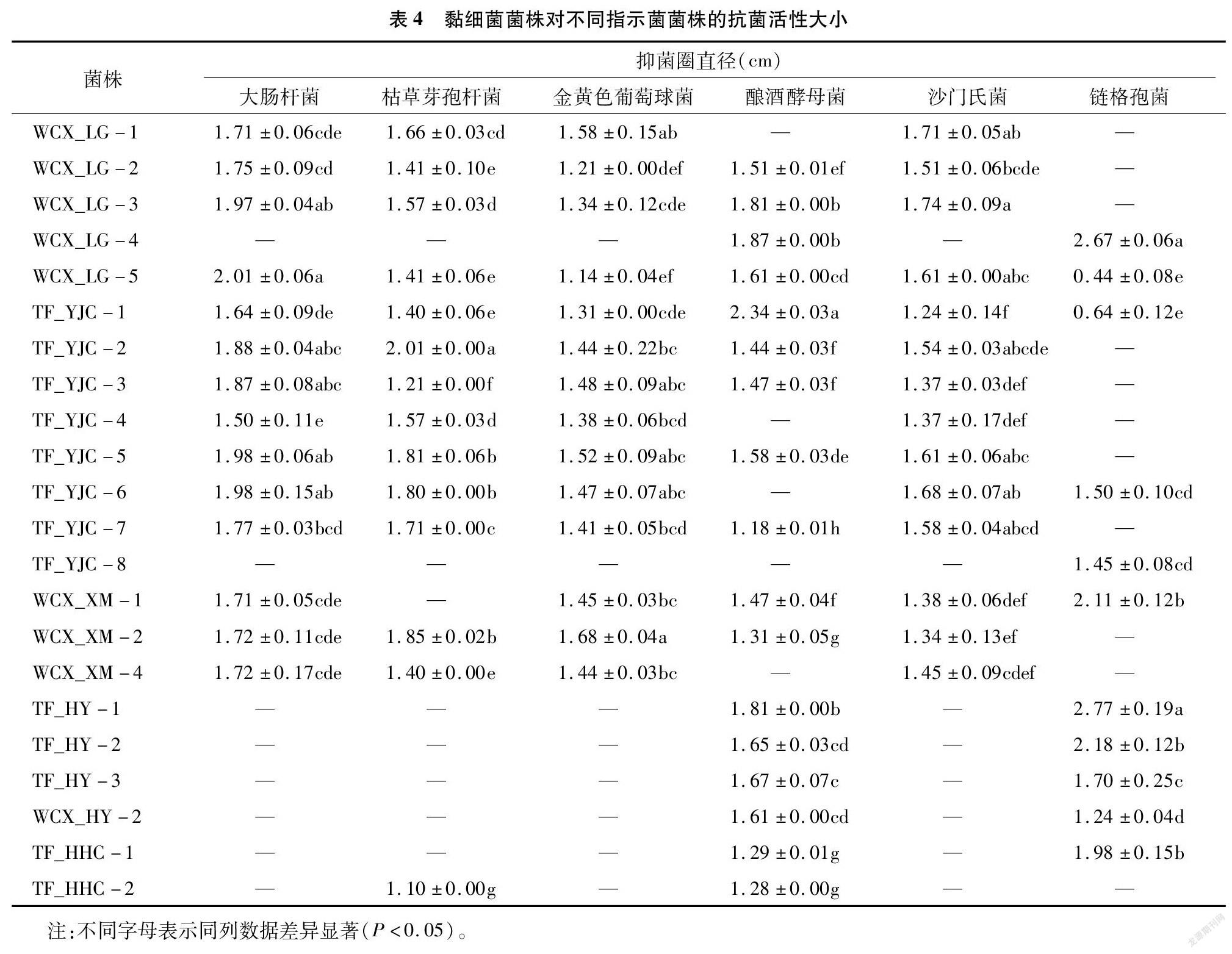
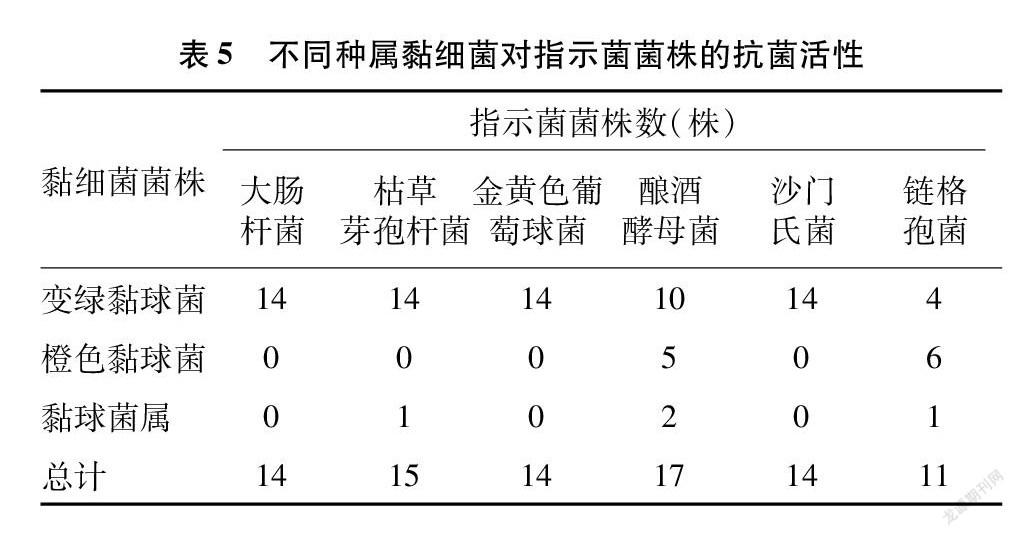
利用平板对峙法,初步探究了22株黏细菌对6种指示菌株的抗菌活性。将指示菌株与黏细菌分别在牛肉膏蛋白胨固体培养基、PDA培养基及VY/4固体培养基上共同培养一定时间后,观察黏细菌抑菌情况并记录抑菌圈的大小。黏细菌抗菌活性检测结果显示,22株黏细菌均表现出对1种或多种指示菌株产生抗性,如图3所示。其中,有14株黏细菌均可抑制大肠杆菌和沙门氏菌的生长,15株对枯草芽孢杆菌的生长表现出抑制作用,14株对金黄色葡萄球菌的生长表现出抑制作用,17株可以抑制酿酒酵母菌的生长,11株黏细菌能够抑制链格孢菌的生长。然而,菌株WCX_LG-5和TF_YJC-1对6种指示菌株均具有抑制作用,具有广谱的抗菌活性。此外,笔者所在课题组还发现归属于同一个种的黏细菌菌株对6种指示菌株的抗性具有一定的差异,结果如表4所示。从表5中可以看出,黏球菌属菌株和橙色黏球菌能够抑制酿酒酵母菌和链格孢菌的生长,而变绿黏球菌对大肠杆菌、枯草芽孢杆菌、酿酒酵母菌、沙门氏菌、金黄色葡萄球菌和链格孢菌均有抑制作用,这说明变绿黏球菌具有广谱的抗菌活性。
3 讨论
3.1 影响艾比湖湿地可培养黏细菌多样性的因素
利用传统的黏细菌分离方法,从新疆艾比湖湿地14份土壤样品及1份朽木样品中分离纯化到14株变绿黏球菌、6株橙色黏球菌和2株黏球菌属菌株,提示艾比湖湿地黏细菌多样性不高,这与张鲜姣等对新疆盐碱化土壤中黏细菌多样性研究结果[18]一致。分析其原因主要有:(1)土壤理化因子(盐碱度)。盐碱地土壤显著的特点是土壤的pH值、含盐量较高,土壤肥力缺乏[36],土壤pH值、含盐量及土壤中的营养物质含量与根系微生物多样性呈显著负相关[37]。通常,黏细菌在中性或偏碱性及有机质丰富的土壤中较为常见[15,38]。而艾比湖湿地土壤盐碱化严重,土壤养分及营养物质均处于较低水平[39],因此该地区的盐碱环境不利于黏细菌的生长。此外,在这种特殊的极端盐碱环境中,可能有一些新种未被发现。(2)土壤性质。黏细菌为土壤中常见的腐生菌,通常一小撮土壤就可分离出较多的黏细菌[31],但在不同的土壤环境中黏细菌的分布是不均匀的[40]。黏细菌在营养丰富的土壤样品中较为丰富,而在含沙土壤中黏细菌含量较少[41]。艾比湖湿地的土壤多为沙性盐碱土且土壤腐殖质含量较低,这可能是影响黏细菌分布及其多样性的重要因素之一。(3)植被类型。从14种植物根际土壤样品中分离筛选黏细菌菌株,其中在盐角草、芦苇、胡杨和花花柴根际土壤样品中分离获得了黏细菌菌株,其余植物根际土壤样品中未分离纯化出黏细菌。此外,从朽木、盐角草和芦苇样品中都分离到了变绿黏球菌,然而从盐角草样品中分离到最多;从胡杨样品中分离到的橙色黏球菌最多,而从花花柴样品中只分离到2株黏球菌属的菌株,而其他样品中均未分离出黏细菌菌株,这说明不同的植被类型及根系分泌物可能会影响黏细菌的分布及其多样性特点。(4)黏细菌分离方法。蚁烁星等通过改进分离方法,大大提高了诱导出的黏细菌的种类和数目[42]。而傳统的黏细菌分离方法本身具有一定的局限性[43],兔粪诱导法和大肠杆菌诱导法主要针对嗜细菌、黏细菌的分离,而滤纸诱导法主要分离嗜纤维素黏细菌菌株[44],所以每种方法并不适用于样品中所有黏细菌菌株的分离。此外,有的黏细菌在纯化过程中,其子实体会随着纯化传代次数的增加而出现不生长、甚至出现死亡等情况[45]。因此在黏细菌分离纯化过程中可能会丢失一些种属,所以分离方法在一定程度上也会影响黏细菌的多样性。
3.2 黏细菌抗菌活性分析
黏细菌作为第三大类药源微生物类群,其次级代谢产物的抗菌活性在其捕食细菌的过程中发挥着重要作用[20],而β-1,6-葡聚糖酶是目前报道的唯一的具有糖苷水解酶活性的外膜蛋白,是黏细菌捕食真菌的关键因子[35]。由于黏细菌不同种属之间的特性差异较大,导致其捕食研究较为缓慢。试验初步探究了22株黏细菌对指示细菌和植物病原真菌的抗菌特性。结果表明,22株黏细菌菌株均对一种或多种指示菌株产生抗性,这可能与黏细菌的捕食作用及其产生的次级代谢产物有关。
大肠杆菌是肠道杆菌中的一种,可以引起人或动物的肠道感染,此外还会引起尿道和膀胱等感染[46]。金黄色葡萄球菌是常见的食源性致病菌,在适当的条件下,金黄色葡萄球菌能够产生肠毒素,引起食物中毒,它是仅次于沙门氏菌和副溶血杆菌的第三大微生物致病菌。分离得到的22株黏细菌中,14株变绿黏球菌不仅能够抑制大肠杆菌和金黄色葡萄球菌的生长,而且对枯草芽孢杆菌和沙门氏菌具有抑制作用,具有广谱的抗菌活性,这可能是由于变绿黏球菌通过分泌蛋白酶、溶菌酶等裂解酶对指示菌株进行消化和捕食的结果。试验中分离得到的6株橙色黏球菌对大肠杆菌、枯草芽孢杆菌及金黄色葡萄球菌均无抑制作用,这与惠明等对橙色黏球菌抗菌活性分析结果[47]不一致,这可能与分离黏细菌的样地及产生代谢产物菌株的特异性有很大关系。此外,试验结果显示同一种属的黏细菌对指示菌株的抗性具有一定的差异性,这可能与黏细菌产生的活性代谢产物的种类有关。
我国大面积种植梨树,其果肉营养丰富。其果实和叶片等往往会被链格孢菌侵染,引发梨黑斑病,这严重影响梨的产量和品质[48]。因此,对梨黑斑病病原微生物的生物防治是一件刻不容緩的事情。抗菌结果显示,分离得到的14株黏细菌能够抑制链格孢菌的生长,这为梨黑斑病病原微生物的防治及微生物农药的开发提供了新方案,同时也为黏细菌菌株代谢产物的深入研究提供了理论数据,具有较好的现实意义。此外,通过对黏细菌抗菌活性的初步探究,发现菌株WCX_LG-5和TF_YJC-1对6种指示菌株的生长均具有抑制作用,具有广谱的抗菌活性,是一类具有开发为菌剂潜力的微生物资源,在今后的研究中有望对其代谢产物进行更深入的研究。
4 结论
利用黏细菌传统分离方法,从新疆艾比湖盐碱湿地中分离出22株黏细菌菌株。所有菌株最终被鉴定为橙色黏球菌、变绿黏球菌和黏球菌属菌株。由此可知,艾比湖湿地可培养黏细菌多样性不高,黏球菌属为该地区可培养黏细菌的优势种属。
黏细菌能够抑制病原微生物的生长。22株黏细菌对一种或多种指示细菌和植物病原真菌的生长具有抑制作用,且同一种属的黏细菌对指示菌株的抗性具有一定的差异性。
有的黏细菌已被开发为微生物菌剂用于农业生产。菌株WCX_LG-5和TF_YJC-1具有广谱的抗菌活性,是一类具有开发为微生物农药前景的微生物资源,为其代谢产物的进一步研究提供了基础。
参考文献:
[1]Savary S,Willocquet L,Pethybridge S J,et al. The global burden of pathogens and pests on major food crops[J]. Nature Ecology & Evolution,2019,3(3):430-439.
[2]康振生. 我国植物真菌病害的研究现状及发展策略[J]. 植物保护,2010,36(3):9-12.
[3]Casadevall A. Fungal diseases in the 21st century:the near and far horizons[J]. Pathogens & Immunity,2018,3(2):183-196.
[4]Yuliar,Nion Y A,Toyota K. Recent trends in control methods for bacterial wilt diseases caused by Ralstonia solanacearum[J]. Microbes and Environments,2015,30(1):1-11.
[5]Syed-Ab-Rahman S F,Singh E,Pieterse C M J,et al. Emerging microbial biocontrol strategies for plant pathogens[J]. Plant Science,2018,267:102-111.
[6]Legein M,Smets W,Vandenheuvel D,et al. Modes of action of microbial biocontrol in the phyllosphere[J]. Frontiers in Microbiology,2020,11:1619.
[7]陈志龙,陈 杰,许建平,等. 番茄青枯病生物防治研究进展[J]. 江苏农业科学,2013,41(8):131-134.
[8]彭 婧,薛书浩. 生物防治在设施蔬菜生产中的应用[J]. 现代农业科技,2014(7):174-175.
[9]方俊松. 农业生物防治的特点及方法[J]. 现代农业科技,2014(7):170,172.
[10]Pal K K,McSpadden Gardener B. Biological control of plant pathogens[J]. The Plant Health Instructor,2006:2(202):147.
[11]Olanya O M,Lakshman D K. Potential of predatory bacteria as biocontrol agents for foodborne and plant pathogens[J]. Journal of Plant Pathology,2015,97(3):405-417.
[12]Lueders T,Kindler R,Miltner A,et al. Identification of bacterial micropredators distinctively active in a soil microbial food web[J]. Applied and Environmental Microbiology,2006,72(8):5342-5348.
[13]李周坤,叶现丰,杨 凡,等. 黏细菌捕食生物学研究进展及其在农业领域的应用潜力[J]. 南京农业大学学报,2021,44(2):208-216.
[14]Dworkin M. Recent advances in the social and developmental biology of the myxobacteria[J]. Microbiological Reviews,1996,60(1):70-102.
[15]Dawid W. Vorkommen und verbreitung fruchtkrper-bildender myxobakterien im Siebengebirge vergleichende untersuchungen unter berücksichtigung charakteristischer biotope[J]. Zeitschrift Für Allgemeine Mikrobiologie,1979,19(10):705-719.
[16]Dawid W. Biology and global distribution of myxobacteria in soils[J]. FEMS Microbiology Reviews,2000,24(4):403-427.
[17]Shimkets L J,Dworkin M,Reichenbach H. The myxobacteria[M]//The prokaryotes. New York:Springer,2006:31-115.
[18]張鲜姣,黎志坤,谭志远,等. 新疆阿克苏地区盐碱地黏细菌分离鉴定[J]. 微生物学报,2012,52(2):160-168.
[19]张鲜姣,吕颖颖,朱红惠. 湿地环境可培养黏细菌多样性研究[J]. 生物技术进展,2018,8(2):140-146,187.
[20]代京莎,李安章,朱红惠. 黏细菌在植物病害生物防治中的作用[J]. 生物技术进展,2016,6(4):229-234.
[21]Hoffmann T,Krug D,Bozkurt N,et al. Correlating chemical diversity with taxonomic distance for discovery of natural products in myxobacteria[J]. Nature Communications,2018,9(1):803.
[22]Schberle T F,Lohr F,Schmitz A,et al. Antibiotics from myxobacteria[J]. Natural Product Reports,2014,31(7):953.
[23]Reichenbach H,Hfle G. Biologically active secondary metabolites from myxobacteria[J]. Biotechnology Advances,1993,11(2):219-277.
[24]Herrmann J,Fayad A A,Müller R. Natural products from myxobacteria:novel metabolites and bioactivities[J]. Natural Product Reports,2017,34(2):135-160.
[25]Dahm H,Brzezińska J,Wrótniak-Drzewiecka W,et al. Myxobacteria as a potential biocontrol agent effective against pathogenic fungi of economically important forest trees[J]. Dendrobiology,2015,74:13-24.
[26]Iizuka T,Fudou R,Jojima Y,et al. Miuraenamides A and B,novel antimicrobial cyclic depsipeptides from a new slightly halophilic myxobacterium:taxonomy,production,and biological properties[J]. The Journal of Antibiotics,2006,59(7):385-391.
[27]Hu W G,Jin X T,Wang Y P,et al. Diversity of eukaryotic micro-organisms and changes in the dominant fungal taxa composition in relationship with soil environment in the Ebinur Lake wetland[J]. Biotechnology & Biotechnological Equipment,2018,32(2):408-419.
[28]Reichenbach H. A simple method for the purification of myxobacteria[J]. Journal of Microbiological Methods,1983,1(2):77-79.
[29]Yan Z C,Wang B,Li Y Z,et al. Morphologies and phylogenetic classification of cellulolytic myxobacteria[J]. Systematic and Applied Microbiology,2003,26(1):104-109.
[30]Karwowski J P,Sunga G N,Kadam S,et al. A method for the selective isolation of Myxococcus directly from soil[J]. Journal of Industrial Microbiology and Biotechnology,1996,16(4):230-236.
[31]Reichenbach H. The myxococcales[M]//Garrity G M. Bergeys manual of systematic bacteriology. 2nd ed. New York:Springer-Verlag,2005:1059-1143.
[32]Reichenbach H,Dworkin M. The myxobacteria[M]//Balous A,Trüper H G,Dworkin M,et al. The prokaryotes. Berlin:Springer,1992:3418-3487.
[33]Brosius J,Dull T J,Sleeter D D,et al. Gene organization and primary structure of a ribosomal RNA operon from Escherichia coli[J]. Journal of Molecular Biology,1981,148(2):107-127.
[34]Brunel B,Givaudan A,Lanois A,et al. Fast and accurate identification of Xenorhabdus and Photorhabdus species by restriction analysis of PCR-amplified 16S rRNA genes[J]. Applied and Environmental Microbiology,1997,63(2):574-580.
[35]Li Z K,Ye X F,Liu M X,et al. A novel outer membrane β-1,6-glucanase is deployed in the predation of fungi by myxobacteria[J]. The ISME Journal,2019,13(9):2223-2235.
[36]Wang W J,He H S,Zu Y G,et al. Addition of HPMA affects seed germination,plant growth and properties of heavy saline-alkali soil in northeastern China:comparison with other agents and determination of the mechanism[J]. Plant and Soil,2011,339(1/2):177-191.
[37]趙 娇,谢慧君,张 建. 黄河三角洲盐碱土根际微环境的微生物多样性及理化性质分析[J]. 环境科学,2020,41(3):1449-1455.
[38]李曙光,周秀文,吴志红,等. 黏细菌的种群生态及其生存策略[J]. 微生物学通报,2013,40(1):172-179.
[39]兰鸿珠,胡文革,杨 扬,等. 艾比湖湿地盐节木土壤固氮微生物群落结构和丰度的环境异质性特点[J]. 微生物学通报,2019,46(7):1597-1610.
[40]李艳青,张利平,杨润蕾. 河北省黏细菌物种资源多样性的研究:承德市区及其五县生态样品的研究[J]. 河北科技大学学报,2005,26(3):215-218,224.
[41]方晓梅,张利平. 黏细菌生态多样性的初步研究[J]. 生物多样性,2001,9(3):207-213.
[42]蚁烁星,周 杨,张鲜姣,等. 不同分离方法对子实体形成和黏细菌分离的影响[J]. 微生物学报,2021,61(4):923-934.
[43]王春玲,冯广达,姚 青,等. 黏细菌基因组学研究进展[J]. 微生物学通报,2019,46(9):2394-2403.
[44]张宜涛,惠 明,田 青. 黏细菌的分离筛选方法及其应用前景[J]. 生物技术,2010,20(6):95-98.
[45]李越中,李 健. 黏细菌的分离与纯化[J]. 微生物学通报,1997,24(4):237-240.
[46]殷泽禄,万 虎. 大肠杆菌的研究综述[J]. 甘肃畜牧兽医,2019,49(5):33-35.
[47]惠 明,张宜涛,田 青,等. 一株橙色黏球菌的筛选及初步鉴定[J]. 河南师范大学学报(自然科学版),2012,40(1):138-141.
[48]董 冉,魏树伟,王宏伟,等. 华北地区梨黑斑病的发生与防治[J]. 果农之友,2019(9):31-32.

