泥炭地苔藓植物孢子生活力的快速检测
白晓珊 仝伟 王建毅 卜兆君 刘文静 夏尤普·玉苏甫 徐雪莹

摘要: 適量的烟气能够促进有性繁殖体萌发,但迄今尚无辅助烟气处理探究孢子生活力快速检测方法的研究报道。该文选择毛缘泥炭藓(Sphagnum fimbriatum)、中位泥炭藓(S. magellanicum)和粗叶泥炭藓(S. squarrosum)作为材料,分别使用亚甲基蓝染色法、四唑(TTC)染色法、碘-碘化钾(I-KI)染色法和红墨水染色法对泥炭藓孢子进行染色,并比照营养液、烟溶液+营养液培养的孢子萌发试验,对比研究泥炭地苔藓植物孢子生活力快速检测的最佳方法。结果表明:亚甲基蓝染色法的染色效果最为明显,TTC和I-KI均未能使泥炭藓孢子着色,孢子对红墨水虽有着色反应但不清晰;与营养液培养相比,添加烟溶液使毛缘泥炭藓、中位泥炭藓和粗叶泥炭藓孢子萌发率分别提高5%、5%和18%;使用亚甲基蓝染色的孢子染色率与经烟溶液处理过的孢子萌发率最为接近。综上认为,亚甲基蓝染色法能快速检测泥炭藓孢子的生活力。
关键词: 泥炭藓孢子, 萌发率, 烟气, 生活力,快速检测
中图分类号: Q945.34文献标识码: A文章编号: 1000-3142(2022)04-0676-06
Rapid viability detection of peatland bryophyte spores
BAI Xiaoshan TONG Wei WANG Jianyi BU Zhaojun LIU Wenjing Shuayib YUSUP XU Xueying
( 1. Key Laboratory of Geographical Processes and Ecological Security in Changbai Mountains, Ministry of Education, School of Geographical
Sciences, Northeast Normal University, Changchun 130024, China; 2. State Environmental Protection Key Laboratory of Wetland Ecology and
Vegetation Restoration, Institute for Peat and Mire Research, Northeast Normal University, Changchun 130024, China; 3. Jilin Provincial
Key Laboratory for Wetland Ecological Processes and Environmental Change in Changbai Mountains, Changchun 130024, China;
4. Jilin Hani National Nature Reserve Administration, Tonghua 134100, Jilin, China )
Abstract: Appropriate amount of smoke can promote germination of sexual propagules. However, rapid detection of spore viability combined with smoke treatment has not been reported up to now. In this paper, Sphagnum fimbriatum, S. magellanicum and S. squarrosum were selected as study species. Methylene blue, TTC, I-KI and red ink were used to dye spores, and nutrient solution and smoke + nutrient solution were used to culture spores, to test which is optimal method for rapid detection of peatland bryophyte spore viability. Of the four methods, methylene blue showed the most obvious dyeing effect while TTC and I-KI did not dye the Sphagnum spores and the spores had no clear and sharp reaction to red ink. Compared with those cultured with nutrient solution only, spores cultured with smoke + nutrient solution increased their germination by 5%, 5% and 18% in S. fimbriatum, S. magellanicum and S. squarrosum, respectively. The frequency of Sphagnum spores dyed with methylene blue was the closest to that of spores germinated after smoke solution treatment. The results indicate that methylene blue dyeing is an ideal method to quickly detect viability of Sphagnum spores.
Key words: Sphagnum spores, germination percentage, smoke, viability, rapid detection
植物种质资源保存,特别是植物有性繁殖体(种子和孢子)的保存是各种迁地保护措施中最为经济有效的方法,在减缓气候变化对生物多样性的影响中发挥了关键作用(Li et al., 2011)。生活力维持是植物有性繁殖体保存的关键。国际上已有一些快速检测植物有性繁殖体生活力的方法,主要包括物理特性检测法(Zhao et al., 2016)、生理检测法(Manju & Kumar, 2015)、生物化学检测法(胡晋等,2009; Magrini et al., 2019)以及逆境检测法(Komba et al., 2006)等。在众多生活力检测方法中,染色测定法最为快速且简单。该方法利用有性繁殖体中的胚对染色剂的不同反应,来判断繁殖体有无生活力,应用比较普遍的如四唑(TTC)染色法(Kaiser et al., 2014; Ma et al., 2019)、噻唑蓝(MTT)染色法(李峰等,2016)、亚甲基蓝染色法(Aniszewski et al., 2012)、I-KI染色法(Du et al., 2018)和红墨水染色法(吴正军等,2012;苏芸芸等,2016)等。
传统的种子生活力的检测通常采用室内萌发试验,以萌发率表征生活力。此方法操作要求高、耗时较长,且休眠往往低估了种子的真实生活力。苔藓植物中,孢子的生活力也常采用萌发率来衡量(Bu et al., 2017)。李秋萍等(2013)曾采用6种非泥炭地苔藓植物为受试物种,开展生活力快速检测研究,通过对比染色率和萌发率发现,亚甲基蓝染色法是测定藓类植物孢子生活力的有效方法。但目前,关于泥炭地苔藓植物孢子生活力测定的研究很少。
由于适量的烟溶液浸泡能够有效促进苔藓植物孢子的萌发,提高孢子萌发率(康媛等,2019),因此能够更为准确地通过萌发率来估测生活力。目前,关于结合烟气处理探讨快速检测苔藓植物孢子生活力方法的研究尚未见报道。本研究选择4种常用于种子生活力快速检测的染色法,以3种泥炭藓属(Sphagnum)植物为试验材料,结合烟溶液浸泡孢子进行解眠,尝试寻找测定泥炭地苔藓植物孢子生活力的简单、快捷的方法,为未来苔藓孢子生态学研究提供基础支撑。
1材料与方法
1.1 孢蒴材料采集
研究采用的受試物种为毛缘泥炭藓(Sphagnum fimbriatum)、中位泥炭藓(S. magellanicum)和粗叶泥炭藓(S. squarrosum)。2018年7月,于小兴安岭东段南坡的汤北林场泥炭地(129°04′ E,48°25′ N)采集毛缘泥炭藓和粗叶泥炭藓的孢蒴;于长白山西麓哈泥泥炭地(126°31′ E,42°13′ N)采集中位泥炭藓孢蒴。孢蒴采回后,均放入冰箱4 ℃暗保存。
1.2 烟溶液制备
锈色泥炭藓(S. fuscum)为哈泥泥炭地常见物种,易于采集,以该植物为材料制备烟溶液。将390 g锈色泥炭藓置于不锈钢炉中燃烧,产生的烟气通过导管导入装有350 mL蒸馏水的瓶中直到烟气溶液饱和,作为烟储备液,室温密闭保存。
1.3 试验设计
1.3.1 孢子初始萌发率与生活力测定孢子悬液的制作参照康媛等(2019)的方法,3次重复。将接种孢子悬液的培养皿置于PRX-450C型人工气候箱中。温度周期、光照周期和光强周期依次设为27 ℃/22 ℃、16 h/8 h以及8 000 lx/0 lx,空气相对湿度为60%(Bu et al., 2017)。于培养的第21天(Feng et al., 2017),显微镜下统计萌发率。
1.3.2 不同染色方法的比较挑选发育成熟且保存完好的3种受试物种的孢蒴,分别置于12个烧杯中(4种检测方法 × 3个物种),充分捣碎以备染色使用。
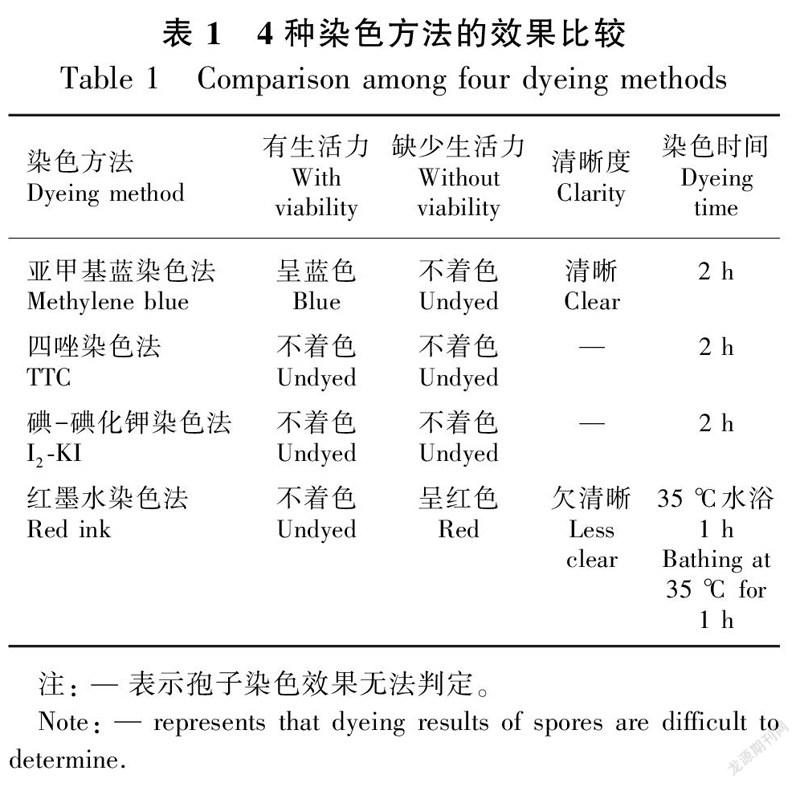
1.3.2.1 亚甲基蓝染色法亚甲基蓝染色剂的配制参照杨发君等(2010)的方法,浓度配置成0.1%。分别取2 mL染液依次滴入装有3种泥炭藓孢子的烧杯中,搅拌均匀,静置染色2 h。染色结束后,利用5 cm × 5 cm的聚乙酰胺筛布将孢子从染液中过滤出,利用3 mL蒸馏水反复冲洗制成孢子悬液。取1 mL滴入制作好的培养皿中(3个重复)。显微镜下统计染色率。孢子若染成蓝色,则计为有生活力,未染色的则计为无生活力。
1.3.2.2 TTC染色法TTC染液的配制方法参照张志良等(2003)的方法,浓度配制成0.5%,避光保存。染色过程与观察方法同上。若染成红色,则认为其具有生活力,其他情况认为孢子无生活力。
1.3.2.3 I-KI染色法参照胡晋等(2009)对种子生活力的测定原理和方法,染色过程及观察方法同上。若孢子壁呈淡蓝色,计为有生活力,否则计为无生活力。
1.3.2.4 红墨水染色法红墨水用蒸馏水20倍稀释,制成5%的红墨水染液(张志良和瞿伟菁,2003),染色时长设定为1 h,并进行水浴处理,温度设定为35 ℃。孢子若被染成红色,则计为无生活力,否则计为有生活力。
1.3.3 烟溶液处理对染色结果的影响将制作好的孢子小包(参照1.3.1)置于烟溶液中,浓度设置同1.3.1,浸泡24 h。对照为未经烟溶液浸泡处理直接染色的孢子。浸泡结束后,用蒸馏水冲洗小包外部,并将每种泥炭藓的4个孢子小包分别用上述染液反复冲洗置于干净烧杯中。重复1.3.2试验内容,观察孢子的染色率,并与1.3.2中的染色结果进行对比。
1.4 数据处理
使用SPSS 24.0软件对数据进行统计分析。不同染色法的染色率差异、烟溶液处理与未经烟溶液处理的萌发率差异、经烟溶液处理与未经烟溶液处理的染色率差异以及染色率与加烟溶液或未加烟溶液培养的萌发率差异,均采用t检验(α=0.05)。
2结果与分析
2.1 不同染色方法的效果比较
使用4种不同的染色方法对3种泥炭藓孢子进行染色试验,以测定孢子的生活力,试验结果见表1。试验发现,TTC染色法和I-KI染色法对3种泥炭藓孢子均无效果(图1:b,c),即使延长染色时間等处理也无法使孢子着色。红墨水染色法虽然能够使孢子着色,但需要进行1 h、35 ℃的水浴处理(图1:d),从而使试验增加了复杂性。然而,利用亚甲基蓝染色法处理的孢子(图1:a),染色效果十分明显,且清晰度很高。
2.2 孢子萌发率的测定
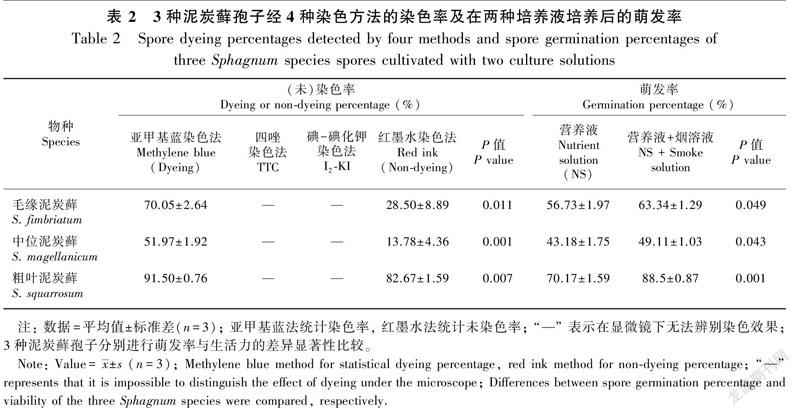
培养21 d观察发现,烟溶液的处理对3种泥炭藓孢子的萌发率都存在显著的正效应(表2)。其中,烟溶液的处理使毛缘泥炭藓和中位泥炭藓孢子的萌发率提高均在5%以上,经烟溶液处理过的孢子萌发率与对照相比具有显著差异(P<0.05,表2)。由表2可知,烟溶液处理对于粗叶泥炭藓孢子的促萌作用最明显,且表现出极显著的差异性(P<0.001)。
2.3 染色率与萌发率的比较
3种泥炭藓孢子经4种不同的染色方法处理后所得的染色率差异均达到显著水平(P<0.05)。由表2可知,亚甲基蓝、I-KI和TTC染色法的染色率及红墨水染色法的未染色率与3种泥炭藓孢子的初始萌发率之间都存在着显著差异。在染色效果较好的亚甲基蓝染色法和红墨水染色法中,利用红墨水染色法所测定的3种泥炭藓孢子未染色率与将其进行烟溶液处理后所得到的萌发率依然存在显著性差异(P<0.05);而亚甲基蓝染色率与烟溶液处理后的孢子萌发率之间无差异,且高度相关(R=0.990)。另外,使用亚甲基蓝染色法所得染色率高于烟溶液浸泡处理后的孢子萌发率,更高于孢子的初始萌发率(表2)。
2.4 烟溶液处理对孢子染色的影响
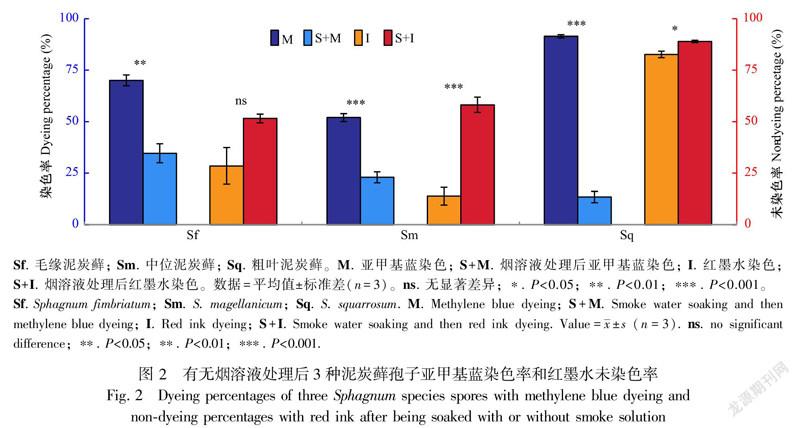
在亚甲基蓝染色法的应用中,3个物种表现出一致的规律,即经烟溶液处理后再染色所得的染色率显著低于直接染色的染色率(P<0.05,图2),且与萌发率之间存在显著差异(P<0.05,表2和图2)。在红墨水法的应用中,经烟溶液处理后再染色所得的未染色率均高于直接红墨水染色的未染色率;除毛缘泥炭藓外,在有无烟溶液处理的不同情况下,同一物种的未染色率之间存在显著差异(P<0.05,图2);与萌发率对比来看,中位泥炭藓和粗叶泥炭藓孢子经烟溶液处理后的未染色率与其萌发率之间无差异(均P>0.05,表2和图2)。
3讨论与结论
4种染色方法中,亚甲基蓝染色法和红墨水染色法具较清晰的染色效果,但亚甲基蓝染色法染色率与经烟溶液处理后的萌发率最接近,且大于未经烟溶液浸泡处理的孢子初始萌发率。由此反映出,烟溶液可促进孢子萌发,而亚甲基蓝染色率能指示烟溶液浸泡后的孢子萌发率。
在进行TTC染色时,依据前人研究结果所选择的染液浓度和浸泡时间对孢子染色并无效果(Mendes et al., 2009; Kaiser et al., 2014)。这与孢子壁阻碍TTC进入、孢子脱氢酶含量过低或呼吸代谢不强有关。另外,Kaiser等(2014)对单花番樱桃(Eugenia uniflora)种子进行TTC染色时发现,附着在种子上的被膜起到物理屏障的作用,阻止了内部组织与TTC溶液的直接接触,且苔藓植物孢子壁具有成层性(Brown et al., 1982)。因此,在使用TTC染色时,需使用去角质、破除屏障等方法使种皮具有渗透性(Magrini et al., 2019),即需对孢子进行预处理。
由于泥炭藓孢子中的淀粉含量比较低, 利用I-KI并不能使泥炭藓孢子染色。有研究表明,藓类植物孢子中的脂肪含量很高,明显高于其他成分(Fang & Zhu, 2012)。利用红墨水染色法的确可以使孢子着色,但将未染色率、烟溶液浸泡后的萌发率、孢子初始萌发率相比,三者都具有显著差异。并且,利用红墨水染色的孢子颜色深浅不一,存在较大误差。
孢子的自身代谢老化、环境的温度、水分、埋藏深度、氧、微生物、化感作用、pH和养分等都会对孢子的生活力造成影响(Feng et al., 2018),使孢子的萌发率低于生活力。一定浓度的烟溶液处理可促进泥炭藓孢子的萌发(康媛等,2019),使烟溶液处理后的孢子萌发率更能表征孢子生活力。本试验中,亚甲基蓝染色法的染色效果最明显,染色快速,无需经过复杂的恒温水浴等操作,且染色率与烟溶液处理后的萌发率无差异,表明该方法可以作为泥炭地苔藓植物孢子生活力的快速检测方法。
在本试验的3个物种中,除毛缘泥炭藓外,由于经烟溶液处理后再利用红墨水进行染色所得到的未染色率与孢子烟溶液处理后的萌发率无差异,因此烟溶液处理后的生活力测定可以利用此法进行操作。另外,尽管清晰度略低,但测定孢子生活力仍可使用红墨水染色法与亚甲基蓝染色法相互佐证,避免单一测定出现的误差,增加准确度。
经烟溶液处理后使用亚甲基蓝染色所得染色率远低于直接染色的染色率。一方面,烟气中的某些化学成分优先与亚甲基蓝发生反应,从而导致孢子无法显色;另一方面,亚甲基蓝是一种碱性的活体染色剂,能与核酸结合令细胞核呈蓝色,而烟溶液的浸泡可能影响核酸物质,使孢子无法染上色。因此,将此法用于泥炭地地层中经历过野火烟气影响的孢子会低估其生活力。
致谢范贝贝同学在试验过程中给予了帮助,谨致谢意。
参考文献:
ANISZEWSKI T, HAIKONEN J, HELWIG B, et al., 2012. Vigor, vitality and seed dormancy of Avena sativa cultivars in a long-term experiment [J]. J Appl Bot Food Qual, 85(2): 150-158.
BROWN RC, LEMMON BE, CAROTHERS ZB, 1982. Spore wall ultrastructure of Sphagnum lescurii sull [J]. Rev Palaeobot Palynol, 38(1/2): 99-107.
BU ZJ, LI Z, LIU LJ, et al., 2017. Bryophyte spore germinability is inhibited by peatland substrates [J]. Acta Oecol, 78(1): 34-40.
DU GC, XU JG, GAO CR, et al., 2018. Effect of low storage temperature on pollen viability of fifteen herbaceous peonies [J]. Biotechnol Rep, 20(1): 1-6.
FANG Y, ZHU RL, 2012. Haplocladium microphyllum (Hedw.) Broth. capsules as food for Agrotis sp. (Lepidoptera) larvae [J]. J Bryol, 34(2): 108-113.
FENG L, BU ZJ, MALLIK A, et al., 2017. Continuous waterlogging may not facilitate germinability maintenance of Sphagnum spores [J]. Wetlands, 37(6): 1015-1022.
FENG L, SEBASTIAN S, OOI MKJ, et al., 2018. Oxygen-deficiency and allelochemicals affect Sphagnum spore persistence in peatlands [J]. Plant Soil,432(1/2): 403-413.
HU J, 2009. Principles and method of seed viability test [M]. Beijing: China Agricultural Press. [胡晉, 2009. 种子生活力测定原理和方法 [M]. 北京: 中国农业出版社.]
KAISER DK, BIRON RP, SIMONATO SC, et al., 2014. Adjustment of the methodology of the tetrazolium test for estimating viability of Eugenia uniflora L. seeds during storage [J]. BBA, 36(3): 344-351.
KANG Y, BAI XS, BU ZJ, et al., 2019. Simulated study on the effects of smoke on sphagnum spore germination [J]. Chin J Appl Ecol, 30(2): 637-643. [康媛, 白晓珊, 卜兆君, 等, 2019. 烟气对泥炭藓孢子萌发影响的模拟研究 [J]. 应用生态学报, 30(2): 637-643.]
KOMBA, CG, BRUNTON BJ, HAMPTON JG, 2006. Accelerated ageing vigour testing of kale (Brassica oleracea L. var. acephala DC) seed [J]. Seed Sci Technol, 34(1): 205-208.
LI DZ, YANG XY, PRITCHARD HW, 2011. Strategies and challenges in plant germplasm conservation [J]. Plant Divers Resour, 33(1): 11-18. [李德铢, 杨湘云, PRITCHARD HW, 2011. 种质资源保存的战略问题和面临的挑战 [J]. 植物分类与资源学报, 33(1): 11-18.]
LI F, LI SM, KE WD, et al., 2016. Study on viability and storage life of Heleocharis dulcis pollen [J]. Hubei Agric Sci, 55(10): 2564-2566. [李峰, 李双梅, 柯卫东, 等, 2016. 荸荠花粉活力测定及贮藏寿命研究 [J]. 湖北农业科学, 55(10): 2564-2566.]
LI QP, WU SP, LU BB, et al., 2013. A rapid detection method of moss spore viability [J]. Acta Bot Boreal-Occident Sin, 33(10): 2126-2130. [李秋萍, 吴思苹, 鲁蓓蓓, 等, 2013. 藓类植物孢子生活力的快速检测方法初探 [J]. 西北植物学报, 33(10): 2126-2130.]
MA Z, LIU J, DONG J, DONG JJ, et al., 2019. Optimized qualitative and quantitative methods for barley viability testing using triphenyl tetrazolium chloride staining [J]. Cereal Chem, 96(3): 421-428.
MAGRINI S, BARRECA D, ZUCCONI L, 2019. A rapid double-staining technique to improve seed viability testing in terrestrial orchids [J]. Plant Biosyst, 153(6): 877-882.
MANJU V, KUMAR S, 2015. Seed leachate conductivity and its correlation with the seed viability and germination of TNAU papaya cv. CO8 seeds stored under different environmental conditions [J]. Inter J Agric Sci Res, 5(4): 127-130.
MENDES AMS, BASTOS AA, MELO MGG, 2009. PadronizaÇão do teste de tetrazólio em sementes de Parkia velutina Benoist (Leguminosae-Mimosoideae) [J]. Acta Amazon, 39(4): 823-828.
SU YY, WANG KC, XUE Q, 2016. Study of the pollen viability and stigma receptivity of Agastache rugosa from different areas [J]. Acta Pratac Sin, 25(9): 189-196. [苏芸芸, 王康才, 薛启, 2016. 不同产地藿香花粉活力与柱头可授性研究 [J]. 草业学报, 5(9): 189-196.]
WU ZJ, ZHU ZB, GUO QS, et al., 2012. Preliminary study on pollination biology of Tulipa edulis [J]. Chin J Chin Mat Med, 37(3): 293-297. [吴正军, 朱再标, 郭巧生, 等, 2012. 老鸦瓣传粉生物学初步研究 [J]. 中国中药杂志, 37(3): 293-297.]
YANG FJ, ZHANG Y, ZHANG J, et al., 2010. Research on the determining methods of the pollen viability and stigmatic receptivity of Saposhnikovia divaricata [J]. Ginseng Res, 22(2): 22-25. [杨发君, 张妍, 张建, 等, 2010. 防风花粉活力测定方法的比较及柱头可授性的研究 [J]. 人参研究, 22(2): 22-25.]
ZHANG ZL, QU WJ, 2003. Experimental guidance of plant physiology [M]. 3rd ed. Beijing: Higher Education Press: 206. [张志良, 瞿伟菁, 2003. 植物生理学实验指导 [M]. 3版. 北京: 高等教育出版社: 206.]
ZHAO XG, GAO YY, WANG X, et al., 2016. Research on tomato seed vigor based on X-ray digital image [C]. Optoelectronic Imaging & Multimedia Technology IV. Beijing: International Society for Optics and Photonics.
(責任编辑蒋巧媛)

