阿莫西林克拉维酸钾致药物性肝损伤1例及文献复习
袁维 黄杏 曾雅雯 石姣灵 陈斌
患者,男性,58岁,主因“腹痛、身目尿黄伴乏力1月余,恶心呕吐、纳差半月余”于2020年8月17日入院。1个月前患者无明显诱因出现持续性上腹痛,进食后明显加重,无恶心、呕吐,无畏寒、发热等其他不适,当地医院胃镜:1.胃潴留;2.慢性浅表性胃炎;3.十二指肠炎;4.Barrett食管。予“阿莫西林克拉维酸钾胶囊2片2次/d”口服;服用2 d后上腹痛明显缓解,但开始出现身目尿黄、乏力、全身瘙痒,当地医院查肝功能:ALT 117.6 U/L,AST 66 U/L,Alb 39.2 g/L,TBil 124.7 μmol/L,DBil 74.7 μmol/L。腹部B超:瓷化胆囊,胆总管上段管壁欠光滑。患者停用阿莫西林克拉维酸钾,辗转多家医院治疗,病毒性肝炎全套、自免肝全套、输血四项、铜蓝蛋白、结缔组织病全套、C12、甲状腺功能三项、肿瘤标志物均未见异常;上腹部MRI;1.考虑胆囊结石并胆囊炎。2.脾脏多发血管瘤。3.右肾错构瘤。4.肝囊肿。予以护肝、退黄、抗感染等对症支持治疗,并于8月3日行ERCP+ENBD术治疗,患者自觉症状无好转,反复复查肝功能仍明显异常,故于8月17日入我院。入院症见:患者纳差,睡眠差,小便黄,大便黄,偶为陶土色,4~5次/d,水样便,量不多,未见黏液脓血改变,体质量减轻20余斤。
患者既往20年前行阑尾切除术;无饮酒史,否认放射线及毒物接触史,吸烟1包/半月,否认肝病家族史;入院查体:神清,精神萎靡,面色萎黄,皮肤及巩膜中度黄染,肝掌(-),蜘蛛痣(-),心肺(-),腹平软,无压痛及反跳痛,肝脾肋下未及,墨菲征(-),肝区叩痛(-),移动性浊音(-),双下肢不肿,NS(-)。鼻胆管引流通畅。
入院查:WBC 7.40×109/L,Hgb 131 g/L,NEU 79.80%,PLT 280.00×109/L,RBC 4.46×1012/L;CRP(-);PCT 0.212 ng/mL;肾功能:UREA 12.5 mmol/L;肝功能:ALT 300.3 IU/L,AST 196.5 IU/L,ALP 193.0 U/L,TBil 156.0 μmol/L,DBil 129.6 μmol/L,IBil 26.4 μmol/L,TBA 22.0 μmol/L;HAV、HBV、HCV、HEV、EBV、CMV等均阴性;自身免疫抗体、抗核抗体、免疫全套、自免肝全套、IgG4均阴性;肿瘤全套阴性;GM实验、G实验、大便培养及胆汁培养阴性;尿常规:尿胆原(++),尿胆红素(++);大便常规、血糖、血脂、甲亢全套、血氨、凝血常规、心肌酶、胰腺炎筛查阴性;上腹MRI+MRCP:胆总管末端未见明确增厚征象,肝内外胆管未见明确梗阻性扩张改变;胆囊结石、胆囊炎(图1)。T管造影:胆总管T管引流术后,胆总管通畅,未见明确充盈缺损。病理结果:肝活检光镜+免疫组化:肝细胞弥漫浊肿变性伴淤胆,毛细胆管单栓形成,部分小叶间胆管损伤,局部灶小叶间胆管缺失,考虑药物性肝损伤可能性大;免疫组化结果:CK示大部分小叶间胆管存在,部分小叶间胆管损伤,局灶小叶间胆管缺失,可见祖细胞双向分化伴小胆管增生。HBsAg及HBcAg均阴性(图2)。肝活检电镜诊断:符合淤胆性肝病超微病理改变(图3)。
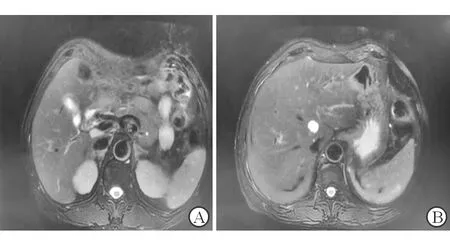
图1 上腹部MRI+MRCP
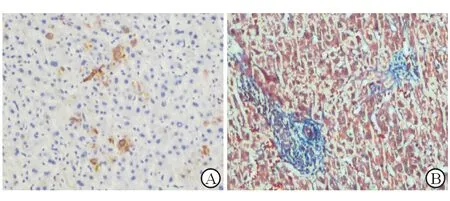
图2 肝脏免疫组化染色
治疗经过:因患者胆管引流通畅,故予以拔除鼻胆管,泮托拉唑制酸护胃,前列地尔改善肝脏微循环,丁二磺酸腺苷蛋氨酸及熊去氧胆酸改善胆汁淤积,头孢哌酮钠舒巴坦抗感染,异甘草酸镁降酶、抑制炎症反应,治疗3周后,患者身目尿黄明显减轻,肝功能指标明显改善,准予出院,并继续口服护肝药物治疗。七个月后门诊随访,患者肝功能完全恢复正常。
讨论美国药物性肝损伤研究网络(US-DILIN)[1]和西班牙药物性肝损伤登记数据库[2]研究发现阿莫西林克拉维酸(Amoxicillin-clavulanate,AC)是非对乙酰氨基酚药物性肝损伤(Drug-induced liver injury,DILI)最常见的原因。在冰岛进行的一项为期2年的前瞻性研究中追踪了约25万份的药物处方,在接受治疗的3.5万例患者中,发现了15例AC-DILI,相当于每2 350例患者中就有1例(每10万人中有43例)[2]。我国阿莫西林克拉维酸所致的肝损伤鲜有报道。
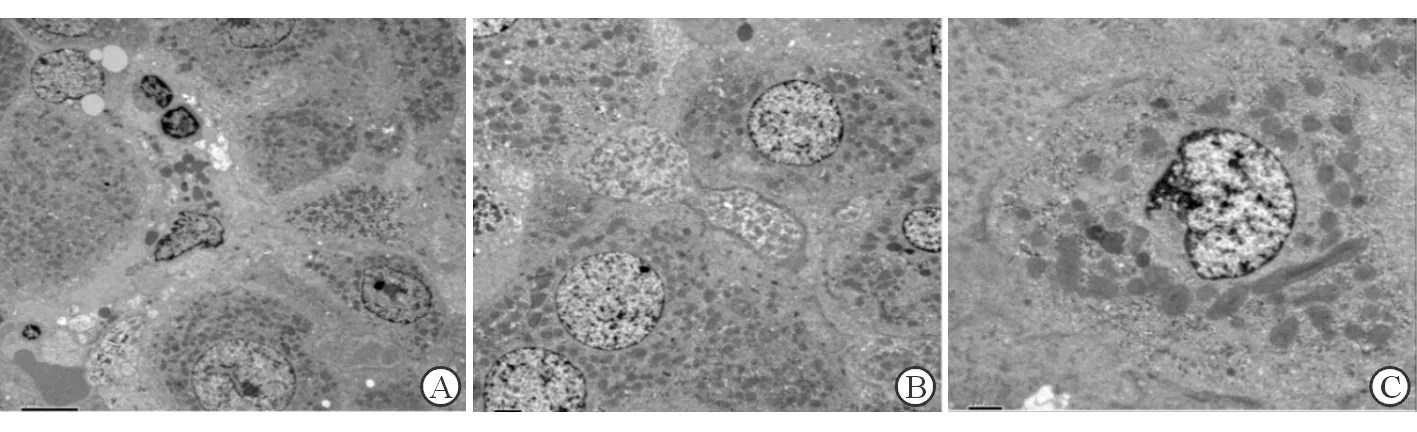
图3 肝组织电镜
中年男性患者,1个月前出现腹痛,服用阿莫西林克拉维酸钾后出现身目尿黄、乏力及恶心呕吐、纳差,反复查肝功能异常,存在肝内胆汁淤积性肝病的生化学依据,考虑胆汁淤积性肝病[3]。排除了遗传代谢性肝病、酒精性肝病、寄生虫感染、病毒性肝炎等常见的肝病,患者影像学检查未见肝外梗阻征象,肝穿病理符合淤胆性肝病超微病理改变。结合患者有服用阿莫西林克拉维酸钾的病史,考虑药物性肝损伤。根据药物性肝损伤诊断标准[4],明确诊断为:药物性肝损伤,混合型,急性,RUCAM评分9分(极可能),严重程度3级。
阿莫西林-克拉维酸(Amoxicillin-clavulanate, AC)是一种复方制剂,克拉维酸为β-内酰胺酶抑制剂具有β内酰胺结构抗菌活性弱但强效广谱抗酶,可保护阿莫西林不被β-内酰胺酶灭活,所以复方制剂扩大了抗菌谱。阿莫西林或克拉维酸均可通过免疫机制引起胆管损伤,且两者有协同胆管损伤作用[5]。
AC-DILI可发生一系列胆汁淤积性肝损伤,包括单纯的肝内胆汁淤积和混合性肝/胆汁淤积损伤,偶尔可发展为消失的胆管综合征(vanishing bile duct syndrome,VBDS)[6-7]。AC-DILI最常见的肝损伤类型为胆汁淤积性肝损伤。胆汁淤积性肝炎的主要症状(如疲劳、食欲不振、瘙痒)[2]。黄疸是AC-DILI患者的典型症状;大多数患者完全康复,少数可能会死亡或需要肝移植[8]。该例患者的病理提示肝细胞弥漫浊肿变性伴淤胆,毛细胆管胆栓形成,部分小叶间胆管损伤,局灶小叶间胆管缺失,主要考虑混合性肝/胆汁淤积损伤。
与其他DILI不同,AC-DILI的发病人群多见于老年男性患者,但女性患者也有重症化的报道,表明年龄和性别的表观遗传变化可能在AC-DILI的结局中发挥作用[9]。大多数DILI患者通常在停用药物及护肝等对症处理后,肝功能逐渐好转,而延迟(治疗停止后)发病通常被认为是AC-DILI的特征[9]。该例患者在停用阿莫西林克拉维酸钾1个月后才开始逐渐恢复,符合AC-DILI的发病特征。
AC-DILI的发病机制主要是免疫介导的对胆管细胞或肝细胞的攻击。细胞免疫应答所针对的特定抗原目前尚不清楚,但它们可能是由阿莫西林或克拉维酸的β -内酰胺结构产生的新抗原,与易感宿主蛋白发生反应[9]。虽然服用AC的许多人可能形成新抗原,但DILI可能只发生在具有特定遗传易感性的一小群人。人类白细胞抗原(HLA) I类和II类位点的遗传变异已被证明与AC-DILI相关[10]。
HLA 基因位于人体第6 号染色体短臂上,根据结构、组织分布和功能差异分3个基因区。Ⅰ类基因区包括HLA-A、HLA-B、HLA-C位点,参与内源性抗原提呈;Ⅱ类基因区包括HLA-DR、DP、DQ三个亚区,参与外源性抗原提呈和免疫调节;Ⅲ类基因区位于Ⅰ类和Ⅱ类之间,包括C2、C4等,参与炎症反应[11]。胆管细胞组成表达HLA I类分子。HLA I类分子可能与细胞毒性CD8+T细胞介导的肝细胞损伤有关;在胆汁淤积性疾病和肝移植排斥反应中,胆管细胞也表达HLA II类分子,胆管细胞可能扮演APC的角色,HLA II类分子激活APC与CD4+T细胞之间的相互作用,导致胆管炎症和肝损伤[12]。HLA-DRB1*1501-DRB5*0101-DQB1*0602、HLA-A*0201 通过适应性免疫反应增加AC-DILI 易感性[13]。
AC-DILI的治疗总体策略主要包括停用AC,对症支持治疗、潜在感染的治疗、熊去氧胆酸的应用和免疫抑制剂的应用,糖皮质激素疗效不好或不良反应明显时可以试换用吗替麦考酚酯或他克莫司,VBDS有合并症或存在并发症时应给予综合治疗。出现肝衰竭可以应用包括血浆置换的人工肝支持系统治疗,以便等待肝移植。本例患者经护肝、降酶、改善肝脏微循环、抗感染、改善胆汁淤积及营养支持对症治疗后,患者自觉症状好转,随访肝功能完全恢复正常。
诊治体会:1.临床医生要仔细询问病史,注重细节及人文关怀,胆大心细;2.切实提高自身的基础知识,提高自己的医疗水平,正确及合理用药;3.在处方时要警惕药物的少见不良反应;4.慎重使用阿莫西林克拉维酸钾,尤其是老年男性患者;5.注意个体差异,严密监测观察药品的不良反应及副作用。

