氧化石墨烯对罗丹明B的吸附行为*
郭才兰,李俊燕,2,王 迁,2
(1.渭南师范学院 化学与材料学院,陕西 渭南 714099;2.陕西省多河流湿地重点实验室,陕西 渭南 714099)
工业的快速发展、天然水资源的过度使用、城市化失控、人口增长这些都大大影响着水质量[1-3]。水中有毒化学品的存在对人类健康和海洋生物构成严重的威胁,有些有机污染物致癌,短期或长期暴露能引起严重的并发症[4-5]。吸附法是去除水中有机污染物的有效方法[6-8]。碳系纳米材料,如多孔碳、木炭、富勒烯、碳纳米管、石墨烯等具有成本低、比表面积高、易于改性、环境友好[9]等优点,广泛应用于水中有机污染物的处理[10],其中石墨烯及其衍生物因其独特的性质而备受青睐。
石墨烯是一种由碳原子紧密排列而成的蜂窝状结构的二维材料,二维石墨烯能包裹成零维的富勒烯,也能卷曲成一维的碳纳米管,还能堆积成三维的石墨。π电子的离域网络结构提供石墨烯优于其他纳米体系的稳定性[11-15]。氧化石墨烯(GO)是石墨烯的重要衍生物,除了具有与石墨烯类似的性质外,表面还含有丰富的含氧官能团,使其更加适用于吸附场合[16]。GO在吸附和水处理领域的应用研究越来越多[17-19],但实际水域中往往存在着多种离子,这些共存离子的影响以及吸附机理方面的报道相对较少。
作者以罗丹明B(RB)为对象,探索pH值、吸附剂质量、吸附时间、离子强度、Cr6+对GO吸附RB性能的影响,并运用各种吸附模型分析吸附机理,以期为GO在实际水治理中的应用提供更多的理论依据。
1 实验部分
1.1 原料、试剂与仪器
天然石墨粉:纯度99.3%,青岛岩海碳材料有限公司。
高锰酸钾:湖南试剂厂;浓硫酸:四川陇西化工有限公司;过氧化氢:天津大茂化学试剂厂;重铬酸钾:国药试剂厂;硝酸钠:天津市恒兴化学试剂;盐酸:四川西陇科学有限公司;氯化钠:天津市巴斯夫化工公司;RB:上海试剂三厂;以上试剂均为分析纯。
红外光谱仪:TensorⅡ,德国Bruker公司,采用衰减全反射ATR方法;X射线衍射仪(XRD):6100,日本岛津,扫描速度2°/min,CuKα靶,λ=0.154 nm;紫外-可见分光光度计:Cary60,安捷伦科技有限公司,波长554 nm。
1.2 GO的合成
向装有92 mL浓H2SO4的三颈瓶中加入2 g石墨粉和1 g NaNO3,用冰水浴冷至t<5 ℃开始缓慢加入7 g高锰酸钾,再加入适量w(过氧化氢)=30%溶液,直至溶液变为亮黄色,依次用盐酸、蒸馏水直至pH值为中性,冷冻干燥得到GO。
1.3 RB溶液的制备
称取0.25 g RB,加入少量水溶解,移至250 mL容量瓶中,用蒸馏水稀释至刻度,摇匀,得到的RB溶液质量浓度为1.0 g/L;吸取上述1.0 g/L溶液5 mL于100 mL容量瓶中,用蒸馏水稀释至标线,摇匀,即可得到50 mg/L的RB标准溶液。
1.4 吸附实验
称取一定量的GO,加入到25 mL质量浓度为50 mg/L的RB溶液中,用1 mol/L的HCl或NaOH溶液调节pH值。吸附后的溶液置于离心管中,n=6 000 r/min离心14 min,取上清液测定溶液的吸光度A,按照RB的标准直线(A=0.2134ρ+0.0057)计算溶液中RB的质量浓度。去除率和吸附量分别按照式(1)和式(2)进行计算。
(1)
(2)
式中:R为去除率,%;ρ0和ρ为吸附溶液的起始质量浓度和平衡质量浓度,mg/L;q为吸附量,mg/g;V为吸附液的体积,L;m为吸附剂的质量,mg。
吸附实验完成后,回收GO,每次用去离子水浸泡24 h反复洗涤3次,冷冻干燥后重新进行吸附实验,测定其循环吸附效果。
2 结果与讨论
2.1 GO的表征
GO的红外谱图见图1。

σ/cm-1

GO的XRD谱图见图2。

2θ/(°)
由图2可知,2θ=9.82°出现一个强的衍射峰,对应于GO的(001)晶面,表明GO具有一定的晶体结构。根据Brag方程2dsinθ=nλ(n取1,λ=0.154 nm),可计算出此时的层间距为d=0.903 nm。
2.2 pH值对GO吸附RB的影响
m(GO)=4 mg、t=25 ℃吸附24 h,pH值对GO吸附RB性能的影响见图3。

pH
由图3可知,pH≤9,GO对RB表现出很强的吸附性,吸附量为300 mg/g;pH=10.9,吸附量明显下降,降至150 mg/g。这是因为GO表面羟基、羧基等官能团的存在使其带电负性,而RB为阳离子染料,GO对RB的吸附主要表现为电荷间的相互作用,在强碱条件下溶液中存在的大量OH-与GO竞争性结合RB,使得GO对RB的吸附量降低。因此,强碱环境不利于GO对RB的吸附。
2.3 m(GO)对GO吸附RB的影响
pH=5、t=25 ℃吸附24 h,m(GO)对吸附RB效果的影响见图4。

m(GO)/mg
由图4可知,去除率随m(GO)的增加而提高,但当达到最佳剂量水平时,去除率保持不变,这在其他吸附研究中也有类似的观察报道[20]。合理的解释是m(GO)的增加,提高了吸附位点的可用性,从而增加了对RB的去除,由于RB浓度和总量不变,其大部分已经被吸附,再增加m(GO)基本起不到吸附作用,因而去除率逐渐趋于平缓。吸附量随着m(GO)的增加而下降。原因在于,在较高的质量下,大量的吸附剂堆积在一起不能与染料充分接触,使得较少的活性吸附位点被使用,导致吸附离子与吸附剂质量的比率降低,从而降低GO对RB的吸附能力[21]。综合考虑去除率和吸附量,选择m(GO)=3 mg。
2.4 动力学模型
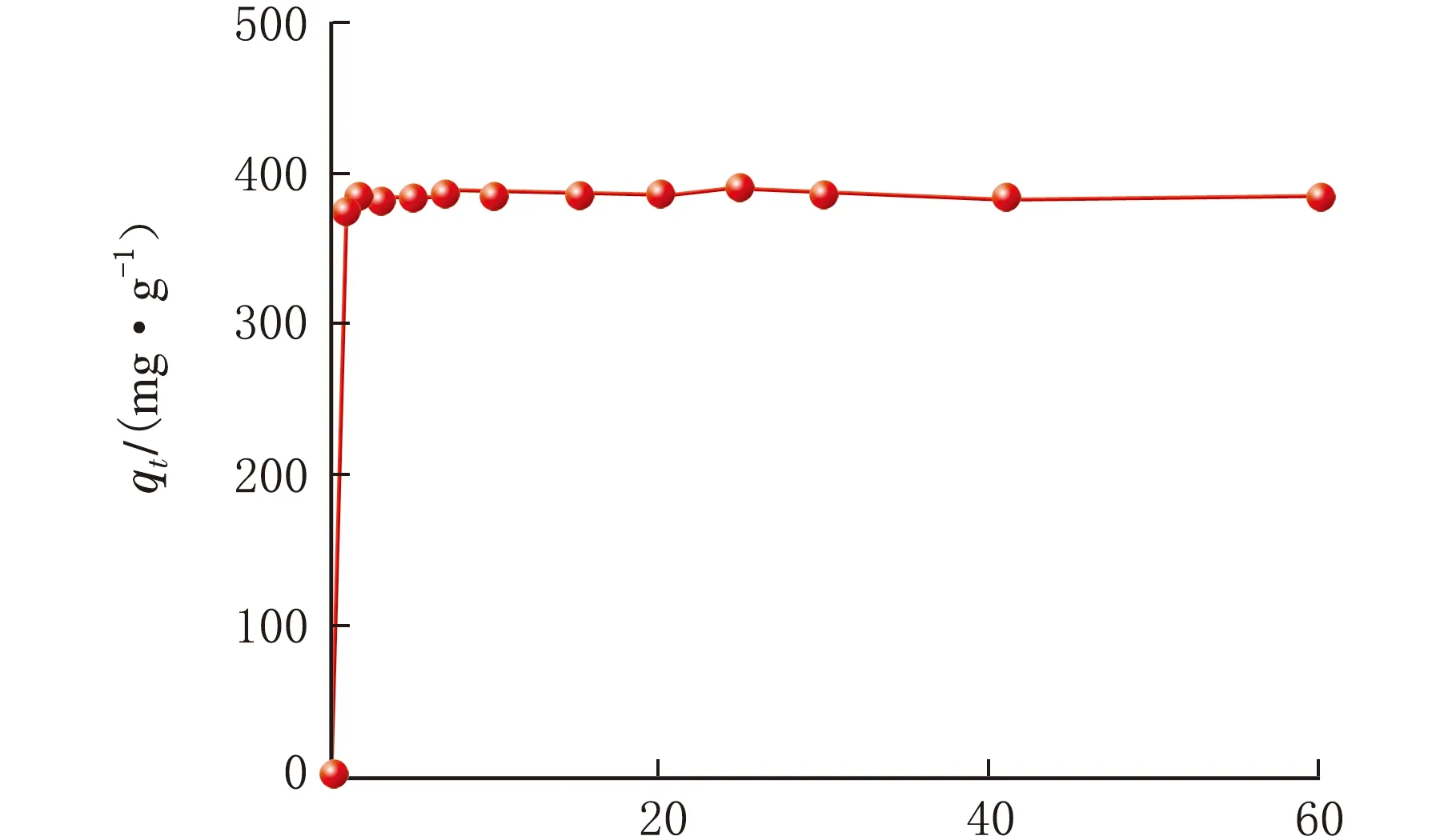
m(GO)=3 mg,吸附时间对吸附RB染液的影响曲线见图5。
t/min
由图5可知,初始阶段,GO对RB的吸附速度很快,t=7 min,吸附量就基本保持不变,达到吸附平衡,吸附量为385.38 mg/g。为了进一步了解速率控制步骤的机理,分别采用准一级(见式3)和准二级(见式4)吸附动力学模型对GO吸附RB染液的实验数据进行分析。
ln(qe-qt)=lnqe-k1t
(3)
(4)
式中:k1和k2分别为一级和二级反应动力学速率常数,min-1;qe和qt分别为平衡和时间t时的吸附量,mg/g。
GO对RB吸附动力学模型拟合的结果见表1。

表1 GO对RB吸附动力学模型拟合的结果
由表1可知,二级动力学模型拟合效果比一级动力学模型更佳,说明GO对RB的吸附符合二级动力学方程,而二级动力学方程是基于假定吸附速率受化学吸附机理的控制,这种化学吸附涉及到吸附剂与吸附质之间的电子共用或电子转移[12]。分析GO对RB的吸附过程,RB阳离子受到电荷间的相互作用,扩散在GO表面,与其中的—COO-等阴离子相结合,随着GO的分离而从溶液中被除去。因此,GO对RB的吸附速率主要受电化学吸附所控制。
为进一步探究GO对RB吸附过程中的速率限制步骤,采用韦伯-莫里斯内扩散模型(见式5)分析RB去除时在GO上的扩散过程,其结果见表1。内扩散模型拟合曲线的线性关系较差,表明GO对RB的吸附过程中涉及复杂的吸附机理,颗粒内扩散不是唯一的速率控制步骤[1]。通常认为吸附质(RB)在固体吸附剂(GO)表面的吸附过程如下。(1)RB分散到GO的外表面;(2)RB通过孔扩散从外表面进入内部多孔结构的表面;(3)RB在内部孔表面被GO吸附[22]。
qt=kidt0.5+C
(5)
式中:kid为颗粒内扩散速率常数,mg/(g·min1/2);t为时间,min;C为截距。
2.5 吸附等温线
为了评价达到平衡时,RB分子在液相和固相的分布状态,采用Langmuir(见式6)和Freundlich(见式7)等温线模型分析GO对RB染料的实验数据。
(6)
(7)
式中:ρe为染料溶液的平衡质量浓度,mg/L;qe和qm分别为平衡时的吸附量和单层饱和吸附量,mg/g;kL为Langmuir常数,L/mg;KF为Freundlich常数。
Langmuir等温模型假设在有限的局域位点上发生均匀的、单层的分子吸附,其基本特征可以用无量纲的平衡参数RL(见式8)来表示。
(8)
式中:ρm为染料溶液的初始质量浓度,mg/L。
若0
经Langmuir和Freundlich等温线模型拟合见图6,得到的拟合参数见表2。

ρe/(mg·L-1)

表2 Langmuir和Freundlich等温线模型拟合得到的参数
由图6、表2可知,采用Langmuir和Freundlich模型都能较好拟合GO对RB的吸附平衡。采用Freundlich模型得到的1/n为0.468 1,小于1,表明GO对RB的吸附符合正常的Langmuir模型。通过对比可知,Langmuir模型拟合的更好,得到的相关系数R2为0.999 8,大于Freundlich模型的相关系数R2(0.979 5)。此外,采用式(8)计算得到的平衡参数RL为0.029,表明吸附为有利吸附。因此,GO对RB的吸附更符合Langmuir模型,且RB在GO表面主要呈均匀的单分子层吸附。
2.6 离子强度对GO吸附RB的影响
离子强度对GO吸附RB性能的影响见图7。

c(NaCl)/(mol·L-1)
由图7可知,GO对RB的吸附随离子强度的增加而降低,c(NaCl)=0.2 mol/L,吸附量从384.4 mg/g降至322 mg/g。离子强度的增加使GO与RB离子间的相互作用力减弱,RB离子的活度系数降低,阻碍了RB阳离子从溶液扩散到GO表面。离子强度的增加使电解质离子Na+与RB离子产生离子交换竞争,吸附量降低。
2.7 共存离子对GO吸附RB的影响
共存离子对GO吸附RB的影响见图8。

ρ[Cr(Ⅵ)]/(mg·L-1)
由图8可知,Cr(Ⅵ)离子的存在会降低GO对RB的吸附量,ρ[Cr(Ⅵ)]=10 mg/L,吸附量从384.4 mg/g降至340.7 mg/g,降低了11.37%。Cr(Ⅵ)的存在使得溶液中离子浓度增加导致吸附过程中扩散阻碍,使RB吸附量降低,且Cr(Ⅵ)浓度增加,该影响越明显。
2.8 循环性能测试
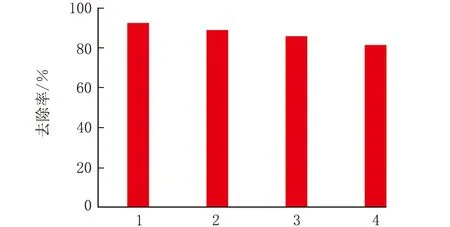
GO吸附RB的循环性能测试结果见图9。
吸附次数
由图9可知,GO经4次循环吸附后,其对RB的去除率分别为92.5%、89.1%、85.7%、81.4%,重复利用率达88%,表明GO是去除有机染料的理想吸附剂,具有良好的循环使用性能。
3 结 论
(1)红外和XRD结果显示,GO中含有大量的—OH、—COOH、C—O等含氧基团,且为晶体结构;
(2)pH≤9,GO对RB有很强的吸附性。在t=25 ℃、25 mL 50 mg/L的RB废液中最佳用量为m(GO)=3 mg,吸附7 min即可达到吸附平衡,此时吸附量为385.38 mg/g;
(3)GO对RB的吸附符合准二级动力学模型和Langmuir吸附等温线。离子强度和共存离子Cr(Ⅵ)会抑制RO对RB的吸附,且离子浓度越高,该影响越明显;
(4)经4次循环使用后,GO对RB的重复利用率达88%,是去除有机染料的理想吸附剂。

