苦笋总黄酮提取工艺优化及其体外抗炎抗氧化活性研究
晏俊玲,樊 扬,秦 川,欧 雪,周 芮,谢 玮,陈姝娟,敖晓琳
(四川农业大学食品学院,四川 雅安 625014)
苦笋,别称凉笋,禾本科苦竹(Pleioblastus ama⁃rus)的嫩芽,在我国分布广泛,资源丰富,是一种传统绿色蔬菜食品[1]。苦笋中富含多种生物活性物质,主要包括黄酮类、生物碱和挥发油类等,具有抗炎抗氧化、抑菌抗肿瘤、增强免疫调节活性、抑制酪氨酸酶和α-淀粉酶活性等功能[2-4]。目前,人们对于苦笋的研究主要集中于初加工,而对于苦笋资源的精细加工及利用鲜有报道,而黄酮作为植物中重要的次级代谢产物,具有多种功能活性,如抗氧化、抗肿瘤、抗病毒及抗细菌感染以及提高机体免疫力等功能[5],具有较高的研究价值。天然植物中黄酮类化合物的提取方法包括酶法辅助、微波辅助、超声波辅助和回流提取法等。其中超声波辅助提取法具有耗时短、提取率高等优点,应用广泛。杜丽霞等[6]采用超声辅助提取调味香料排草中总黄酮,其得率可达到3.16%。但目前关于超声波辅助提取苦笋总黄酮的工艺研究还未见报道。另外不同种类的总黄酮提取物,因黄酮含量和组分的差异,其活性也不同。要进一步对苦笋总黄酮进行开发利用,苦笋总黄酮提取物的活性研究显得尤为重要。但目前有关苦笋总黄酮提取物活性的研究也还未见报道。因此本研究以苦笋作为试验原料,采用超声波辅助提取法,优化提取工艺,并探讨其抗炎抗氧化活性,为苦笋资源的综合开发应用提供理论数据参考。
1 材料和方法
1.1 材料与试剂
苦笋采自四川省雅安市,新鲜苦笋干燥粉碎后过60目筛;芦丁标准品(纯度≥98%)购自北京世纪奥科生物科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH);ABTS溶液;氢氧化钠;无水乙醇;亚硝酸钠等均为国产分析纯,购自成都市科隆化学品有限公司。
1.2 仪器与设备
Varioskan LUX酶标仪,赛默飞世尔科技有限公司;S28L超声波清洗器,东莞市墨洁超声波设备有限公司;FA2004B电子天平,上海精天电子仪器有限公司。
1.3 苦笋总黄酮提取方法的选择
水提取法条件:苦笋粉20 g,料液比1∶30 g/mL,提取时间30 min,提取温度40℃;
乙醇提取法条件:苦笋粉20g,料液比1∶30g/mL,提取时间30 min,提取温度40℃,体积分数80%乙醇作为提取剂;
乙醇超声提取条件:苦笋粉20 g,料液比1∶30 g/mL,超声时间30 min,提取温度40℃,超声功率300 W,提取剂为体积分数80%乙醇。
分别按照上述方法提取两次,过滤后合并两次滤液定容至一定体积,即得到不同提取方法的苦笋总黄酮样液,待测其提取率,重复3次。经试验选取超声辅助提取作为后续提取方法。
1.4 标准曲线的制作及总黄酮含量测定
参照吴昊等[7]的方法并稍作修改。精确称取芦丁标准品20.00 mg于20 mL的容量瓶中,并用体积分数60%的乙醇溶解,得到1 mg/mL的芦丁溶液。准确移去芦丁溶液0、1、2、3、4和5 mL于10 mL容量瓶中,定容揺匀静置15 min后在510 nm处测定吸光度,以芦丁浓度(mg/mL)为横坐标,吸光度值(y)为纵坐标绘制标准曲线:y=4.845 2x-0.003 3,R2=0.999 8,根据标准曲线计算出总黄酮浓度。以乙醇作为空白,按公式(1)计算苦笋中总黄酮提取率。

1.5 提取工艺优化
1.5.1 单因素实验
按一定料液比称取苦笋粉末,与乙醇溶液混合后置于超声波清洗器中以一定功率提取一定时间后过滤备用,按照1.4测定其总黄酮提取率。设定料液比(质量体积比g/mL)为1∶15、1∶20、1∶25、1∶30、1∶35和1∶40,超声时间10、20、30、40、50和60 min,乙醇体积分数40%、50%、60%、70%、80%和90%,超声温度30、40、50、60、70和80℃,超声波功率50、100、150、200、250和300 W,提取溶液pH值为2、4、6、8和10。每改变一个因素水平,其他因素固定不变。
1.5.2 响应面试验设计
基于单因素实验,固定溶液pH值为6.0、超声功率200 W,以料液比(A)、乙醇体积分数(B)、提取时间(C)、提取温度(D)为考察因素,总黄酮含量为试验的响应值Y,进行响应面试验,利用Design Expert 8.0.6软件优化提取工艺,确定苦笋中总黄酮最优提取工艺条件,试验设计因素见表1。
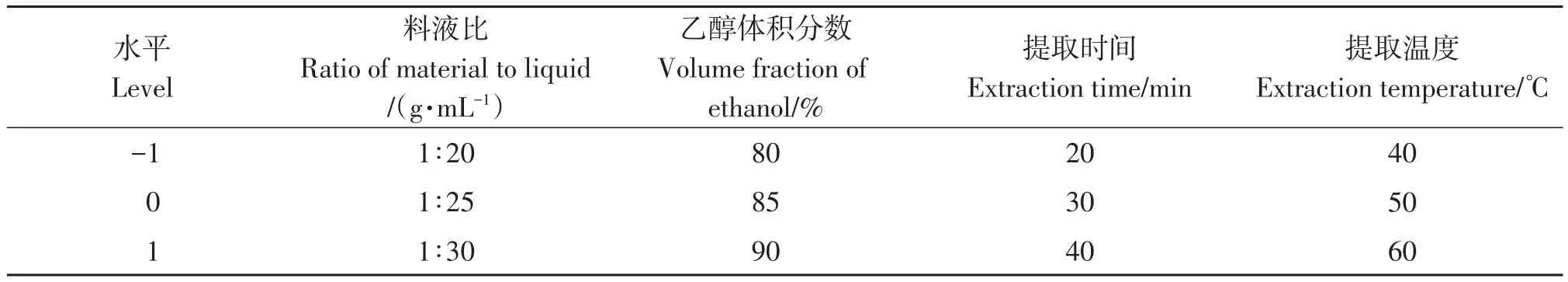
表1 响应面实验设计Table 1 Response surface experimental design
1.6 苦笋总黄酮体外抗氧化
1.6.1 FRAP试验测定苦笋总黄酮抗氧化能力
参照Du B.等[8]的方法,并稍作修改。将醋酸缓冲 液(pH=3.6,300 mmol/L)、FeCl3(20 mmol/L)、TPTZ(10 mmol/L)按体积比例 10∶1∶1混合配制FRAP工作液。取不同浓度(0.1~0.5 mg/mL)的总黄酮提取液80 μL,加入FRAP 120 μL后混匀,置于37℃水浴锅中30 min,于593 nm下测定吸光值,抗坏血酸为阳性对照,蒸馏水为空白,0.5~5 mmol/L硫酸亚铁为标准,建立了不同硫酸亚铁浓度的标准曲线。标准曲线为y=0.080 2x-0.495 7,R2=0.999 3。样品的抗氧化活性以亚铁当量(FRAP,mmol/L)表示。
1.6.2 苦笋总黄酮对DPPH自由基清除能力的测定
参照高喜霞等[9-10]的方法。取不同浓度的苦笋总 黄 酮 提 取 液 90 μL(0.1~0.5 mg/mL),加 入0.4 mmoL/L DPPH溶液110 μL,混匀,于室温下避光反应30 min,在517 nm处测定吸光度,记为A1。其他条件和操作不变,用乙醇溶液代替苦笋总黄酮提取液测得的吸光值记为A2。按照公式(3)计算清除率。以样品浓度为自变量,自由基清除率为因变量作图并进行线性拟合,计算IC50值,IC50(半抑制浓度)为自由基清除率为50%时,所需抗氧化物质的质量浓度,其值越小,表明清除自由基的能力越强,抗氧化能力越强[11]。

1.6.3 苦笋总黄酮对羟基自由基清除能力的测定
采用张静祎等[12]方法并稍作修改。分别吸取0.5 mL 8 mmol/L水杨酸-乙醇溶液、0.5 mL 8 mmol/L硫酸亚铁、不同浓度(0.1~0.5 mg/mL)的苦笋总黄酮提物液1 mL充分混匀均匀,加入0.5mL 30% H2O2溶液充分反应,混匀后静置10 min后,在510 nm处测定吸光度为A1;1 mL蒸馏水取代样品,测定其吸光度A0;0.5 mL蒸馏水取代FeSO4溶液,测定其吸光度A2。不同质量浓度的VC(0.1~0.5 mg/mL)作阳性对照。按公式(4)计算清除率,并计算IC50值。
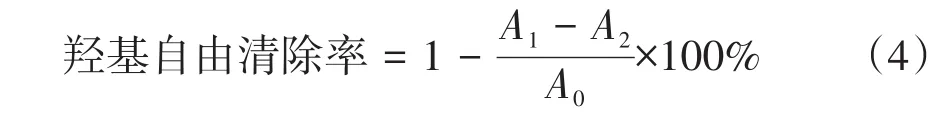
1.6.4 苦笋总黄酮对ABTS+自由基清除能力的测定
2.45mmol/L过硫酸钾溶液与7 mmol/L ABTS溶液,按1∶1比例混合,室温避光静置反应16 h,无水乙醇稀释ABTS储备液使其在734 nm处的吸光值为0.7±0.05,作为ABTS工作液。取1 mL样品和6 mL ABTS工作溶液,室温条件下充分混合反应6 min,于734 nm波长下测吸光度,记为A1。1 mL蒸馏水代替样品溶液测得的吸光值为A0,6 mL蒸馏水代替ABTS工作液,其吸光值记为A2。VC作阳性对照。按公式(5)计算清除率,并计算IC50值。
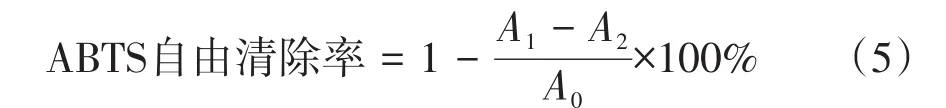
1.7 苦竹笋总黄酮体外抗炎
10%胎牛血清和1%青霉素链霉素的培养基,在适宜湿度,温度为37℃,体积分数5% CO2的条件下培养RAW264.7细胞。采用Griess法[13]检测苦笋总黄酮提取物对RAW264.7细胞产生NO的抑制作用,将1×104个/孔RAW264.7细胞接种于细胞96孔板中,每孔体积为100 μL,接种孔周围加入新鲜培养基用来排除边缘效应,待细胞贴壁后弃去多余培养基,并进行药物处理。试验分为:空白对照组(不含有LPS和样品);模型组(LPS组,含有0.5 μg/mL LPS);试验组(总黄酮浓度分别为0.20、0.40、0.60、0.80、1.00和1.20 mg/mL)。分别预处理2 h后,模型组和试验组中加入0.5 μg/mL LPS 0.5 μL处理18 h,再吸取50 μL细胞培养上清液,依次加入恢复室温后的 Griess ResgentⅠ50 μL 和 Griess ResgentⅡ50 μL,充分反应后于550 nm处检测吸光度。按照公式(6)计算NO产生抑制率。

1.8 数据分析
采用SPSS 18.0软件对试验数据进行处理,Origin 8.5制图,所以实验均平行进行3次,结果以均值±标准差表示。
2 结果与分析
2.1 苦笋总黄酮提取方法的选择
按照1.3的试验方法,分别测得3种提取方式的总黄酮提取率,其结果见表2。

表2 不同提取方法的苦笋总黄酮提取率Table2 The extraction rate of total flavonoids from the shoots of pleioblastus amarus by different extraction methods
从表2可以看出,以总黄酮提取率为考察指标,乙醇超声提取法较水提取法和乙醇提取法提取效果更佳,故本试验采用乙醇超声辅助提取法,并对提取时间、乙醇体积分数、提取时间以及提取温度等因素进一步考察。
2.2 单因素实验结果
2.2.1 料液比对苦笋总黄酮提取率的影响
从图1-A可以看出,料液比在1∶25 g/mL时黄酮提取率达到最大,在1∶15到1∶25 g/mL时呈现上升趋势,苦笋总黄酮提取率随溶剂体积的增加而增大,可能是因溶剂用量太少,提取不完全;超过1∶25 g/mL时,总黄酮提取率反而降低,可能是由于溶剂用量过大,超声波加热的负荷增大,达到提取完全的时间随之增加,结果在限定时间内苦笋总黄酮提取率反而下降[14]。因此选择最佳料液比为1∶25 g/mL。
2.2.2 超声时间对苦笋总黄酮提取率的影响
由图1-B可知,最佳超声时间为30 min,此时总黄酮提取率最高,可达到9.50%左右,当超声时间进一步延长时,总黄酮提取率反而呈现下降趋势,这可能是因为超声处理可以显著增强苦笋粉内部的分子震动碰撞,加速与提取剂之间的物质交换,当物质交换作用达到平衡时,总黄酮含量趋于稳定,随着提取时间的进一步延长其他醇溶性物质增多,黄酮的稳定性也可能受到破坏,所以导致总黄酮提取率降低[15]。因此综合考虑提取成本和提取量,选择30 min为最优提取时间。
2.2.3 提取温度对苦笋总黄酮提取率的影响
图1-C显示的是提取温度对总黄酮提取率的影响。结果表明,提取温度为60℃时提取率最高,在30~60℃时温度升高,提取率随之增大,可能是因为随着温度升高,分子运动加剧,增加溶解度[16]。超过60℃,随着温度的升高,苦笋中总黄酮提取率反而降低,且乙醇在高温下容易挥发,不易于乙醇的回收,另外,在高温条件下,黄酮类化合物的结构可能发生变化[17]。
2.2.4 乙醇体积分数对苦笋总黄酮提取率的影响
由图1-D可知,在乙醇体积分数为40%~80%时,乙醇体积分数不断增大,苦笋总黄酮的提取率也逐渐增大,但当乙醇体积分数大于80%时,苦笋中总黄酮的提取率降低,这与周伟等学者的研究结果相似[15]。可能是因为溶剂的极性随乙醇体积分数的增大而降低,不利于有极性的黄酮类化合物的溶出,从而造成总黄酮提取率下降。因此,体积分数80%乙醇为最佳提取剂。
2.2.5 提取溶液pH值对苦笋总黄酮提取率的影响
由图1-E可知,当提取溶液pH在2~4时,苦笋总黄酮提取率随pH升高而增大。但当pH大于6时,苦笋中总黄酮的提取率降低,在pH 6时,苦笋总黄酮的提取率最大。这可能是由于黄酮类化合物苯环结构中含有酚羟基,显弱酸性,因此在弱酸环境中比较稳定。因此选择pH=6为最佳提取液pH值。
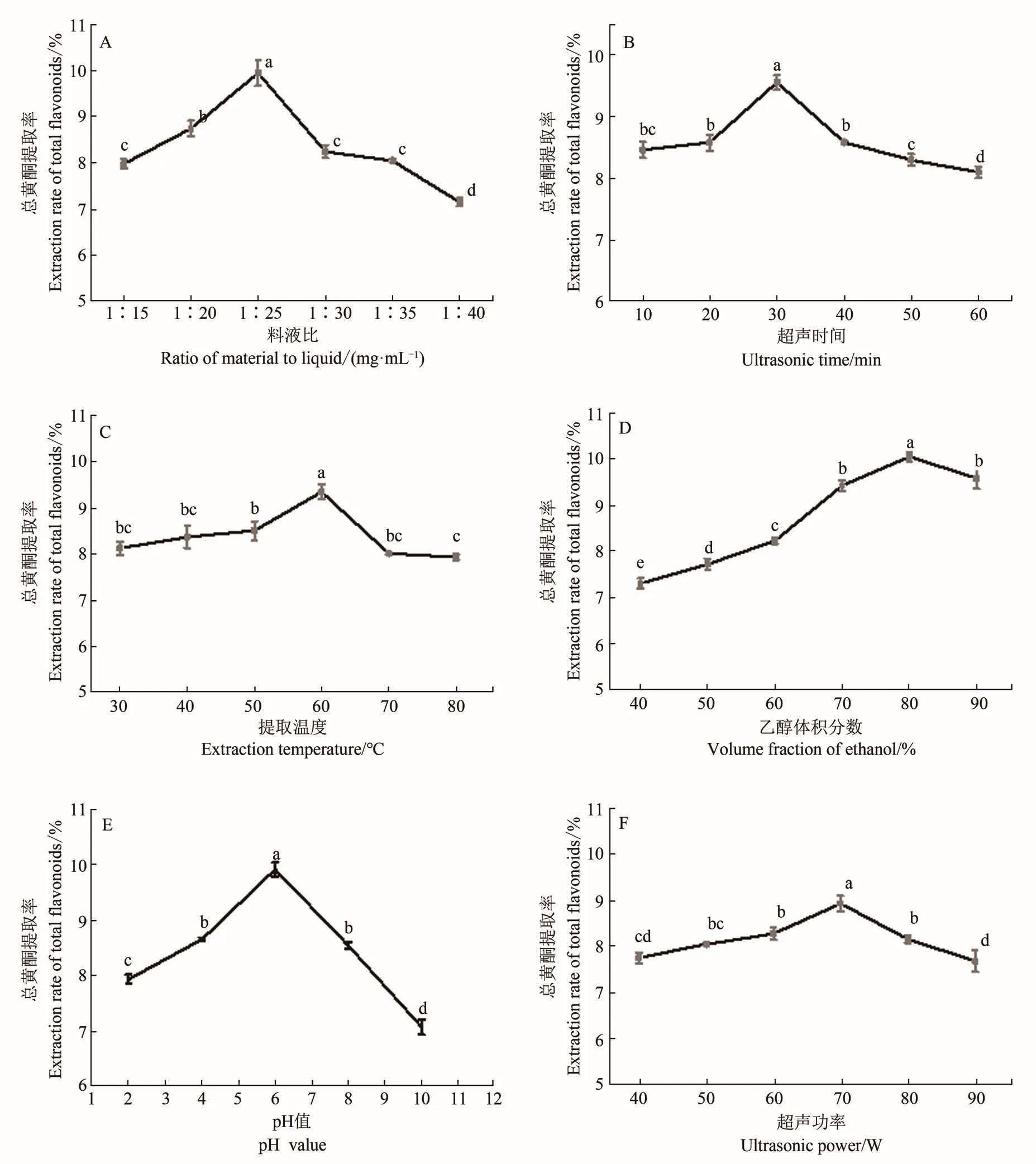
图1 液料比(A)、提取时间(B)、提取温度(C)、乙醇体积分数(D)、提取溶液pH值(E)和超声功率(F)对总黄酮提取率的影响Figure 1 Effects of liquid/solid ratio(A),extraction time(B),extraction temperature(C),ethanol concentration(D),pH value(E)and ultrasonic power(F)on total flavonoids yield
2.2.6 超声功率对苦笋总黄酮提取率的影响
苦笋总黄酮提取率随超声功率的增加而逐渐增加,200 W时黄酮含量达到最大,但超过200 W其总黄酮含量反而下降。这可能是由于超声对植物细胞有很好的破碎功能,并促进分子之间的热运动,随着功率的增加,加大苦笋细胞的破碎程度,加速苦笋粉与提取剂之间的运动,但是当超声功率过大时,又会造成总黄酮的分解或氧化,黄酮类物质稳定性降低,从而造成提取率下降[18]。因此最适的超声功率为200 W。
2.3 响应面模型拟合与方差分析
2.3.1 响应面试验
响应面试验方案与结果见表3。
对表3的数据作回归分析,得到回归拟合方程:Y=10.01+1.07A+0.41B+0.09C+0.30D+0.18AB-0.43AC-0.02AD-0.02BC-0.32BD+0.13CD-0.67A2-0.72B2-0.10C2-0.50D2,其试验响应面模型方差分析结果见表4。从表4看出,P<0.01,模型F值=7.55,表明该模型极显著;模型的相关系数R2=0.883 1,校正决定系R2Adj=0.766 2,二者较为接近,说明模型实际值与预测值拟合良好;本试验中建立的回归模型准确失拟项F=3.09(P>0.05),说明失拟项误差不显著,表明该回归模型的拟合情况较好,回归方程代表性较好,能准确预测实际情况,使用该方程代替真实的试验点进行分析是可行的[19]。方差分析表明,各因素对苦笋总黄酮提取率的影响为:A料液比>B乙醇体积分数>D提取温度>C提取时间。两两因素交互作用的主次顺序为:AC>BD>AB>CD>AD>BC。
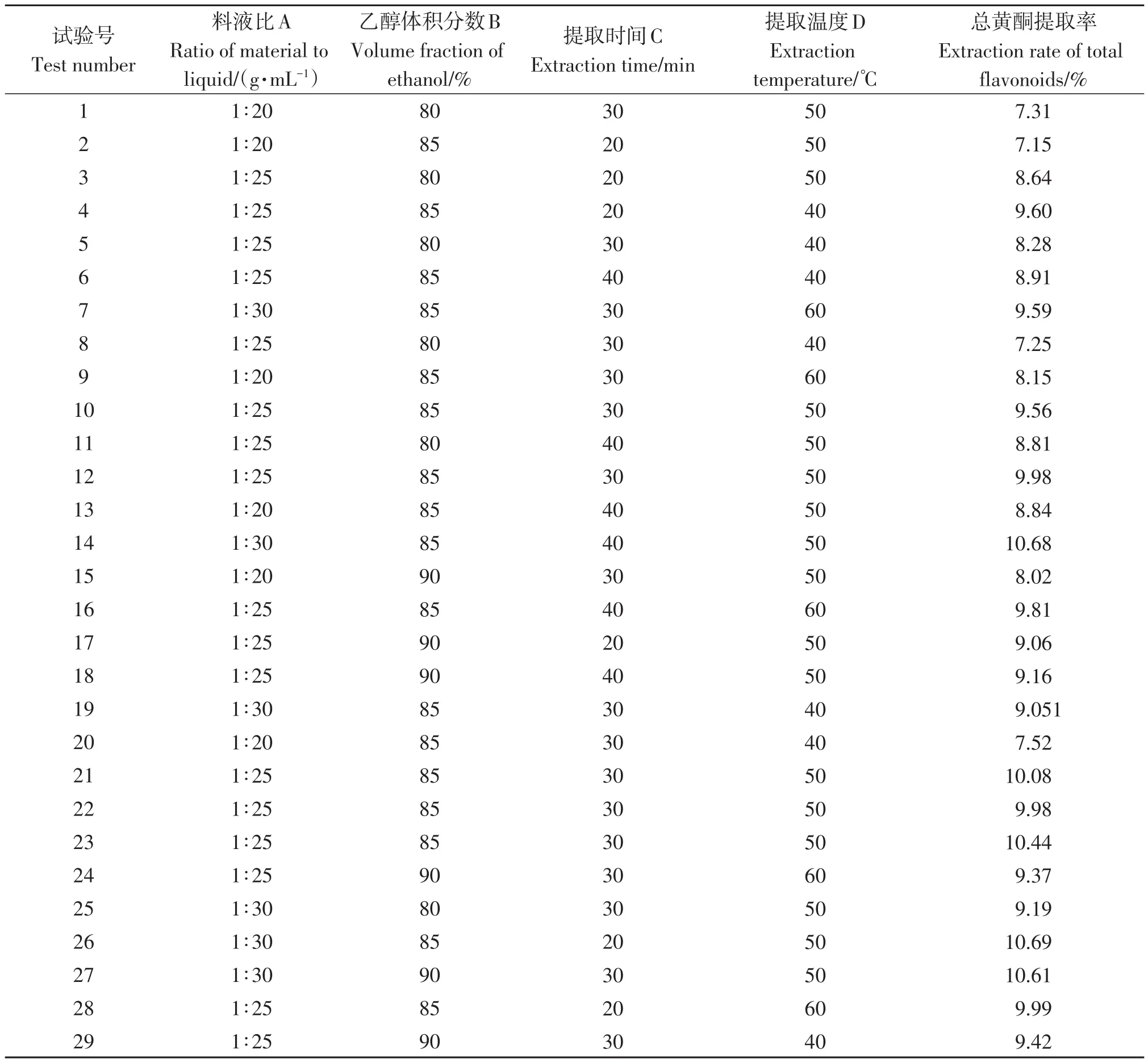
表3 Box-Behnken试验设计及结果Table 3 Response surface design arrangement and experimental result

表4 拟合二次多项式模型的方差分析Table 4 ANOVA for the fitted quadratic polynomialmodel
Design-Expert软件进行数据处理,料液比、提取时间、提取温度和乙醇体积分数两两因素之间对于苦笋总黄酮提取率的3D图见图2A-F。在两因素交互作用3D图中,图形的坡度越陡,表明响应指标对响应因素的变化越敏感[19]。比较6组三维曲面响应图可知,料液比(A)与乙醇体积分数(B)、乙醇体积分数(B)与提取温度(D)、提取料液比(A)与提取时间(C)、提取料液比(A)与提取温度(D)的响应曲面图呈现开口向下的陡峭凸曲面,表明各交互因素的响应面存在最高点,极值存在于所选的范围之间,各因素考察范围较为适当;响应面为一个卷曲的曲面,说明因素与响应值之间不能以简单的一元线性方程加以阐述,故上述回归方程能够全面地阐明料液比、提取时间、提取温度和乙醇体积分数与总黄酮提取率之间的关系[20]。Design-Expert软件系统给出最佳参考工艺为:料液比1∶29.85 g/mL,提取温度51.14℃,提取时间23.11 min,乙醇体积分数86.96%。在此条件下预测的苦笋总黄酮提取率为10.72%。
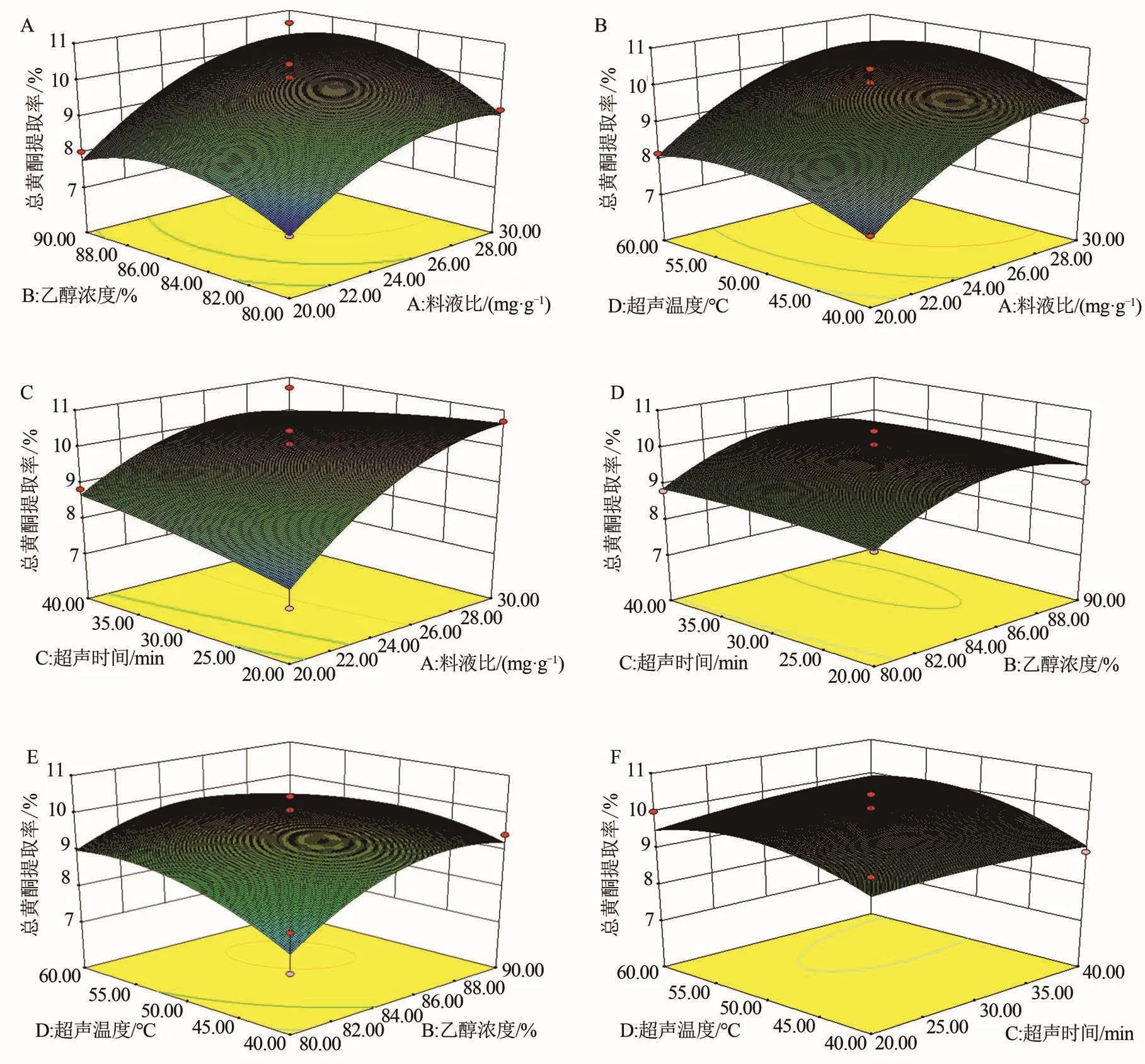
图2 两两交互对总黄酮提取率的响应面图Figure 2 Response surface diagram of pairwise interaction on total flavonoids yield
2.3.2 验证试验
为检验模型预测的准确性,采用上述最佳条件进行3次平行试验,考虑到实际操作便捷,将提取工艺条件调整为料液比1∶30 g/mL、提取温度51℃、提取时间23 min、提取液pH值为6、超声功率200 W、乙醇体积分数87%,在此条件下进行验证试验,得到苦笋总黄酮提取率为10.61%,ASD为0.45%,与预测结果较为接近,该模型拟合效果较好,此法是有效可行的。
2.4 苦笋总黄酮体外抗氧化活性研究
抗氧化活性的测定取决于反应机理,需结合多种测试方法才能准确评估样品的抗氧化能力[22]。在本研究中,采用FRAP还原铁能力,清除DPPH自由基、羟基自由基和ABTS自由基的方法进行抗氧化活性测定。
2.4.1 FRAP还原铁能力测定
还原能力是衡量抗氧化能力的重要指标,两者之间成正相关[21-22]。因此,可通过测定苦笋总黄酮的还原能力来评价其抗氧化活性。不同浓度苦笋总黄酮提取物的还原力如图3-A所示。由图可知,样品浓度增加,其FRAP值均有提高。在同等浓度下,苦笋总黄酮提取液的还原能力与VC相比,相差不大。从整体来看,苦笋总黄酮具有较强的还原能力,当其浓度为0.5 mg/mL时,FRAP值达3.04 mmol/L。
2.4.2 清除DPPH自由基能力的测定
DPPH清除率与抗氧化能力呈正相关。由图3-B可知,总黄酮浓度越大,其清除能力越强,与VC的差距也逐渐缩小,总黄酮浓度为0.5 mg/mL时,DPPH清除率达到88.73%。与蔓三七叶黄酮相比[23],苦笋总黄酮对DPPH的清除率较强。苦笋总黄酮和VC的IC50分别为0.07、0.04 mg/mL,而IC50值越小,其抗氧化能力越强[24]。由此可知,苦笋总黄酮提取物具有较好清除DPPH自由基的能力。
2.4.3 清除羟基自由基能力的测定
Fe2+与H2O2反应可生成羟基自由基,羟基自由基进攻较高电子云密度的乙烯基基团使结晶紫发生褪色,而抗氧化剂的加入能够清除羟基自由基,从而达到提高清除率的效果[12]。由图3-C可知,清除羟基自由基的能力随样品浓度的增大而增强,VC清除羟基自由基的能力稍强于苦笋总黄酮提取液,苦笋总黄酮浓度达到0.5 mg/mL时,其清除率可达到60.22%。VC和苦笋总黄酮对羟基自由基清除率的IC50分别为0.23、0.39 mg/mL,两者相差不大。可见苦笋总黄酮有一定清除羟基自由基的能力。
2.4.4 清除ABTS自由基能力的测定
VC和苦笋总黄酮对ABTS自由基清除能力结果见图3-D。由图可知,在一定范围内,随着浓度的增加苦笋总黄酮样品和VC样品对ABTS自由基清除率均逐渐增强,说明浓度对ABTS自由基的清除能力存在着一定的量效关系,苦笋总黄酮浓度达到0.5 mg/mL时,其清除率可达到72.38%,其IC50值为0.27 mg/mL,可见苦笋总黄酮有一定的ABTS自由基抑制能力。
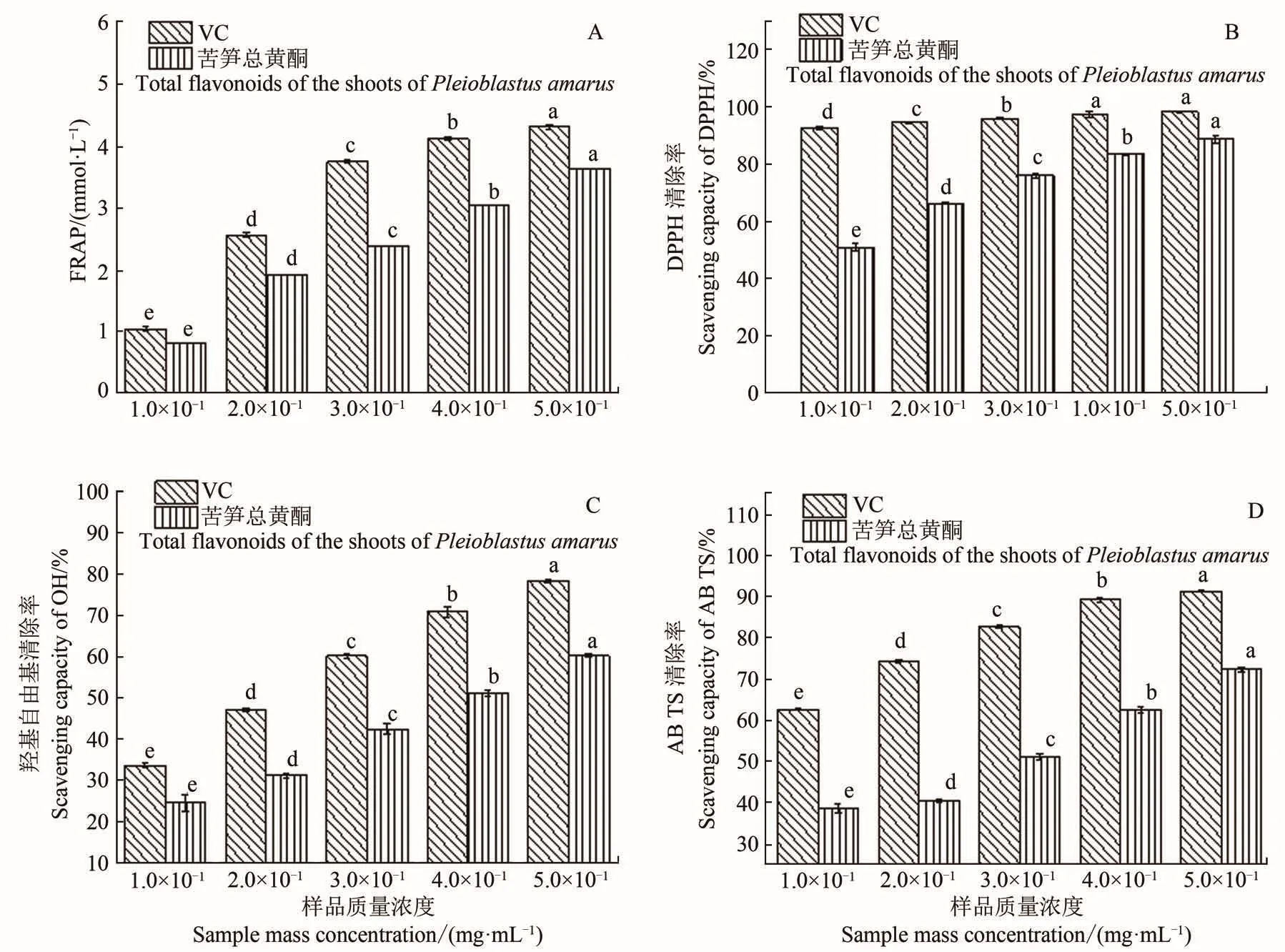
图3 苦笋总黄酮提取物的抗氧化活性Figure 3 Antioxidant of flavonoid from the shoots of Pleioblastus amarus
2.5 苦笋总黄酮体外抗炎活性研究
NO参与多种炎症信号转导,与多种炎症因子相互作用,在炎症反应进程每一阶段都有产生,NO的过量产生与炎症密切相关,而抑制NO生成则是抗炎活性的直接指标[25]。苦笋总黄酮样品的NO产生抑制率结果如图4所示。由图可知,NO抑制率随着苦笋总黄酮浓度的升高而增大,当苦笋总黄酮浓度为1.20 mg/mL时,NO产生抑制率可达到93.94%,说明在此浓度下苦笋总黄酮提取液可较好地抑制LPS诱导小鼠腹腔巨噬细胞中NO的产生,同时可推测苦笋总黄酮提取物的抗炎活性,与其黄酮类化合物密切相关,苦笋中黄酮类物质也可能为良好的抗炎活性提高一定的辅助作用。
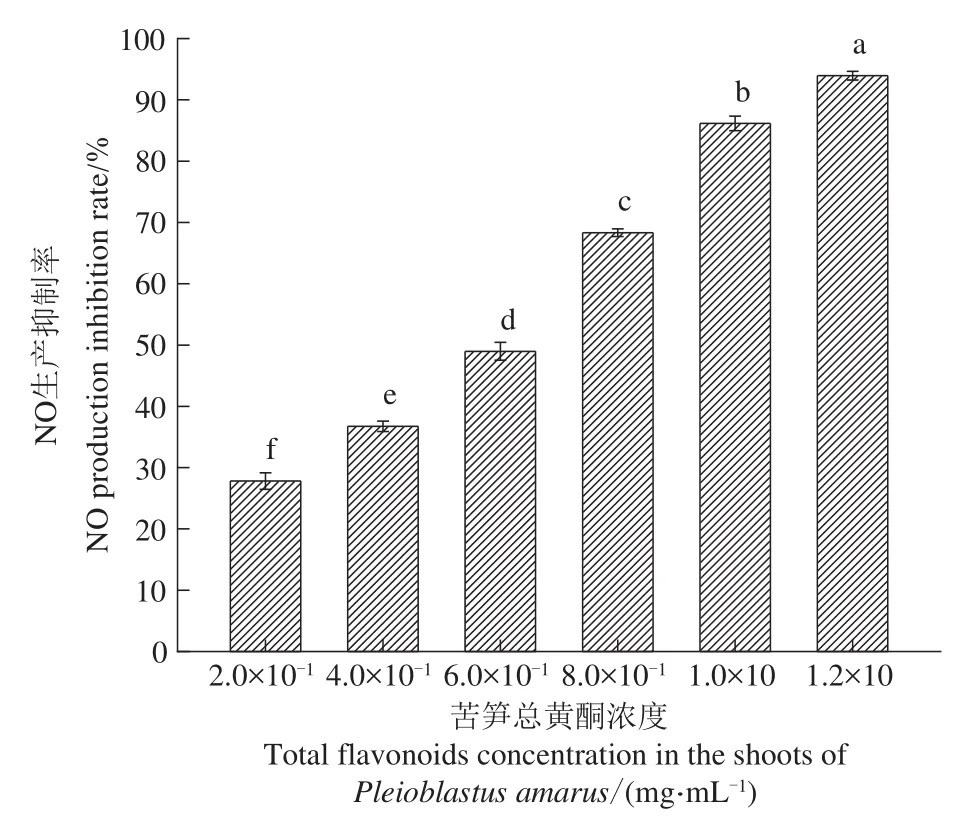
图4 苦笋总黄酮对LPS诱导的小鼠巨噬细胞NO生成量的影响Figure 4 Effect of total flavone on NO production in LPS-induced mouse macrophages
3 结论
本试验采用超声波辅助提取苦笋总黄酮的方法,在单因素实验的基础上运用Box-Behenken试验设计,得到苦笋总黄酮的最佳提取工艺条件为:料液比1∶30(g/mL),提取温度51 ℃,提取时间23 min,乙醇体积分数87%,在此条件下进行验证试验,得到苦笋总黄酮提取率为10.61%,ASD为0.45%。另外苦笋总黄酮显示出良好的抗氧化活性及抗炎活性,当苦笋总黄酮浓度为0.5 mg/mL时,FRAP值达到3.04 mmol/L,对DPPH自由基、羟基自由基、ABTS自由基的清除率分别为88.73%、60.22%和72.38%,其IC50值分别为0.07、0.39和0.23 mg/mL;苦笋总黄酮浓度为1.20 mg/mL时,NO产生抑制率可达到93.94%。该试验结果表明,苦笋总黄酮的提取工艺有效可靠,并且苦笋总黄酮提取物具有较强的体外抗氧化活性和抗炎活性,具有较好的现实意义和开发利用价值。本试验结果将为苦笋资源的深度开发利用提供理论参考。
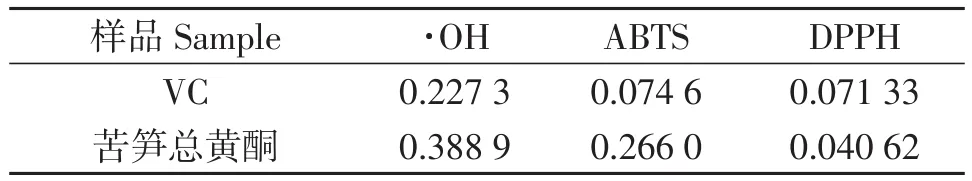
表5 ABTS、·OH、DPPH自由基抗氧化试验的IC50值Table 5 IC50value of the ABTS,·OH and DPPH assay mg·mL-1

