柚AP2/ERF转录因子的鉴定及其在柚采后表达分析
彭玉娇 ,宋芳菲 ,李美欣 ,邵元元 ,崔学宇 *,胡 林 ,谭梦超 ,阮红燕 ,区燕丽
(1.南宁师范大学广西地标作物大数据工程技术研究中心,南宁 530001;2.南宁师范大学北部湾环境演变与资源利用教育部重点实验室,南宁 530001;3.南宁师范大学广西地表过程与智能模拟重点实验室,南宁 530001;4.容县土肥植保经作站,广西 容县 537500)
沙田柚(Citrus maxima(Burm.)Merr.cv.Shatian Yu.)是一种重要的柚类品种[1-2],具有果实硕大、风味清香、采后耐存储(采后可存储4~6个月)的特点[3-5],被誉为“天然的水果罐头”[6]。沙田柚采后随着保存时间的延长,品质发生了变化,对4℃和室温保存的沙田柚研究发现,存储40 d后,沙田柚可溶性固形物含量均显著增加,对沙田柚果实采后柠檬酸的研究发现,采后75 d内柠檬酸含量均高于刚采摘时,苹果酸含量则先增加后降低[7-9],但引起其发生变化的机制仍不清晰。AP2/ERF类转录因子(Apetala2/Ethylene response factor)含有保守的ERF结构域,该类转录因子可以参与到果实品质的调控[10]。枇杷中的研究表明,EjAP2-1基因[11]可以减轻冷害对采后枇杷的木质化作用;黄瓜中的研究表明,CsERF025基因通过影响乙烯的生物合成,影响了黄瓜的果实的弯曲[12];番茄中的研究表明,AP2a类转录因子可以影响该果实的性状以及类胡萝卜素的积累[13];香蕉中研究发现,MaERF9是一种转录激活因子,可以参与到香蕉香气的形成过程[14];猕猴桃中的研究发现,ERF转录因子参与到果实的成熟过程中[15]。果实中的研究均表明AP2/ERF类转录因子影响了其采后的品质,是关键的作用因子之一,但该类转录因子在沙田柚果实中如何影响采后品质依然未知。本研究首先对采后沙田柚的糖、酸等生理指标进行了测定,而后利用生物信息学的方法鉴定AP2/ERF类转录因子家族成员,同时利用转录组测序和实时定量PCR的方法,对沙田柚采后AP2/ERF基因的表达动态进行分析,为研究柚采后品质变化可能的发生机制奠定基础。
1 材料和方法
1.1 柚AP2/ERF转录因子生物信息分析
利用转录因子数据库(plntfdb,PlantTFDB)下载已知的拟南芥和水稻AP2/ERF序列,作为探针序列进行Blast搜索候选基因,分别在网站https://www.citrusgenomedb.org、http://citrus.hzau.edu.cn/orange/、http://citrus.hzau.edu.cn/orange/和 http://citrus.hzau.edu.cn/orange/中下载甜橙(Citrus sinensis)、橘子(Cit⁃rus reticulata)、香橼(Citrus medica)和柚(Citrus maxima)的基因组序列。
统计利用PFAM数据库下载AP2 domain(PF00847),分 别 使 用 blastp(evalue 1e-3)和hmmsearch(默认参数)扫描4个Citrus物种全部候选基因,并将候选基因合并,利用CDD和SMART在线服务对候选基因进行验证,将无对应mootif的序列排除,得到最终目标序列。
利用mafft v.7.427默认参数对AP2/ERF基因氨基酸序列进行多序列对比;使用ProtTest v.3.4.2选择ML进化树最佳进化模型,最终JTT+I+G+F被选为最佳进化模型,用于后续进化树构建;使用RAxML v.8.2.12软件构建序列最大似然法进化树;进化树可视化使用在线工具iTOL完成。基因染色体分布、基因结构信息来源于基因组测序注释GTF文件,蛋白序列motif分布来源于SMART数据库。
1.2 沙田柚采后AP2/ERF基因家族的表达分析
2019年11月沙田柚成熟后取样,取样地点为广西容县“五一柚场”,而后利用容县沙田柚分拣中心筛选机对其进行初步筛选,取等重(1 kg)、可溶性固形物达到12%的沙田柚12个,分为4组室温(20 ℃)保存(每组3个),保存时间分别为0、20、40和60 d。对4组沙田柚进行转录组测序委托北京诺禾致源生物信息科技有限公司完成,果肉取样及分析方法参考我们前期文章[16]。
1.3 沙田柚采后主要生理指标的测定
沙田柚采后生理指标测试方法参考我们前期文章[17],利用电子天平称量果实重量;利用手持糖度仪测定沙田柚可溶性固形物含量;VC、苹果酸和柠檬酸利用HPLC法测试,测试委托齐一生物科技(上海)有限公司完成;蔗糖、果糖和葡萄糖利用分光光度法进行测试,试验所需试剂盒生产商为齐一生物科技(上海)有限公司。
沙田柚可溶性固形物增加率=(保存后可溶性固形物-刚采摘时可溶性固形物)/刚采摘时可溶性固形物值×100%
沙田柚果实失重率=(刚采摘时重量-保存后重量)/刚采摘时重量×100%
1.4 实时定量PCR测试
2020年,根据转录组表达数据,挑选与刚采摘相比均发生显著差异表达的9个基因设计引物,利用Actin基因作为内参进行实时定量PCR分析,引物序列见表1,测试委托北京百迈客生物科技有限公司完成。

表1 实时定量PCR引物序列Table 1 Primer sequences of quantitative RT-PCR
2 结果与分析
2.1 沙田柚采后生理指标的变化
经过分拣中心筛选,刚采摘沙田柚的可溶性固形物值为(12.1±0.26)%,证明初筛结果可靠。由表2可知,沙田柚可溶性固形物值随着保存时间延长而增加,果实质量随着保存时间延长而降低。由表可知,两组数据上升趋势并不一致,采后保存40~60 d是可溶性固形物变化最大的阶段。证明了沙田柚采后可溶性固形物的变化不是一个果实简单失水的过程,存在着复杂的生理生化变化。
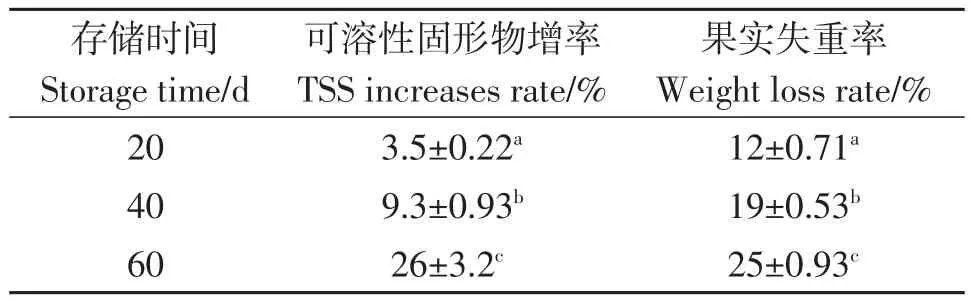
表2 不同保存时间果实失重率和可溶性固形物增加率Table 2 The weight loss and soluble solid increases rate at different storage
沙田柚采后总酸、柠檬酸、苹果酸和VC的变化见表。由表3可知,随着保存时间的延长,沙田柚采后总酸、柠檬酸和VC的含量均出现上升的趋势,苹果酸含量无显著差异。
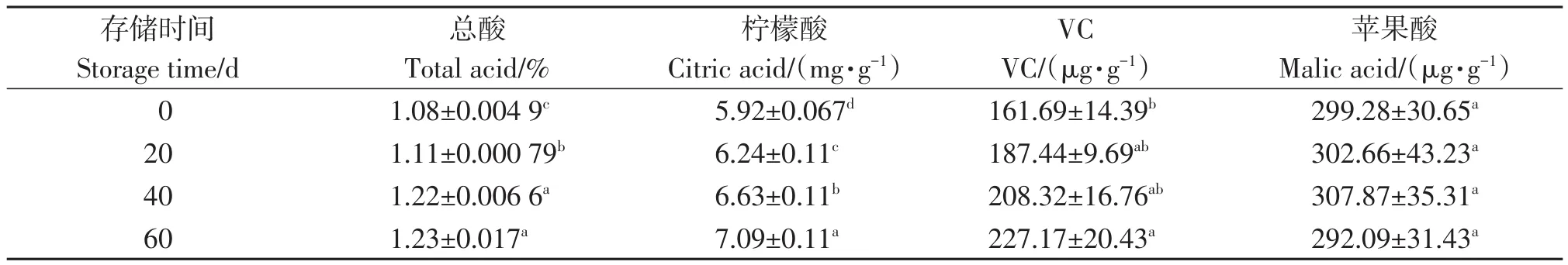
表3 不同保存时间酸的变化Table 3 The acid content in pomelo at different storage
沙田柚采后蔗糖、果糖和葡萄糖含量的变化见表。由表4可知,随着采后保存的时间延长,沙田柚蔗糖含量呈下降趋势,葡萄糖和果糖的含量呈上升趋势。
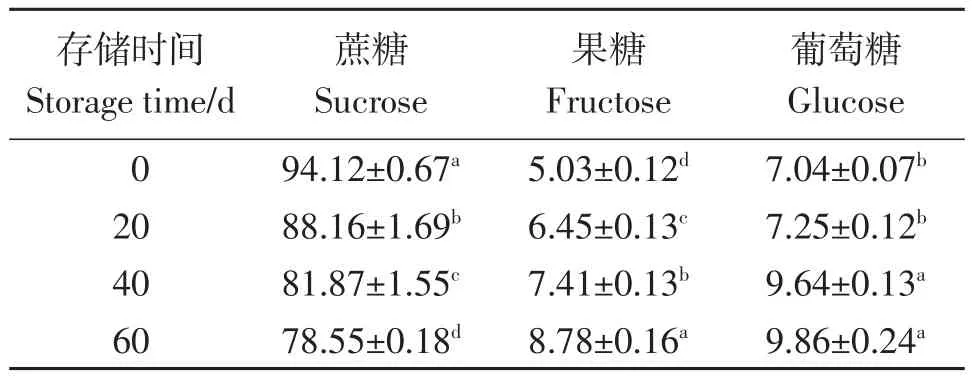
表4 不同保存时间糖的变化Table 4 The sugar content in pomelo at different storage mg·g-1
2.2 柚及近缘物种AP2/ERF转录因子鉴定结果
利用拟南芥和水稻的AP2/ERF序列作为探针,在柚中发现128个目标序列。柚AP2/ERF转录因子包括107个ERF基因、16个AP2基因、4个RAV基因和1个独立基因,根据其染色体位置对目标基因命名,分别对其命名为CgERF1~CgERF107、CgAP2.1~CgAP2.16、CgRAV1~CgRAV4和CgSoloist1(表5)。对AP2/ERF转录因子的理化性质进行分析,柚AP2/ERF转录因子的氨基酸数量在125(CgERF61)~803(CgERF56)个之间,分子量在 14 324.87 kD(CgERF61)~88 835.89 kD(CgERF56)之间,等电点在4.71(CgERF84、CgERF5和CgERF36)~11.24(CgERF72)之间。
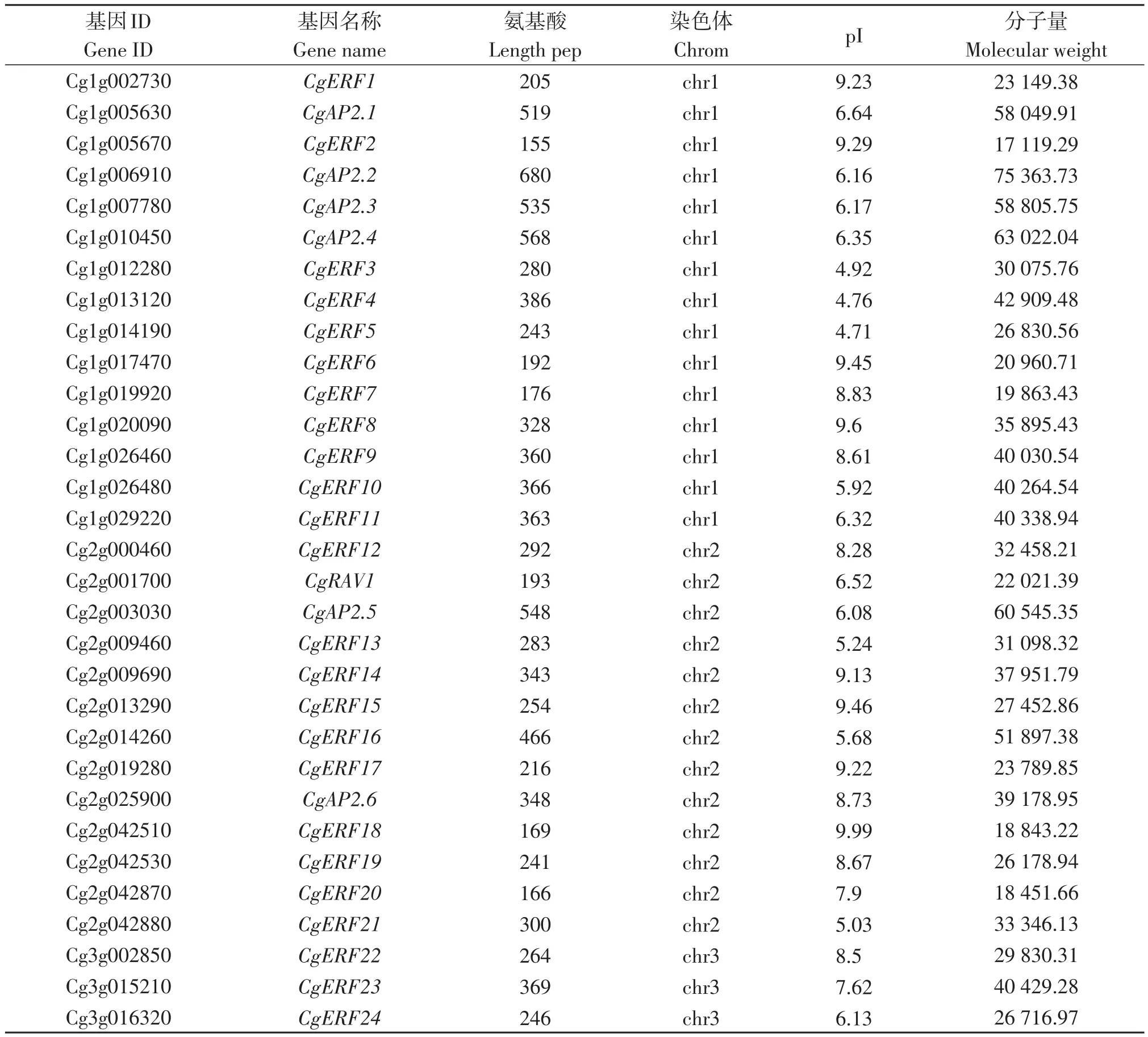
表5 柚AP2/ERF转录因子家族信息Table 5 The information of AP2/ERF transcription factor family in pomelo
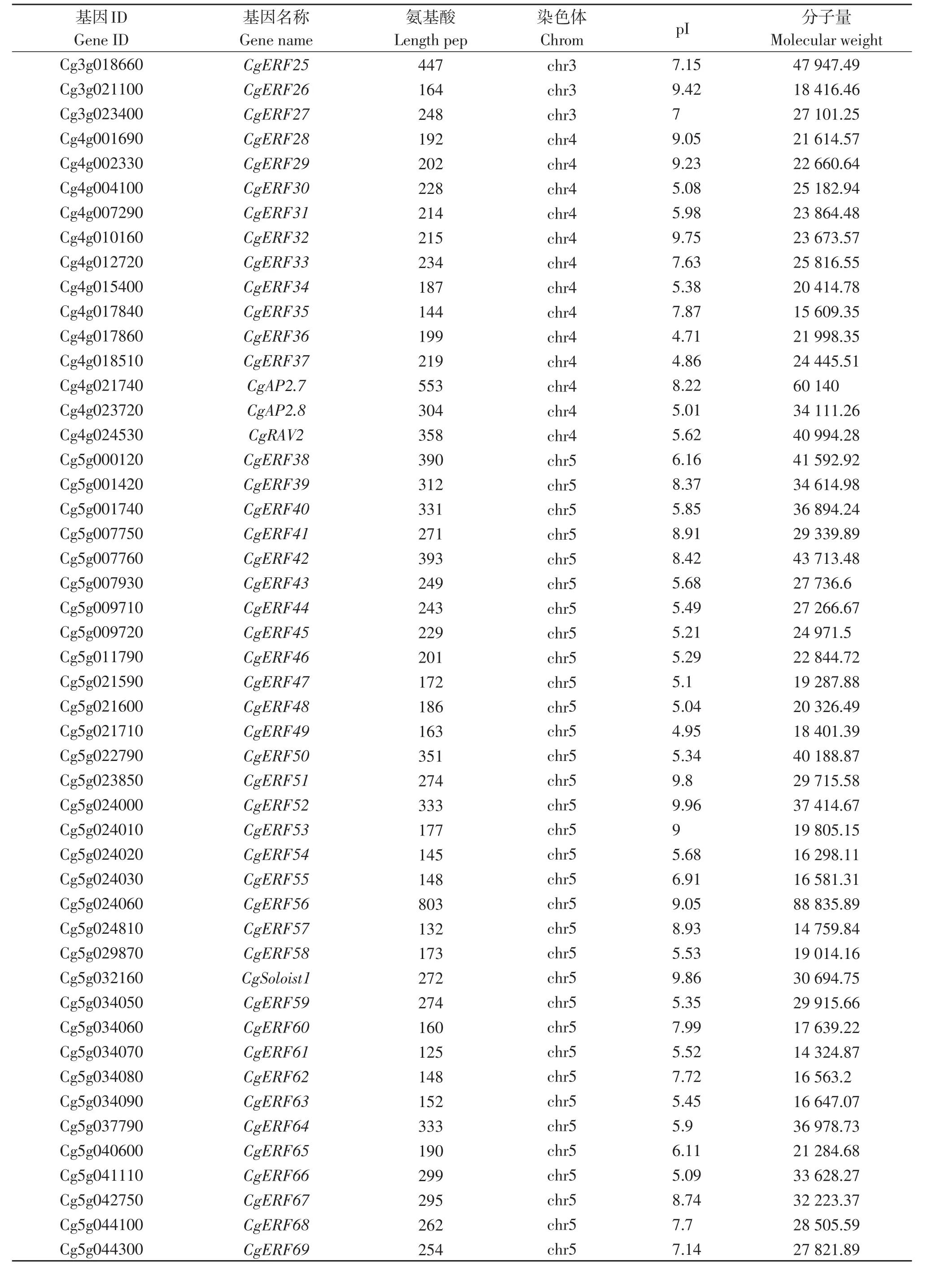
(续 表5)
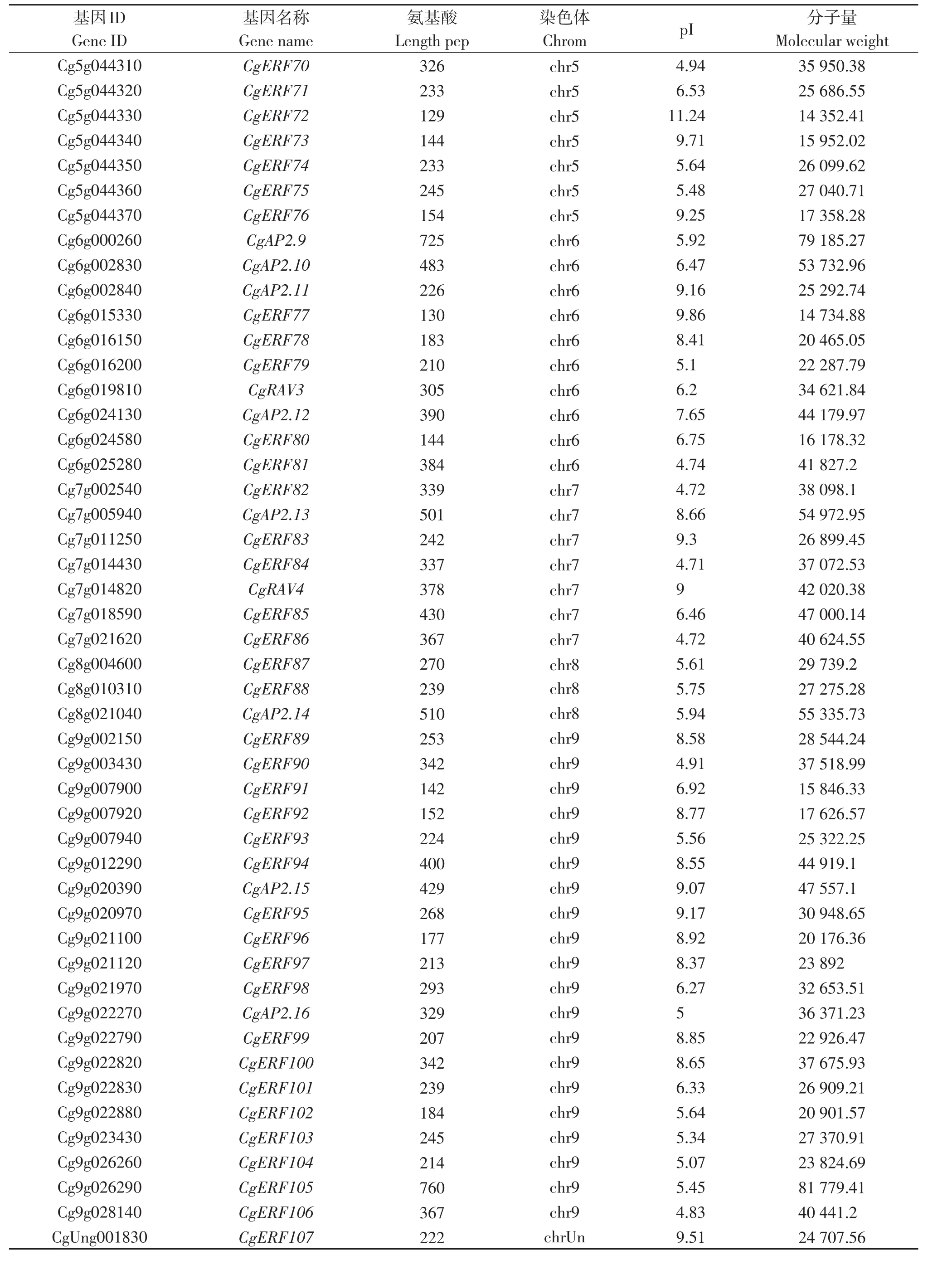
(续 表5)
2.3 柚AP2/ERF转录因子在染色体上的分布
对柚AP2/ERF转录因子在染色体上的分布进行分析发现,127个柚AP2/ERF转录因子分布在柚的9条染色体上,基因CgERF107没能定位,分布图如图1所示。由图可知,柚AP2/ERF转录因子在5号染色体分布的最多,有40个(CgERF3 8~CgERF76和CgSoloist1,28.3%),分布在8号染色体的最少,只有 3个(CgERF87、CgERF88和CgAP2.14),AP2/ERF转录因子在柚染色体上分布并不均匀。
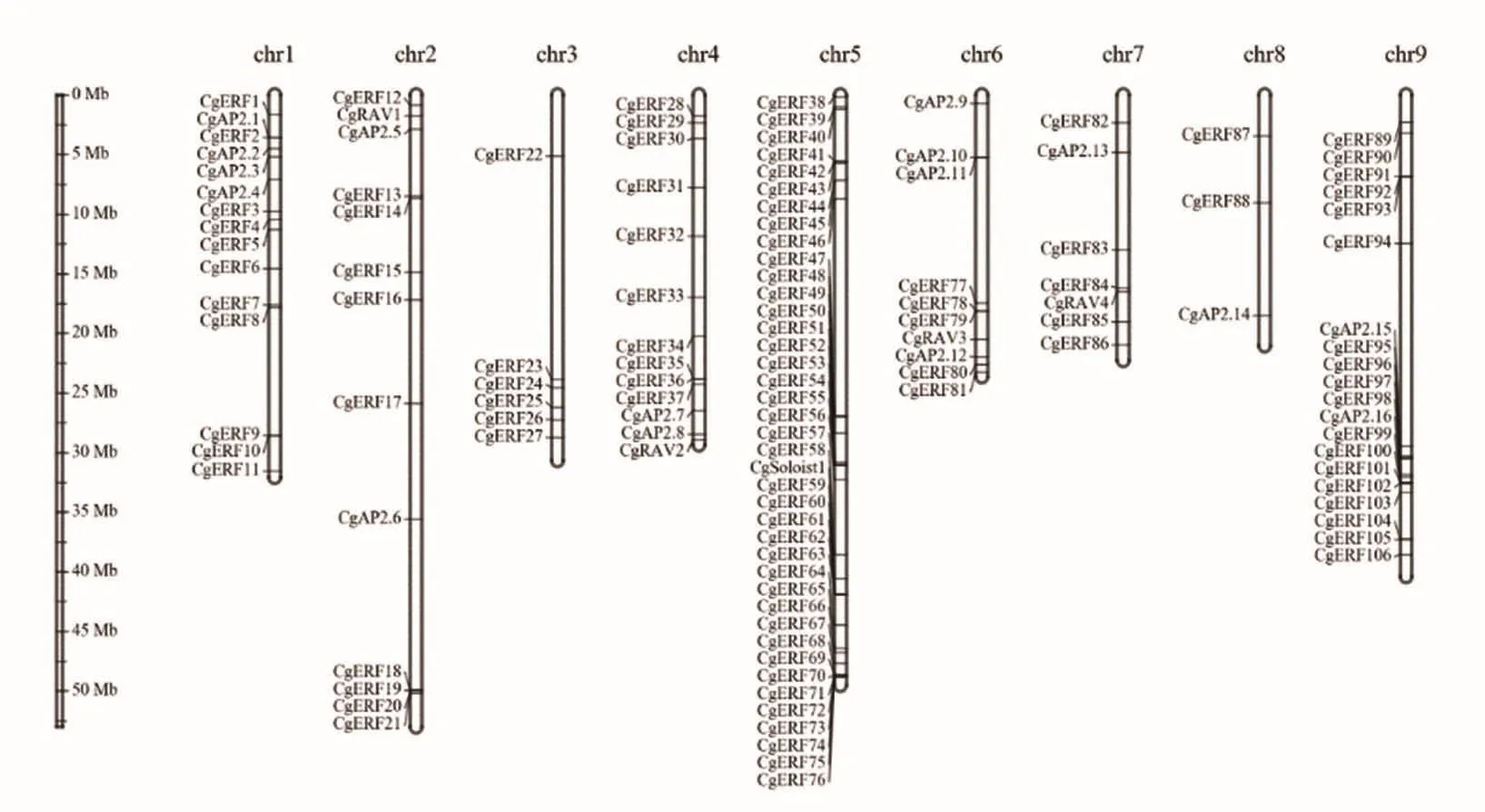
图1 柚AP2/ERF转录因子染色体结构定位Figure1 Chromosomal structure localization of AP2/ERF transcription factor in pomelo
2.4 柚AP2/ERF转录因子物种进化树
柚AP2/ERF转录因子基因结构和进化树如图所示。由图2可知,AP2/ERF转录因子外显子数在1~10个之间,内含子数在0~4个之间,基因长度差异较大,证明柚AP2/ERF转录因子在进化的过程中变异较大。AP2/ERF蛋白包含1~2个AP2结构域,除了共有保守的AP2结构域外,有3个RAV基因有保守的B3结构域,2个ERF基因包含coiled-coil结构域,1个ERF基因包含F-BAR结构域。
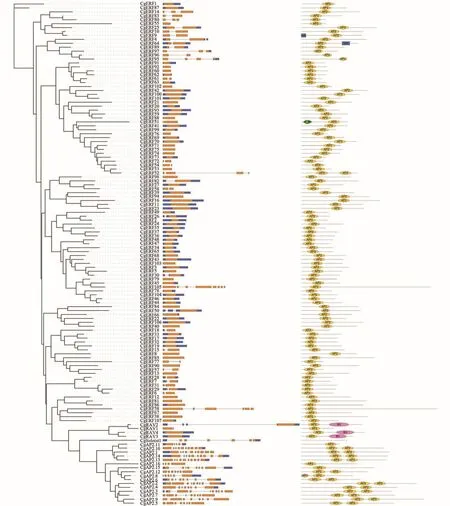
图2 柚AP2/ERF转录因子家族进化树与基因结构Figure 2 Phylogenetic tree and gene structure of AP2/ERF transcription factor in pomelo
2.5 沙田柚采后室温保存ERF转录因子表达分析
本研究对沙田柚采后室温保存进行果肉转录组测序,在4个时间点取样进行基因表达分析,合计得到差异表达的AP2/ERF转录因子基因63个,和刚采摘相比,得到显著差异表达基因42个,如图3 Venn图所示。其中9个基因在3个时间点中均存在差异表达,3个基因在20和60 d两个时间点差异表达,5个基因在40和60 d两个时间点差异表达。
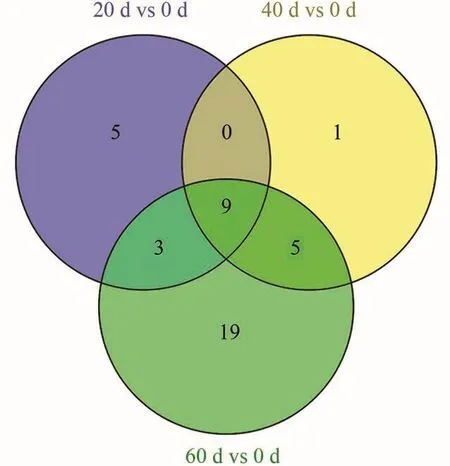
图3 采后保存柚差异表达AP2/ERF基因的Venn展示Figure 3 Venn diagram of AP2/ERF gene expression level with significant differential expression of pomelo after harvest
针对转录组测序分析得到的差异表达基因,进行基因表达分析,采后表达热图如图4所示,在采后不同时期,该家族基因表达差异较大,根据其表达可以将其分为四类。第一类为刚采摘时表达量较高,如CgERF95、CgAP2.6和CgERF11等基因,该类基因合计21个;第二类为采后保存20 d表达量较高,如CgAP2.15、CgERF100和CgERF96等,该类基因合计7个;第三类为采后0、20 d低表达,采后40、60 d高表达的基因,如CgERF2、CgERF30和CgERF45等,这类基因合计7个,第四类为采后60 d高表达的基因,如CgAP2.10、CgERF106和CgERF104等,该类基因合计28个。
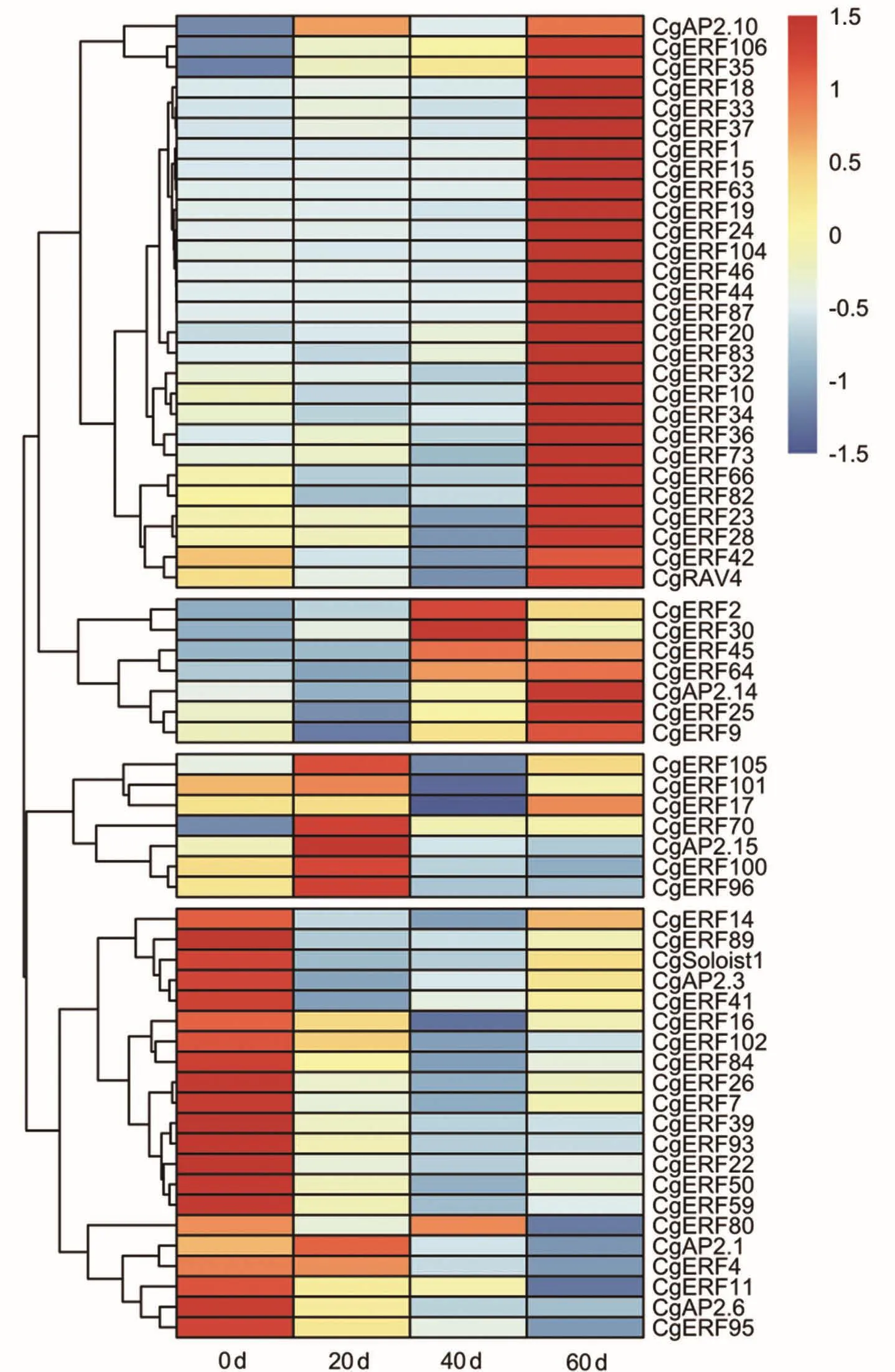
图4 采后保存柚AP2/ERF基因的转录组数据热图Figure 4 Heatmap of transcriptome data of AP2/ERF gene in different stages after harvest
2.6 实时定量PCR验证AP2/ERF转录因子在沙田柚采后保存过程中的表达
根据前期转录组的结果,挑选与刚采摘相比发生显著差异表达的9个基因,这些基因包括采后均显著上调的基因 CgAP2.10、CgERF1、CgERF63、CgERF45和CgERF70;均显著下调的基因CgERF89、CgERF39、CgERF93 和 CgERF22。对其进行了实时定量PCR验证,结果如图5所示,实时定量结果与转录组测序结果趋势一致,证明转录组结果真实可靠。结果表明CgERF39表达量持续降低,CgERF1、CgERF63和CgERF45表达量持续升高,这些基因可能是沙田柚采后品质发生变化的关键基因。
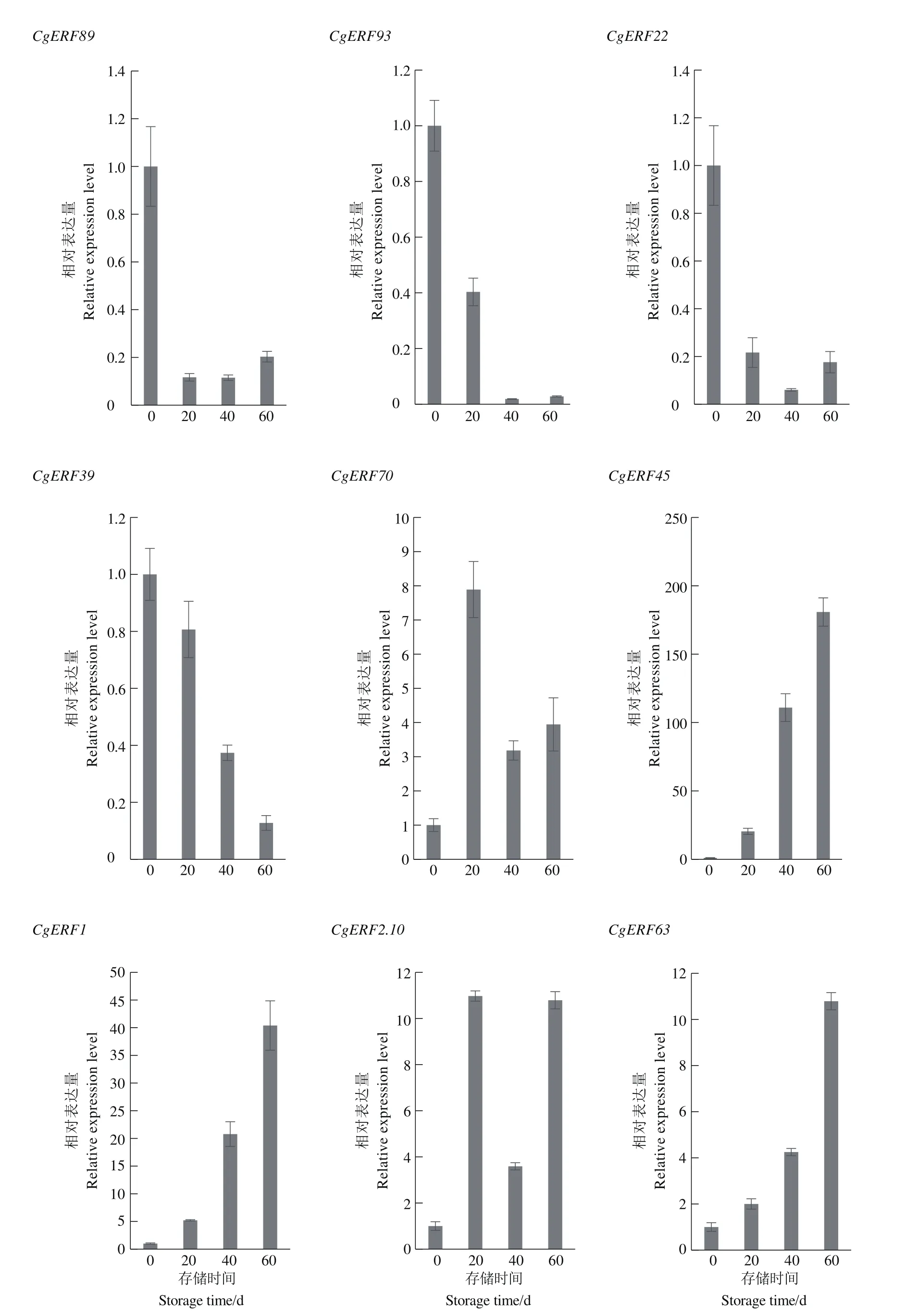
图5 沙田柚采后显著差异表达的AP2/ERF基因表达量分析Figure 5 Analysis of AP2/ERF gene expression level with significant differential expression of pomelo after harvest
3 讨论
沙田柚是我国栽培面积最大、产量最高的柚类品种。作为柑橘类中耐存储的品种,沙田柚采收后作为一个独立的代谢系统,可溶性固形物、糖类、有机酸和维生素等营养成分决定了采收后的果实风味品质[18-19],随着对沙田柚采摘后品质的分析发现,随着保存时间的延长沙田柚的品质会发生显著的变化。刘萍等[20]研究发现:沙田柚在室温保存20 d时失重率为20%,保存90 d以内可溶性固形物含量上升、抗坏血酸含量和有机酸含量先下降后上升;在本研究中我们发现:沙田柚在室温贮藏60 d内可溶性固形物含量、果实失重率、总酸、柠檬酸和VC的含量均出现上升的趋势。但是,苹果酸含量无显
著差异。糖度是决定沙田柚品质的重要指标,在果实成熟的后期,蔗糖可以被分解为葡萄糖和果糖,提高沙田柚的口感和风味[21]。与之前的研究一致,本研究中我们发现沙田柚采后随着贮藏时间的不断增长,蔗糖含量逐渐下降,而葡萄糖和果糖含量则不断上升。以上研究表明,贮藏后可溶性固形物、糖类和有机酸的改变影响沙田柚的品质,但是其调控的机制尚不清楚。
乙烯响应因子(AP2/ERF)转录因子家族是一类广泛存在于植物中的转录因子,对植物的生长发育、次生代谢过程和植物的抗胁迫能力具有重要的调控作用[22-23]。同样,研究发现AP2/ERF家族在果实的发育和品质的调控过程中起重要作用[24-25]。Liu M.等[26]发现在番茄基因组中存在的77个ERF,其中27个在成熟开始时表达增强,而28个ERF基因的表达随着果实的成熟表达量减少,这表明不同的ERF在果实成熟中可能具有截然不同的作用;Fan Z.Q.等[27]鉴定了一个带有EAR基序的DREB的转录因子MaDEAR1,研究发现MaDEAR1可以作为细胞壁修饰基因的转录抑制因子抑制乙烯介导的香蕉果实成熟。所以,探究并挖掘AP2/ERF转录因子家族及其关键的基因在沙田柚果实品质中的影响具有重要的意义。在本研究中,我们通过生物信息学分析发现在沙田柚中共鉴定获得128个AP2/ERF转录因子,分布于柚的9条染色体上,其中包括107个ERF基因,16个AP2基因,4个RAV基因和1个独立的基因。在本研究中我们鉴定的AP2/ERF基因的总数低于拟南芥(145)、水稻(167)、番茄(146)、葡萄(132)、胡萝卜(267)和毛果杨(200)中AP2/ERF转录因子的数量[28-30]。但是,该数量大于T.M.Ito等[31]在甜橙中发现的108个AP2/ERF基因。基因重复在基因家族扩展和串联重复产生的基因簇或热点区域中具有重要作用[32],片段重复产生同源基因,从而扩大基因家族的总基因数[33]。所以,我们推测这种在不同种属中基因数目的差异可能是沙田柚AP2/ERF基因进化和复制造成的。
系统发育关系和保守结构域的分析有助于对AP2/ERF基因进行聚类分析。聚类分析发现AP2/ERF蛋白包含1~2个AP2结构域,除了共有保守的AP2结构域外,有3个RAV基因有保守的B3结构域,2个ERF基因包含coiled-coil结构域,1个ERF基因包含F-BAR结构域。这一研究结果与在其他物种的研究结果类似[34-35],表明AP2/ERF家族基因在进化中体现出巨大的差异性。这一结果同样在基因结构中得到验证。基因结构分析发现P2/ERF转录因子外显子数在1~10个之间,内含子数在0~4个之间,基因长度差异较大,证明柚AP2/ERF转录因子在进化的过程中变异较大。但是,进一步分析发现同一亚群中的基因具有相似的基因结构,表明这些基因具有相似的基因功能。
AP2/ERF转录因子作为乙烯信号通路中的最终目的基因,可通过调控各种下游靶基因的表达来参与植物整个生命周期的生长发育和各种逆境胁迫。越来越多的研究表明AP2/ERF转录因子在调控果实的品质中起到决定性的作用,比如果实成熟软化、果实色泽、果实风味和果实芳香[25]。宋丽等[36]研究发现AP2/ERF基因家族影响了板栗糖的物质积累。T.M.Ito等[31]研究发现在拟南芥中过表达CitERF13或AtERF17导致柠檬酸显著积累。为了进一步挖掘在沙田柚贮藏过程中对果实风味的调控起重要作用的AP2/ERF转录因子,对沙田柚采后室温保存20、40和60 d的果实进行了转录组测序分析。经过差异表达分析共得到63个差异表达的AP2/ERF转录因子,这些差异表达的基因同样得到了qRT-PCR的验证,表明转录组测序的准确性。根据其表达分为四类,第一类(21个),为刚采摘时表达量较高,包括CgERF95、CgAP2.6和CgERF11等基因;第二类(7个)为采后保存20 d表达量较高,包括CgAP2.15、CgERF100和CgERF96等;第三类(7个)为采后0、20 d低表达,采后40、60 d高表达的基因,包括CgERF2、CgERF30和CgERF45等;第四类(28个)为采后60 d高表达的基因,包括CgAP2.10、CgERF106和CgERF104等。以上研究表明不同的AP2/ERF基因影响沙田柚不同贮藏时期的品质。AP2/ERF转录因子不同的表达模式的分析有助于深入了解不同AP2/ERF基因在沙田柚不同贮藏时间品质中的作用,将有助于进一步研究沙田柚品质的调控机制。但是,这些基因如何调控沙田柚采后的哪些品质需要进一步深入的研究。
4 结论
本研究对沙田柚采后品质研究发现,总酸、柠檬酸和VC的含量均出现上升的趋势,苹果酸含量无显著变化,蔗糖含量呈下降趋势,葡萄糖和果糖的含量呈上升趋势;在柚的9条染色体上鉴定到了127个AP2/ERF转录因子,这些转录因子包括107个ERF基因、16个AP2基因、4个RAV基因和1个独立基因;在沙田柚采后保存过程中,4个基因的表达持续发生变化,可能是影响沙田柚采后品质的重要AP2/ERF转录因子。

