饲粮非纤维性碳水化合物/中性洗涤纤维对藏羊瘤胃发酵参数及菌群结构的影响
李蒋伟,周 力,马博研,高占红,姚有莉,王志有,侯生珍,桂林生
(青海大学农牧学院,西宁 810016)
藏羊是青藏高原特有的绵羊品种,是牧区牧民的经济支柱;由于青藏高原海拔较高,地势险峻,气候比较寒冷且干旱少雨,太阳辐射比较强烈,枯草期较长,特殊的气候环境对牧草生长形成阻碍,因此传统的放牧饲养模式不能满足日益增长的市场需求,藏羊由放牧饲养逐渐向舍饲过渡[1]。瘤胃作为反刍动物的重要消化站,不同动物品种、年龄及日粮结构均会影响瘤胃微生物区系的建立和微生物发酵[2-3];大量研究表明,NFC/NDF水平可对反刍动物瘤胃微生物区系产生较大影响[4]:李岚捷[5]研究不同NFC/NDF水平饲粮对3—6月龄断奶公犊牛瘤胃微生物多样性的影响发现,虽然不同NFC/NDF水平饲粮对犊牛瘤胃微生物组成无显著影响,但显著影响了瘤胃微生物的种类和物种丰富度,也影响了属水平下微生物的分布,继而改变瘤胃发酵模式。普宣宣[6]研究饲粮NFC/NDF对卡拉库尔羊营养物质消化率和瘤胃菌群结构的影响发现,当NFC/NDF为1.37时营养物质消化率最高,半纤维降解菌在属水平上的丰度也达到最高;NFC/NDF为0.96时,会引起瘤胃菌群结构变化,此时纤维降解菌属水平上的相对丰度最高;淀粉降解菌在属水平上的相对丰度在NFC/NDF为1.90时达到最高。
16S rDNA高通量测序技术通过测定不同菌种中序列的多样性从而鉴定不同菌种的类别[7]。本试验旨在探究育肥藏羊日粮适宜的NFC/NDF水平,通过测定藏羊瘤胃发酵参数和微生物区系分布规律,分析不同NFC/NDF水平日粮对育肥藏羊瘤胃发酵模式和菌群定植的影响,为藏羊饲养模式转变和饲粮的合理配制提供理论依据。
1 材料和方法
1.1 试验时间和地点
2020年5月10日—9月6日,在青海省海北州高原现代畜牧示范园区进行动物饲养试验;2020年9月16日瘤胃样品交由广州赛哲生物科技股份有限公司进行瘤胃微生物16S rDNA基因的测序工作。
1.2 试验设计及饲养管理
选择健康且体况相近的早期断奶藏羊母羔共15只[(21.27±0.38)kg],随机分成 3组,每组 5只。3组羔羊分别饲喂NFC/NDF水平为2.20(Ⅰ组,精粗比70∶30)、1.39(Ⅱ组,精粗比50∶50)和0.92(Ⅲ组,精粗比30∶70)的日粮;根据育肥藏羊生长和营养需要,参考NY/T 816-2004中国肉羊饲养标准[8]进行日粮配制。饲养试验预饲期为10 d,正试期为90 d。精饲粮组成及营养水平如表1。试验羔羊全舍饲分栏饲养,分别于每天9:00和17:00饲喂两次,让自由采食和饮水,中午清扫羊舍,每周对羊舍和运动场地进行消毒杀菌。试验期对羔羊进行常规疫苗的免疫注射和寄生虫防治。
1.3 样品采集和处理
饲养试验结束后,每组中5只羔羊于清晨空腹屠宰在不同位点取瘤胃液于50 mL心管中,混匀、经4层纱布过滤后将滤液进行3 500 r/min离心15 min,投入液氮,并于实验室-80℃冷冻保存。
1.4 瘤胃发酵参数测定
氨态氮(NH3-N)浓度:使用721型分光光度计在700 nm波长下比色测定[9];pH:采用便携性pH酸度计(CY-PH-60,北京恒奥德仪器仪表有限公司)测定;瘤胃液挥发性脂肪酸(VFA),包括乙酸、丙酸、异丁酸、丁酸、异戊酸、戊酸及总挥发酸(TVFA),由西北高原生物研究所采用岛津(GC-2014)气相色谱仪测定,测定方法参照王加启[10]关于气相色谱测定羊瘤胃液中挥发性脂肪酸方法。
1.5 瘤胃液细菌分析方法
本试验16S rDNA高通量测序部分交由广州赛哲生物科技股份有限公司测定,对采集到的15个瘤胃液样品基于Illumina HiSeq测序平台,采用双末端测序(Paired-End)的方法,构建小片段文库进行测序,OTU聚类分析,物种注释及丰度分析,使用DNA提取试剂盒(Invitrogen™,USA)提取瘤胃微生物基因组DNA,根据保守区设计得到引物,其中通用引物正向:5’-CCTACGGGNGGCWGCAG-3’,反向:3’-GGACTACHVGGGTATCTAAT-5’。在引物末端加上测序接头,进行PCR扩增并对其产物进行纯化、定量和均一化形成测序文库,建好的文库先进行文库质检,质检合格的文库进行高通量测序,进而得到原始图像数据文件。其中Ⅱ组一个瘤胃液样品测序质量评估不合格,对其剔除。
1.6 数据处理
采用Microsoft Excel整理初始数据,用SPSS 20.0中的One-way ANOVA进行单因素方差分析,检测结果用平均值±标准误(Mean±SE)的形式表示。差异显著的评断标准为P<0.05。
2 结果与分析
2.1 饲粮精粗比对育肥藏羊瘤胃发酵参数的影响
由表2可见,不同NFC/NDF水平下瘤胃pH处于5.7~6.6之间,当NFC/NDF比值提高,pH显著降低,瘤胃液氨态氮浓度有升高趋势(P<0.05)。NFC/NDF比值可对瘤胃液挥发性脂肪酸造成显著影响,其中丙酸、异丁酸占总挥酸含量的百分比以及总挥发酸含量与NFC/NDF比值呈正相关,乙酸百分比及乙酸丙酸比随NFC/NDF比值增高而显著降低(P<0.05)。
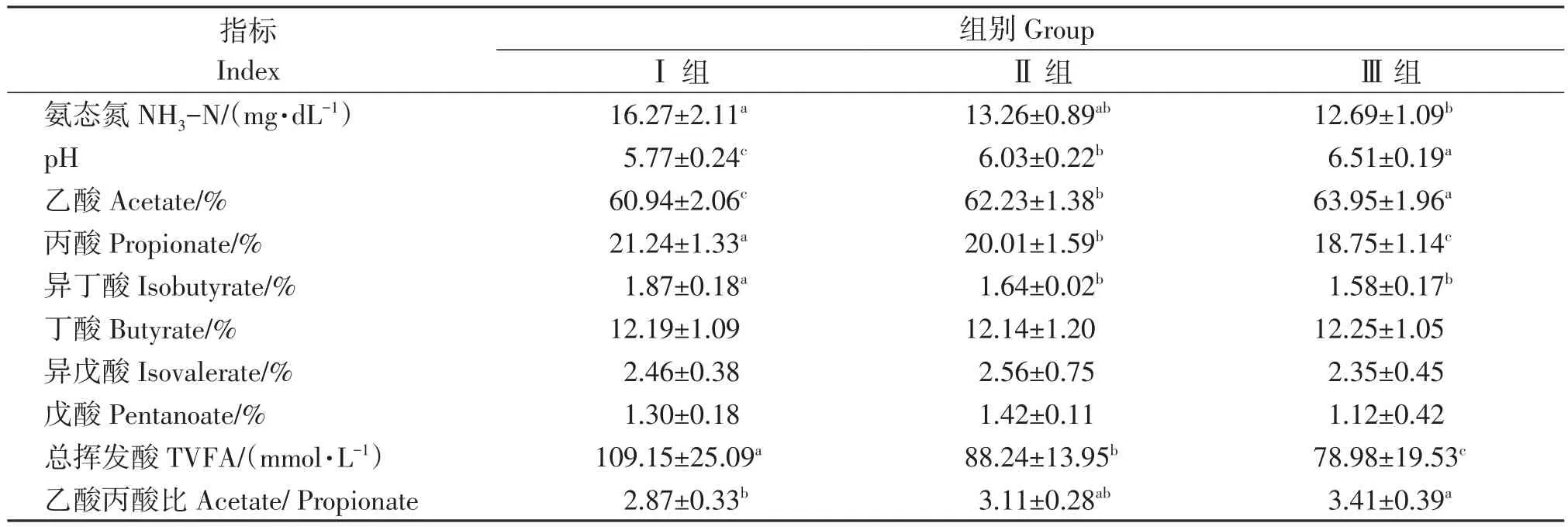
表2 不同NFC/NDF水平日粮对育肥藏羊瘤胃发酵参数的影响Table 2 Effect of different NFC/NDF levels on rumen fermentation parameters of fattening Tibetan Sheep
2.2 不同NFC/NDF水平下育肥藏羊瘤胃细菌OTU基础分析
2.2.1 瘤胃微生物多样性由Alpha多样性分析
如表3所示,反映了羔羊瘤胃细菌群落丰富度和多样性,并表现出一定的规律性。其中Shannon指数Ⅱ组和Ⅲ组显著高于Ⅰ组(P<0.05),Simpson指数各组之间无显著性差异(P>0.05),表明各组间群落多样性相似;ACE指数和Chao l指数Ⅰ组显著低于Ⅱ组和Ⅲ组(P<0.05),表明Ⅰ组群落丰富度较小。

表3 不同NFC/NDF水平日粮对育肥藏羊瘤胃微生物多样性指数的影响Table 3 Effects of different NFC/NDF levels on rumen microbial diversity index of fattening Tibetan Sheep
2.2.2 测序数据质量评估
在97%的物种相似度水平下,3组检测样本共得到347种OTU,其中有269种为3组共有OTU,占OTU总数的77.52%,独有的OTU占OTU总数的比例较小,表明各组OTU组成差异很小,相似度较高。
2.3 不同NFC/NDF水平下育肥藏羊瘤胃细菌分类学分析
2.3.1 门水平下瘤胃细菌分布分析
经序列对比发现本试验中藏羊瘤胃存在4种主要菌门,对其相对丰度进行显著性分析如表4所示。瘤胃细菌的优势菌群是拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes),相对丰度分别超过45%和29%;变形菌门(Proteobacteria)和软壁菌门(Tenericutes)相对丰度较小,分别低于4%和2%。拟杆菌门(Bacteroidetes)Ⅱ组显著高于其余两组(P<0.05),厚壁菌门随NFC/NDF降低而降低(P<0.05),变形菌门(Proteobacteria)和酸杆菌门(Acidobacteria)相对丰度差异不显著(P>0.05)。

表4 门水平下细菌相对含量Table 4 Relative bacterial content at phylum level %
2.3.2 科水平下瘤胃细菌分布分析
经序列对比发现本试验中藏羊瘤胃主要存在12种主要菌科,对其相对丰度进行显著性分析如表5所示。毛螺菌科(Lachnospiraceae)Ⅰ组显著高于Ⅱ组(P<0.05),相对丰度1.98%~11.19%;瘤胃菌科(Ruminococcaceae)相对丰度1.21%~12.61%,且Ⅰ组和Ⅱ组显著高于Ⅲ组(P<0.05);韦荣氏菌科(Veillonellaceae)相对丰度6.20%~22.92%,且Ⅱ组显著高于Ⅰ组和Ⅲ组(P<0.05)。帕拉普氏菌科(Paraprevotellaceae)、克 里 斯 滕 森 菌 科(Christensenellaceae)、丹毒丝菌科(Erysipelotrichaceae)、普雷沃氏菌科(Prevotellaceae)和琥珀酸弧菌科(Succinivibrionaceae)等的相对丰度不受NFC/NDF水平影响(P>0.05)。
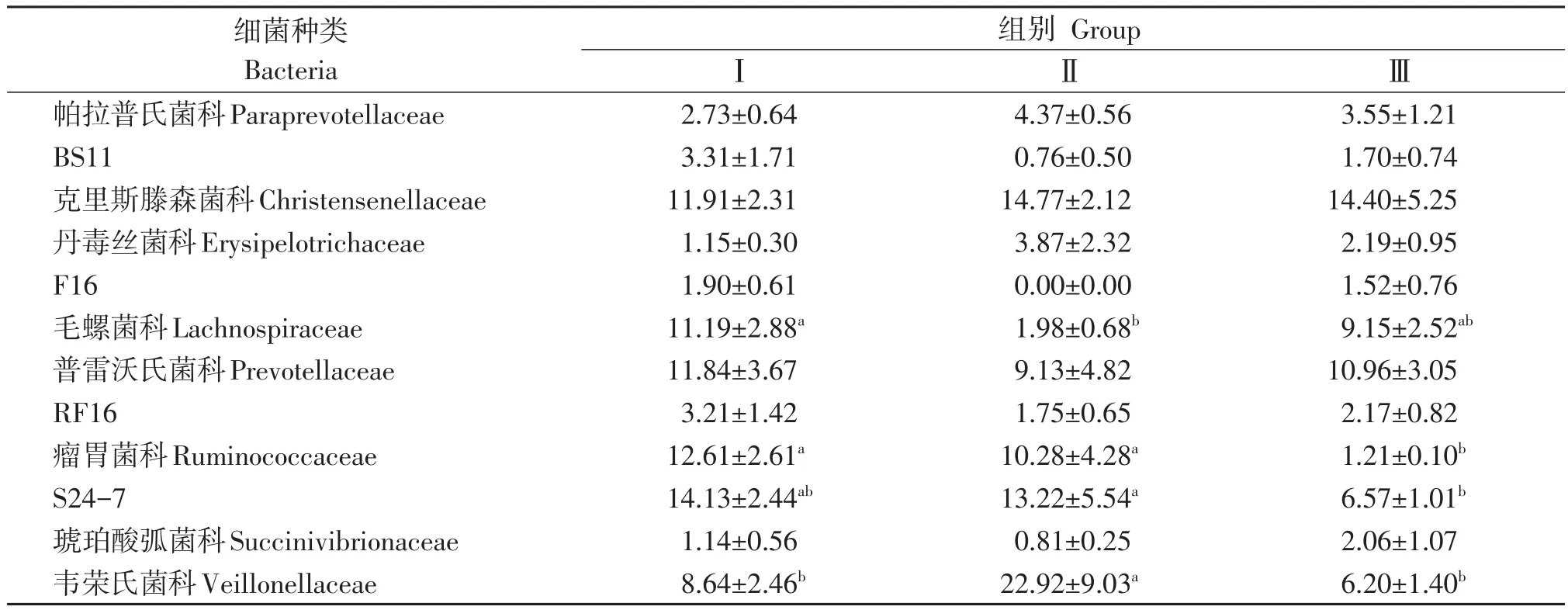
表5 科水平下细菌相对含量Table 5 Relative bacterial content at family level %
2.3.3 属水平下瘤胃细菌分布分析
经序列对比发现本试验中藏羊瘤胃主要存在7种主要菌属,对其相对丰度进行显著性分析如表6所示。普雷沃氏菌属(Prevotella)的相对丰度较高(8%~11%),其余菌属相对丰度均较小(<3%)。其中丁酸弧菌属(Butyrivibrio)Ⅱ组显著高于Ⅰ组和Ⅲ组(P<0.05);瘤胃球菌属(Ruminococcus)相对丰度有降低趋势,且Ⅰ组和Ⅱ组显著高于Ⅲ组(P<0.05);普雷沃氏菌属(Prevotella)、RFN20、月形单胞菌属(Selenomonas)和解琥珀酸菌属(Succiniclasti⁃cum)均不受NFC/NDF水平影响(P>0.05)。
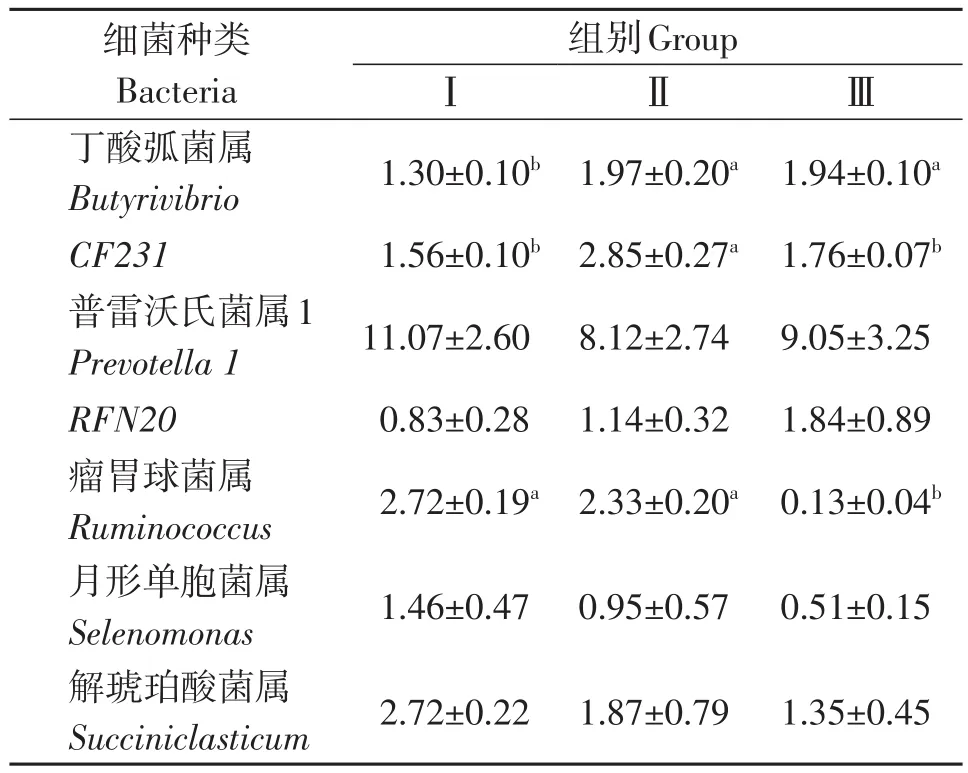
表6 属水平下细菌相对含量Table 6 Relative bacterial content at genus level %
2.4 不同NFC/NDF水平下育肥藏羊瘤胃细菌主成分分析
利用UniFrac PCA对不同NFC/NDF水平下育肥藏羊瘤胃细菌群落差异进行研究,通过系统进化距离来衡量样品间的距离并显示于二维或三维空间的PCA图上(图1)。基于UniFrac加权主坐标分析其第一主成分和第二主成分贡献率分别为63.93%和57.63%,各组间瘤胃液细菌群落结构差异明显,Ⅰ组与Ⅱ组明显分隔,Ⅲ组介于两组之间。
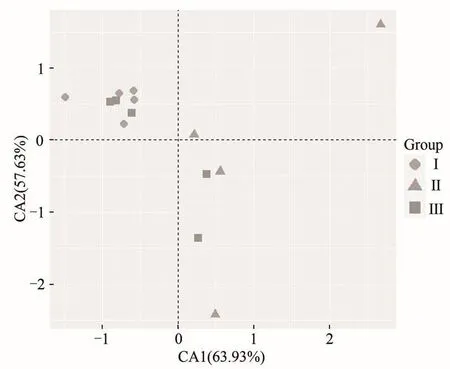
图1 瘤胃细菌主成分分析Figure 1 The PCA of rumen bacteria
3 讨论及小结
3.1 不同NFC/NDF水平对瘤胃发酵参数的影响
瘤胃pH是瘤胃发酵水平及健康程度的最基本反映指标。在本试验研究中,随着NFC/NDF水平的逐渐降低,瘤胃pH逐渐提高。K.A.Beauchemin等[11]将瘤胃pH是否低于5.8作为反刍动物亚急性酸中毒的发生阈值,当NFC/NDF水平为2.20时,瘤胃pH低于5.8,Ⅰ组试验羊可能处于亚急性酸中毒的状态,这与魏德泳等[12]和胡红莲等[13]在山羊瘤胃发酵的研究结果相一致。瘤胃NH3-N浓度是饲粮氮源分解状况的集中反映,也是微生物合成微生物蛋白的重要氮源。本试验中,NH3-N浓度与NFC/NDF水平呈正相关,原因在于饲粮NFC的改变使微生物发酵所利用的有机物含量改变,从而改变氮的利用效率[14]。在本研究中,瘤胃挥发性脂肪酸浓度的变化趋势与pH相对应,当NFC/NDF比值降低,瘤胃中乙酸、丙酸和TVFA的浓度明显降低,瘤胃发酵模式有转变趋势,由乙酸发酵逐渐向丙酸发酵过渡,但乙酸所占总挥酸百分比仍然最大。大量研究表明瘤胃液中TVFA浓度过高易导致瘤胃亚急性酸中毒发生,从而导致pH的下降[15];本研究结果印证了挥发酸浓度及发酵模式与瘤胃亚急性酸中毒的发生存在密切联系。
3.2 不同NFC/NDF水平对瘤胃细菌多样性的影响
瘤胃中汇集了数量庞大且功能各异的微生物群落,这些微生物的组成受环境、个体遗传因素等的影响[16],除此之外日粮结构是影响微生物组成和群落分布的最重要人为可控因素,适宜的NFC/NDF水平可促进瘤胃有益菌的定植,从而影响瘤胃养分消化和发酵[17]。已有研究结果表明,较高NFC水平的日粮使产酸菌增殖明显,从而使反刍动物处于酸中毒状态[18-19],除此之外,李岚捷等[5]研究发现,高NFC/NDF水平(1.35)较低NFC/NDF水平(0.80)瘤胃微生物多样指数均显著降低。本研究表明,饲喂NFC/NDF水平为2.20的育肥藏羊瘤胃细菌Shannon指数、ACE指数、Chao1指数和OTU数量均显著低于NFC/NDF水平为1.39和0.92的试验羊,说明高NFC/NDF水平(2.20)显著降低了瘤胃微生物的多样性分布。
3.3 瘤胃细菌分类学分析结果
厚壁菌门和拟杆菌门是反刍动物瘤胃细菌的重要组成部分,分别作用于饲粮中的纤维和淀粉类物质,其优势地位因日粮中纤维和淀粉含量而改变[20-21]。本实验结果与其相似,在门水平下,厚壁菌门和拟杆菌门的比例随NFC/NDF水平变化而变化,当NFC/NDF水平为1.39时瘤胃内拟杆菌门相对丰度达到最高,说明在此种日粮饲喂下瘤胃内拟杆菌门增殖达最佳水平;而拟杆菌门与非纤维类物质分解密切相关,碳水化合物一般在反刍动物日粮中高达60%~70%,是微生物主要能量来源[22-24],高碳水化合物比例可促进拟杆菌门增殖,并将其发酵并降解成挥发性脂肪酸[25]。在NFC/NDF水平为2.20时拟杆菌门并未出现理论上的持续增加,结合其他菌门分布本试验认为在高NFC/NDF水平时,瘤胃酸杆菌门有增加趋势,可能在瘤胃中发生亚急性酸中毒,变形菌门的增加也说明了瘤胃微生物的菌群失调和群落不稳定[26]。本研究中厚壁菌门相对丰度随NFC/NDF水平降低而降低,厚壁菌门是革兰氏阴性菌,可将纤维类物质降解为短链脂肪酸为反刍动物供能[27],其在本试验中的分布规律结合前人研究本实验推测藏羊瘤胃发酵模式发生了改变。
丁酸弧菌属一种可发酵淀粉、非纤维多糖以及单糖的多功能菌属,并兼具淀粉酶和蛋白酶活性,影响部分挥发性脂肪酸的含量[28];在本试验中不同NFC/NDF水平下丁酸弧菌属相对丰度较小,但相互差异显著,说明其活性受NFC/NDF水平影响较大,并对瘤胃发酵模式的改变产生推动作用。普雷沃氏菌属是拟杆菌门下重要的淀粉降解菌,可以利用非纤维性碳水化合物并降解蛋白;目前发现普雷沃氏菌属不同菌株遗传差异较大,而栖瘤胃普雷沃氏菌株发酵产物以乙酸、琥珀酸和丙酸为主,可产生木聚糖酶和羧甲基纤维素酶[29]。本研究发现不同NFC/NDF水平下瘤胃普雷沃氏菌属相对丰度差异不显著,但随NFC/NDF水平降低而随之降低,与前人多数研究结果保持一致。瘤胃球菌属是厚壁菌门下降解纤维的常见优势菌属,能产生大量的纤维素酶和半纤维素酶[30]。其中黄色瘤胃球菌能产生结构复杂的木聚糖酶、多种内切酶和一种外切酶,可将结构复杂的纤维物质降解成纤维二糖、戊糖和挥发性脂肪酸;白色瘤胃球菌可利用纤维二糖和葡萄糖,其发酵产物为琥珀酸、乙酸和甲酸,还有少量氢气、乙醇和乳酸[31];在本试验中瘤胃球菌属丰度与NFC/NDF水平呈正相关,受日粮纤维水平影响显著,与理论结果相一致。本研究还发现CF231菌属丰度也受NFC/NDF水平影响,并差异显著,但其功能及在瘤胃发酵中扮演角色尚未可知,待进一步研究挖掘。
综上,在本试验条件下,随着NFC/NDF水平降低,瘤胃发酵模式由乙酸发酵逐渐向丙酸发酵过渡,高NFC/NDF水平饲粮(2.20)饲养下的藏羊瘤胃细菌的种类和丰富度明显降低,不同NFC/NDF水平对门水平下优势菌群相对丰度有显著影响;在属水平下优势菌群为普雷沃氏菌属,丁酸弧菌属和瘤胃球菌属受NFC/NDF水平影响差异显著。

