靶向THRβ的新化合物YWS01125对NASH小鼠的治疗作用
程昊,刘波,李妍,刘娜,牟艳玲
(1.山东第一医科大学药学与制药科学学院,山东 济南 250117;2.山东省医学科学院药物研究所,山东 济南 250062;3.国家卫生部生物技术药物重点实验室,山东 济南 250062;4.山东省罕少见病重点实验室,山东 济南 250062)
非酒精性脂肪肝病(non-alcoholic fatty liver disease,NAFLD)是一种以肝脏脂肪异位、脂肪变性为主要特征的肝脏疾病,伴随有炎症及肝细胞损伤的脂肪变性现象,主要表现在无酗酒人群肝脏内的脂肪蓄积[1]。NAFLD包括一系列肝脏疾病,像非酒精性单纯性脂肪肝(non-alcoholic fatty liver disease,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)及与NASH相关的脂肪肝、肝脏纤维化、肝硬化和肝细胞癌(HCC)等。在100名NAFLD患者中,约有20名患者将发展为非酒精性脂肪性肝炎,进一步发展会导致炎症和纤维化,部分患者最终会发展成肝硬化甚至肝细胞癌[2]。随着肥胖和糖尿病患者的增加,全球NAFLD的发病率呈逐年上升趋势,有研究报道[3],NAFLD的全球患病率估计值为总人口数的24%~25%,预计2030年NAFLD的全球患病率将达到28.4%。
甲状腺激素受体激动剂(包括T3和T4),作为一种治疗靶点,目前认为,包括α受体(THRα)和β受体(THRβ)两种亚型。THRα在骨骼肌和心脏中高度表达,主要调节心率,而THRβ高度表达肝脏、肾脏和脑垂体,主要调节促甲状腺激素的释放[4]。由于THRα的心脏副作用,我们选择THRβ进行一系列研究。临床试验发现[5],以THRβ为靶向的药物具有良好的降脂特性,并表现出肝脏特异性分布,具有良好的安全性,是治疗NASH的一种有前景的靶点[6],对以THRβ为靶点合成出的哒嗪酮类化合物(YWS01125,见图1)进行非酒精性脂肪肝的治疗作用研究,对治疗NASH的创新药物具有较好的社会意义。

图1 YWS01125化学结构式
1 材料与方法
1.1 实验动物 健康雄性C57BL/6J小鼠,150只,体质量22~24 g,均购于济南朋悦实验动物繁育有限公司,SPF级,动物合格证号:SCXK(鲁)20190003,实验动物使用许可证号:SYXK(鲁)20170015。饲养于山东第一医科大学实验动物中心,小鼠分笼饲养,10只/盒分配于SPF级屏障系统中,环境温度(23±2)℃,湿度50%~65%,光照明暗交替各12 h,动物自由饮水摄食,良好通风,适应环境7 d 后方可进行实验。本实验符合《实验动物福利伦理审查指南》要求,经我所实验动物伦理委员会审核通过(伦理号:2021035)。
1.2 药品与试剂 YWS01125(分子量:446.24,纯度≥99%),由山东省医学科学院药物研究所合成室提供;MGL-3196、T3购自Selleck公司;CCK-8试剂盒购于日本同仁;丙氨酸氨基转移酶试剂盒(Maccura Biotechnology Co.,Ltd.,1220091);天门冬氨酸氨基转移酶试剂盒(Maccura Biotechnology Co.,Ltd.,1020071);甘油三酯试剂盒(Maccura Biotechnology Co.,Ltd.,0420061);总胆固醇试剂盒(Maccura Biotechnology Co.,Ltd.,0620061);高密度脂蛋白胆固醇试剂盒(Maccura Biotechnology Co.,Ltd.,0321011);低密度脂蛋白胆固醇(LDL-C)试剂盒(Maccura Biotechnology Co.,Ltd.,1220092);游离脂肪酸试剂盒 (Medicalsystem Biotechnology Co.,Ltd.,210506101);CCl4试剂(烟台远东精细化工有限公司)。
1.3 仪器设备 Synergy H1(美国);7180全自动生化分析仪(日本日立);Vevo 3100超高分辨小动物超声成像系统(加拿大)。
1.4 饲料 辐照高脂饲料购自北京科澳协力饲料有限公司,高脂饲料配方如下:67%基础饲料,10%猪油,10%蛋黄粉,1%胆固醇和0.2%胆酸钠。
1.5 试验方法
1.5.1 THRβ/RXR/GRIP1辅激活因子多肽募集实验 用buffer 1(50 mmol·L-1Hepes,pH 7.0,1 mmol·L-1DTT,0.05% NP40,0.2 mg·mL-1BSA)制备THRα(125 nmol·L-1)或THRβ(50 nmol·L-1)溶液,将5 μL GST-THRα(Invitrogen,PV4762)或THRβ(Invitrogen,PV4764)与等量的EE-RxRα(50 nmol·L-1)加入384黑色微孔板中。向微孔板中分别加入2.5 μL T3(0~6 μmol·L-1)或试验化合物(0~0.48 mmol·L-1)的DMSO溶液,并在37 ℃下培养溶液30 min。向每孔中加入2.5 μL生物素-GRIP1肽[生物素-ACAHGTSLKEKHKILHRLLQDSSPVDL-CONH2, 100 nmol·L-1,溶于buffer 1中并加入5%的二甲基亚砜,GL Biochem (Shanghai) LTD合成],于 37 ℃下培养30 min。每孔中加入5 μL含有Eu-anti-GST(Cisbio,61GSTKLA)和streptavidin-d2(Cisbio,610 SADLA)的混合液(用缓冲液:50 mmol·L-1Tris,pH 7.4,100 mmol·L-1NaCl, 0.2 mg·mL-1BSA稀释),在4 ℃下孵育过夜。在Synergy H1上读取665 nm和615 nm荧光信号值,并计算Ratio 665 nm/615 nm。
1.5.2 细胞存活实验 将小鼠成纤维细胞L929浓度调整至5×104个/mL,接种至96孔细胞培养板中,每孔100 μL,设立空白孔,培养过夜至细胞贴壁。吸出96孔细胞培养板中的上清,加入不同浓度(0.1、1、10、100 μmol·L-1)的化合物YWS01225 200 μL,每个浓度设置3个复孔,并设立对照组,继续培养48 h。吸出96孔细胞培养板中的上清,加入含有10% CCK-8的新鲜培养基,避光孵育约2~3 h后,测量450 nm处吸光度,并计算细胞存活率:存活率=(实验组吸光度-空白组吸光度)/(对照组吸光度-空白组吸光度)×100%。
1.5.3 NASH模型制备 选取雄性健康 C57BL/6J 小鼠 150只,22~24 g,按体重均衡的原则随机分为两组:空白对照组20只,造模组130只,分别饲喂基础饲料和高脂饲料,自由饮水,当模型组小鼠与正常组小鼠相比ALT、AST水平显著升高时,随后采用皮下注射CCl4,具体操作如下:皮下注射共 8 次,第一次剂量为0.05 mL·kg-1,皮下注射,剩余7次剂量为0.1 mL·kg-1[7]。在末次CCl4注射结束后,随机抽取造模组小鼠进行B超检测、生化各参数及肝组织病理学的检查,确认NASH小鼠造模是否成功。
1.5.4 分组与给药 当造模组小鼠B超检测出现肝肾比值大于1;血生化检测造模组ALT、AST 指标较空白对照组明显升高;病理切片示小鼠肝组织见大油滴和微小脂滴,肝细胞肿胀,胞质易见脂肪空泡,肝细胞呈明显炎性改变,说明NASH模型造模成功。将造模成功小鼠随机分成模型组、YWS01125(10、20、40 mg·kg-1)及阳性药MGL-3196(40 mg·kg-1)组[8],每组各10只,各组灌胃给予相应浓度的药物溶液,给药体积20 mL·kg-1,连续给药30 d,空白对照及造模组给予等体积蒸馏水,给药期间观察小鼠一般情况,每周称量体重一次。
1.5.5 标本采集及处理 末次给药后24 h,采用腹部超声观察肝脏病变,将小鼠仰卧位置于动物实验台上,固定四肢,脱毛后暴露胸腹部,吸入2%异氟醚和98% O2诱导轻麻醉,以0.5%~1%异氟醚维持麻醉,使用22~55 MHz线性阵列传感器观察肝脏与肾脏情况,拍取B超照片;随后将小鼠眼眶静脉丛取血,将血浆于37 ℃孵箱静置半小时后,3 000 r·min-1,离心15 min,吸取血清,置于自动生化仪中检测测定所取得小鼠血清中ALT、AST、TC、TG、HDL-C、LDL-C水平;摘眼球取血后处死小鼠,称取体质量,解剖取其肝脏,用0.9%氯化钠注射液冲洗,滤纸吸干后称其肝脏质量,测量计算肝指数(肝脏质量/体质量×100%),然后将肝脏置于10% 中性缓冲福尔马林溶液固定24 h后取材,进行病理组织切片,显微镜观察HE染色结果。

2 结果
2.1 THRβ/RXR/GRIP1辅激活因子多肽募集实验 结果表明(见表1),对照组MGL-3196对THRβ的选择性是THRα的4.34倍,而YWS01125对THRβ的选择性是THRα的6.23倍,说明了YWS01125对THRβ的选择性优于阳性对照MGL-3196。

表1 YWS01125对THR两种受体激活的选择性
2.2 细胞存活实验 如图2所示,YWS01125和T3对L929细胞株的存活率均无显著影响。在100 μmol·L-1剂量下,YWS01125和T3的存活率分别为110.30%±11.50%和100.00%±6.20%,说明YWS01125对L929细胞系无毒性作用。
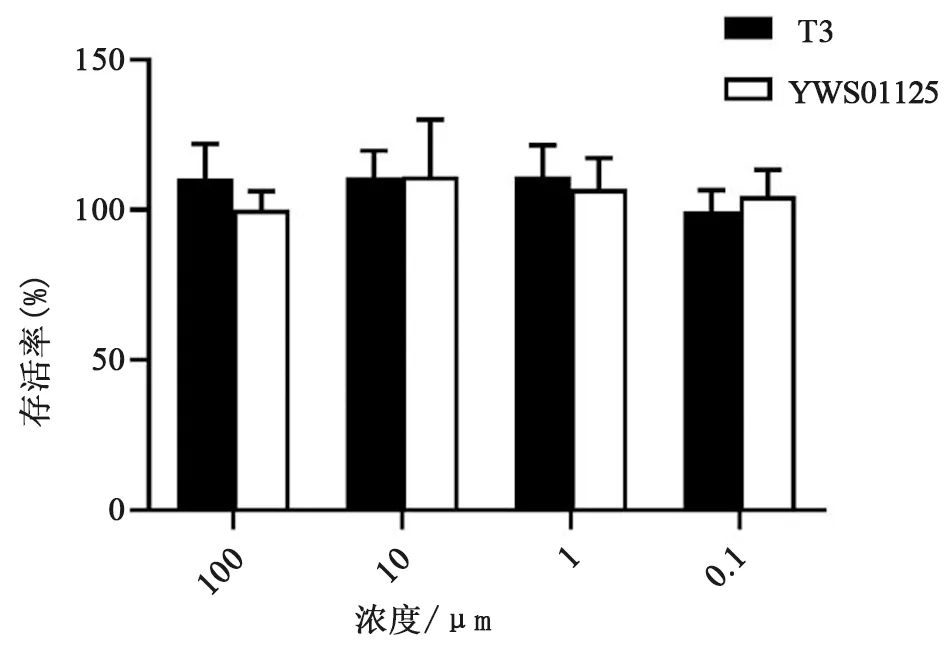
图2 YWS01125对L929细胞系存活能力的影响,数据为3次独立实验的平均值
2.3 小鼠一般情况 实验过程中各组小鼠状态均良好,体重正常增长。正常组小鼠皮毛光滑,活动正常,性情相对温顺。模型组、阳性药对照组及YWS01125剂量组小鼠体质量均大于正常组小鼠,毛发粗糙,偶有出现斑秃现象,性情躁动,不喜动。
2.4 腹部超声观察YWS01125对模型小鼠的影响 与空白对照组相比,造模组肝脏回声明显升高,肝肾比值为1.33,可判断肝脏出现炎症性损伤。阳性药MGL-3196对照组以及YWS01125低、中、高治疗组肝肾比值分别为0.62、1.06、0.90、0.71,均能不同程度改善肝脏病变,且肝肾比值成剂量依赖性降低。图3 A~F分别为空白对照组、造模组、阳性药(MGL-3196)对照组以及YWS01125三剂量治疗组腹部超声图片。
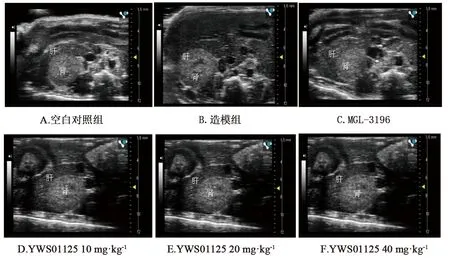
图3 不同治疗组小鼠肝脏B超图片
2.5 YWS01125对模型小鼠血清ALT、AST的影响 与空白对照组相比较,模型建立后C57BL/6J 小鼠的ALT、AST血生化指标有显著增高趋势,说明高脂饲料饮食结合CCl4注射使造模组小鼠肝细胞出现炎性损伤,证明慢性肝损伤小鼠模型建造成功。如图4,与模型组相比较,阳性药(MGL-3196)对照组和YWS01125治疗组小鼠的ALT、AST活性呈现显著降低趋势(P<0.01),说明MGL-3196组和YWS01125治疗组具有降低转氨酶作用,能有效减轻模型对小鼠肝细胞造成的损伤,保护肝脏细胞膜,明显减轻炎性反应,以上结果均具有统计学意义(P<0.01)。
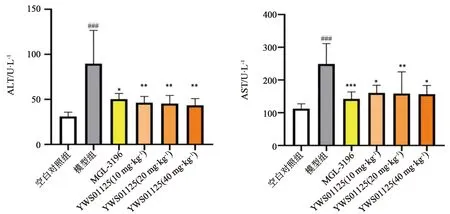
图4 不同治疗组小鼠ALT、AST生化指标的变化 注:与空白对照组比较,###P<0.0001;与模型组比较,*P<0.01,**P<0.001,***P<0.0001
2.6 YWS01125对肝脏组织病理学改变的影响 空白对照组(见图5A)其肝细胞索间界限清晰,胞浆界限明显,肝小叶、肝血窦结构完整,肝细胞围绕中央静脉放射状排列,未见炎症细胞浸润,无病变情况。
造模组(见图5B),其病变情况除肝小叶结构消失,出现了不同程度弥漫性肝细胞肿胀,胞浆疏松,还伴有肝窦略狭窄以及局灶性少量肝细胞坏死伴炎症细胞浸润的病变状况出现。造模组肝脏切片呈现的情况,表明了造模干预使小鼠肝脏产生了明显炎症、出现损伤。
阳性药对照组(见图5C)和YWS01125三个剂量治疗组(见图5D~F)与造模组相比较,小鼠肝细胞肿胀、坏死和炎症程度均有不同程度的改善。肝脏细胞的颜色和形态均较为正常:颜色没有明显变化,形态也比较正常,肝脏细胞偶见有炎性坏死细胞。结果表明哒嗪酮类化合物(YWS01125)对高脂饲料及CCl4所致的慢性肝损伤小鼠模型有一定的治疗作用(图5A~F均为光学显微镜下放大200倍的图片)。

图5 不同治疗组小鼠肝脏HE染色图片
2.7 对脏器指数影响 与空白对照组相比,模型组小鼠的肝脏指数明显增加(P<0.001),模型组小鼠的肝脏出现肿胀、炎症等病变状况,结果表明干预对小鼠肝脏造成明显损伤。与模型组相比,阳性药对照组和YWS01125三个剂量治疗组小鼠肝脏指数均有所减小(P<0.01),表明哒嗪酮化合物YWS01125(10、20、40 mg·kg-1)对慢性肝损伤小鼠模型具有一定的治疗作用(见表2)。

表2 YWS01125 对各组小鼠肝脏指数的影响
3 讨论
近年来,非酒精性脂肪肝动物模型的建立主要分为三类:营养失调性脂肪肝模型、化学诱导与饲料组合模型和基因敲除或基因突变性模型[9]。理想的动物模型应该具备与人类疾病特征尽可能相似,同人类 NAFLD疾病进程一样,成模率高,对动物伤害小,死亡率低,具有一定的可重复性等。作为国内外研究NASH的最佳模型之一,化学诱导与饲料组合操作方法简便、费用较低、重复性好、死亡率低,且建立成功的模型与人类患病的病理生理方面较为相似,缺点是造模周期较长。在 NASH的发病过程中,HFD饮食引起脂肪细胞增生肥大,释放大量FFA,其可与 Toll样受体4结合激活固有免疫通路,进而引发内质网应激和炎症反应。本文C57BL/6J小鼠喂养高脂饲料产生脂肪肝然后使用CCl4加速剂干预8次促使肝脏产生炎症,结果表明高脂饲料加CCl4干预喂养至第20周时小鼠肝脏出现明显的脂肪变性,肝组织有所损伤,出现炎症,可作为NASH治疗模型的制备提供实验依据。
THR-多选择性激动剂作为一种降低脂毒性负荷的方法,临床试验已发现其是通过脂肪酸的分解和促进线粒体生物合成来降低脂肪毒性,改善健康人体的脂质循环并快速去除肝脏脂肪从而达到改善肝功能的作用,还可有效缓解肥胖及降低低密度脂蛋白水平,以THR为靶点的药物在动物和小型临床试验中均表现出较好的降脂性能[10]。THRβ由位于3号染色体上THRβ基因编码,主要在肝脏、脑和肾脏中表达。在多项研究中,显示肝脏特异性表达的THRβ在脂质代谢中发挥重要作用,可有效抑制肝脏甘油三酯合成,增加肝脏胆固醇清除,减少脂质沉积,同时部分增加胰岛素敏感性,促进糖代谢,改善炎症,成为治疗非酒精性脂肪性肝病极具潜力的治疗药物。随着甲状腺素类药物的发展,针对不同组织所存在的不同THR进行个体化治疗已成为当今治疗趋势。本实验结果表明,YWS01125三个剂量组均可以有效降低血清中ALT、AST水平,减轻发生病变肝脏的炎症反应,表明了YWS01125对慢性肝损伤小鼠模型具有一定的治疗作用,为NASH疾病的药物开发提供了一些可行性依据,但其确切作用机制还需进一步研究。

