艾灸对癌性疲劳小鼠JAK-STAT信号通路的影响
李丹 胡凯文 韩丽 赵百孝
癌因性疲劳(Cancer related fatigue,CRF)是一种由肿瘤或者肿瘤治疗引起的与患者体力不成正比,不能通过休息缓解的慢性主观性疲劳。研究表明,在积极治疗阶段,30%~60%癌症患者会经历中度或重度疲劳,而在治疗后一年内30%的患者会经历重度疲劳,在治疗十年后仍有20%患者遗留重度疲劳[1-3]。目前CRF的治疗主要针对贫血、睡眠障碍等的中西药治疗和运动、行为、心理社会干预,尚无确切疗效的药物缓解这一现状[4]。CRF的发病机制尚不明确[5],炎症假说认为长期存在的炎症环境,特别是如白介素-1(interleukin-1,IL-1)、白介素-6(interleukin-1,IL-6)、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)等促炎性细胞因子可诱导机体发热,在CRF中发挥关键作用[6-7]。而IL-6等细胞因子可激活Janus激酶—信号传导子和转录激活子(Janus kinase-signal transducers and activators of transcription,JAK-STAT)信号通路从而加重炎症反应或促进肿瘤的生成导致CRF的恶化[8]。前期研究表明,艾灸可降低IL-1β、IL-6、TNF-α等炎症因子以改善癌性疲劳的状态[9-11]。为了进一步发掘艾灸治疗CRF的作用因素及内在机制,本研究通过观察艾灸及同波长红外线对CRF模型小鼠疲劳跑台实验及悬尾实验等行为学、炎性因子及JAK-STAT信号通路上相关指标的影响,探究艾灸的作用机制及靶点,以期为CRF的中医药防治方案提供实验室依据。
1 材料与方法
1.1 动物与细胞
SPF级7周龄雌性Balb/c小鼠:体质量(20~30) g。由北京维通利华实验动物技术有限公司提供,SPF/VAF级。许可证号:SCXK(京)2016-0006。所有小鼠饲养于SPF级动物室,室温20~25℃,相对湿度60%~80%,保持通风,定时换气,每日光照12小时。4T1小鼠乳腺癌细胞:由中国科学院典型培养物保藏委员会细胞库提供。本实验经北京中医药大学伦理委员会批准(编号:BUCM-2021031104-1071)。
1.2 试剂与仪器
Total RNA Extraction Kit(批号:GPQ1801,GenePool);mRNA/lncRNA qPCR Kit (批号:GPQ1808,GenePool);Jak1 antibody(批号:133666,CST);Phospho-Jak1 antibody(批号:bs-3238R,Bioss);STAT3 antibody(批号:ab31370,Abcam);Phospho-STAT3 antibody(批号:ab76315,Abcam);Actin antibody(批号:ab6276,Abcam);艾条(16 mm×130 mm,北京国医研医药技术开发有限公司)。
超净工作台FLC-3型(哈尔滨市东联);离心机Centrifuge 5415D(Eppendorf);荧光定量PCR仪9600Plus型(中国Bioer Technology);温控摇床TS-2000A(中国其林贝尔);电泳仪PP-1150(中国CAVOY);红外陶瓷/石墨烯智能灸疗仪BXM-02型(北京德源博汇科技有限公司)。
1.3 细胞培养、分组、造模及干预
4T1小鼠乳腺癌细胞,用含10%胎牛血清,100 U/mL青/链霉素的DMEM培养液,置于37 ℃,5%CO2培养箱中饱和湿度下进行培养,细胞呈贴壁生长,2~3天换液传代,选取对数生长期的细胞进行实验。
待小鼠适应性喂养3天后,随机将其分为空白组、模型组、艾灸组、红外组。除空白外,参照欧阳明子等[12]方法,选择1×107个/mL 4T1乳腺癌细胞悬液于小鼠左腋下种植0.1 mL,一周后等到肿瘤大小达到50~100 mm3后,向小鼠腹腔注射顺铂(5 mg/kg)一次,复制CRF小鼠模型。
根据预实验结果,并按人与动物等效剂量换算法,分别算得艾灸干预剂量、时间及频率,即艾灸组在模型组基础上艾灸关元穴;红外组在小鼠关元穴距离5 cm处垂直发射红外光源,输出功率8 W, 红外波长3.9 μm, 辐照面积12.5 cm2进行干预治疗,两组每次干预20分钟,1次/日,一周6次,干预4周。
1.4 行为学检测
1.4.1 疲劳跑台实验 干预完24小时,采用YLS-10B小鼠转轮式疲劳仪研究各组小鼠间疲劳状态,记录小鼠每次实验的奔跑时间、奔跑距离及电击次数。
1.4.2 悬尾实验 将小鼠尾部后1/3处用胶带悬挂于支架上,头部距离台面15 cm,计时6分钟,观察小鼠后四分钟(3~6分钟)的不动时间进行统计。
1.5 组织取材
各组小鼠行为学检测后立即取材。2%戊巴比妥钠(0.2 mL/100 g)腹腔注射麻醉后,摘除眼球取血,置于干净的EP管中,室温静置2小时,3500 r/分钟离心15分钟,取血清置-80℃冰箱保存备用。剥离瘤块,匀浆保存于-80 ℃冰箱备用检测。
1.6 指标检测
1.6.1 血清学指标 采用酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测血清IL-6、TNF-α相关炎性因子浓度。按照试剂盒说明书操作,分别设置不同浓度标准品孔、空白孔和样本孔,加入辣根过氧化物酶标记的检测抗体,37℃恒温箱温育60分钟,弃去液体,重复洗版5次,加入底物,37℃避光孵育15分钟,各孔加入终止液,15分钟内在450 nm 波长处测定各孔的吸光度,通过标准品直线回归计算出浓度相对值。
1.6.2 实时荧光定量PCR法检测Jak1、STAT3及IL-6 mRNA表达 按Total RNA Extraction Kit(DNaseⅠ)试剂盒说明提取肿瘤细胞样本中总RNA并定量,1%琼脂糖凝胶进行电泳,检测RNA的完整性。按mRNA cDNA Synthesis Kit试剂盒说明逆转录合成cDNA,-20℃保存备用。按mRNA/lncRNA qPCR Kit试剂盒说明进行扩增,反应程序为95℃ 30秒,(95℃ 5秒,60℃ 30秒)×45个循环,同时在60~95℃进行融解曲线分析,采用2-△△CT法进行数据的相对表达强度,所有样本均设6个重复。引物序列见表1。

表1 引物序列
1.6.3 Western blot法检测Jak1、Phospho-Jak1、STAT3、Phospho-STAT3蛋白表达 按Protein Extraction Kit(GenePool/GPP1815)试剂盒说明进行瘤体组织BCA法蛋白定量,依照电泳上样量需要用SDS-PAGE Loading Buffer(5×)调整蛋白浓度,100℃煮沸变性10分钟备用。配制12%的分离胶,5%浓缩胶。算得待检测蛋白样品上样量,浓缩胶恒压80V,约20分钟;分离胶恒压120V,电泳至溴酚蓝到凝胶底部。2小时恒流300mA转膜至PVDF膜,5%BSA室温封闭1小时。将PVDF膜置于杂交袋中,分别加入配制好的一抗4℃孵育过夜。TBST缓冲液洗膜3次,每次10分钟,加入相应二抗,室温孵育1小时。TBST缓冲液洗膜3次,每次10分钟。按ECL Plus Western Blot Kit试剂盒说明暗室中曝光,显影并定影。条带灰度值采用Quantity One v.4.6.2软件进行读取,除以内参Actin灰度值,即得样品中目标蛋白的相对表达量,所有样本均设6个重复。
1.7 统计学方法

2 结果
2.1 Balb/c小鼠行为学检测
Balb/c小鼠干预4周后通过检测疲劳跑台实验和悬尾实验验证机体和精神两方面疲劳,如下表所示,与空白组相比,模型组小鼠跑台时间、距离均显著降低(P<0.01),电击次数和悬尾不动时间显著增加(P<0.01),证明癌性疲劳小鼠模型复制成功。与模型组比较,艾灸组、红外组均增加了小鼠的跑台时间、距离(P<0.05),降低了小鼠跑台的电击次数和悬尾不动时间(P<0.05)。与红外组比较,艾灸组小鼠的跑台疲劳时间、距离有增加趋势,电击次数减少(P>0.05),悬尾不动时间减少(P<0.05),说明模型组造模成功,艾灸及红外治疗能缓解CRF小鼠的疲劳状态。见表2、3。

表2 各组小鼠疲劳跑台实验结果比较

表3 各组小鼠悬尾实验结果比较分钟)
2.2 ELISA法检测IL-6、TNF-α含量
如下图所示,ELISA 提示小鼠血清中IL-6及TNF-α 含量较空白组显著上升,组间差异有统计学意义(P<0.01);经艾灸及红外灸疗仪干预治疗后小鼠血清中IL-6及TNF-α含量减少,组间差异有统计学意义(P<0.05);与红外组比较,艾灸组小鼠血清中IL-6及TNF-α含量降低,组间差异有统计学意义(P<0.05),说明艾灸及红外照射治疗能改善CRF小鼠的炎症状态。见表4。
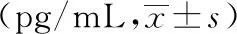
表4 各组小鼠血清IL-6、TNF-α水平比较
2.3 RT-PCR法检测Jak1 mRNA、STAT3 mRNA及IL-6 mRNA表达
小鼠经艾灸及红外灸疗仪干预后小鼠肿瘤组织中的Jak1 mRNA、STAT3 mRNA及IL-6 mRNA表达减少,组间差异有统计学意义(P<0.05);与红外组比较,艾灸组小鼠瘤体组织的Jak1 mRNA、STAT3 mRNA及IL-6 mRNA降低,组间差异有统计学意义(P<0.05),说明艾灸及红外照射治疗能下调CRF小鼠的Jak1 mRNA、STAT3 mRNA及IL-6m RNA的表达,激活JAK-STAT信号通路。见表5。

表5 各组小鼠瘤体组织JAK1、STAT3、IL-6 mRNA表达水平比较
2.4 Westernblot法检测Jak1、Phospho-Jak1、STAT3、Phospho-STAT3蛋白的表达
艾灸组小鼠肿瘤组织P-Jak1与P-STAT3表达较模型组降低,组间差异有统计学意义(P<0.05);红外组小鼠肿瘤组织P-Jak1与P-STAT3表达较模型组降低,组间差异有统计学意义(P<0.05);说明艾灸及红外治疗能下调P-Jak1与P-STAT3蛋白的表达。图1、表6。

表6 各组小鼠瘤体组织P-Jak1/JAK1、P-STAT3/STAT3蛋白表达水平比较
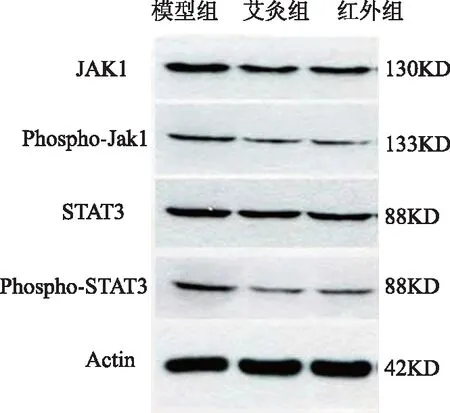
图1 Jak1、Phospho-Jak1、STAT3、Phospho-STAT3蛋白条带图
3 讨论
癌性疲劳隶属中医理论中“虚证”和“虚劳”范畴, 《黄帝内经》曰“虚者补之、陷下则灸之”,说明艾灸疗法可以较好地改善虚劳下陷等病症。现代研究揭示,刘晓荣[13]、霍雨佳等[14]根据《素问·阴阳应象大论篇》中所阐述的“形不足者,温之以气”及李东垣的“脾主五脏元气”的理论,观察艾灸神阙、关元、气海、中脘、足三里对CRF的影响,发现艾灸能够改善癌症患者的疲乏症状及生活质量。
JAK-STAT通路是一条参与细胞生长、发育、凋亡的重要细胞因子信号通路[15],该通路的异常活化被证明在肿瘤细胞的克隆性增殖和分化中发挥了重要作用[16]。JAK是一类非特异受体型酪氨酸激酶,主要包含四个亚型,分别为JAK1、JAK2、JAK3和TYK2,并能被包括IL-6在内的多种炎症介质和细胞因子活化,继而激活JAK-STAT信号通路,参与到多种疾病的发生发展[8]。白细胞介素6(interleukin6,IL-6) 是一种多功能细胞因子,在炎症反应网中占有重要地位。IL-6与其受体结合后可通过3条信号通路发挥生物学功能:JAK/STAT途径、Ras/Erk途径和PI3K介导的途径[17-19]。IL-6与IL-6Rα和gp130两个受体结合后,通过磷酸化JAK而激活STAT3转录因子,磷酸化的STAT3形成二聚体,转移至细胞核中,使JAK/STAT3信号通路持续激活而引起肿瘤组织的增长[17,20-21]。IL-6在癌症患者中表达增高,而JAK-STAT通路参与了IL-6介导的免疫细胞炎症反应,表明炎症因子IL-6与JAK-STAT通路可能与促进肿瘤或者癌性疲劳机制有关[22-23]。另外,研究表明,TNF-α、IL-6能抑制促红细胞生成素,减少血红蛋白的产生及活动耐受力,亦能导致癌性发热,使机体长期处于消耗性状态,在CRF的发生过程中起关键作用[24-25]。
艾灸能直接激活JAK/STAT3信号通路调节炎症状态。杨馨等[26-27]通过干预滑膜细胞内JAK-STAT信号通路及分泌功能,证明艾灸能有效改善动物RA滑膜炎症。赵继梦等[28]运用隔药灸抑制了NF-κB通路和STAT3的磷酸化, 减少了IL-6、IL-1β的释放,从而缓解了肠炎模型大鼠的结肠炎症。斐建等[29]发现艾灸可通过JAK-STAT3信号通路调节肿瘤微环境。
本研究中,CRF模型小鼠通过疲劳跑台实验和悬尾实验两方面反映了荷瘤小鼠的疲劳状况。如结果所示,各实验组疲劳度由高到低依次为:模型组、红外组、艾灸组、空白组,证明癌性疲劳小鼠模型复制成功,艾灸及红外灸疗仪均能有效缓解CRF小鼠的疲劳状态,艾灸治疗作用更显著。炎症因子作为癌性疲劳的发病机制假说之一,本实验示,与空白组相比,模型组小鼠血清中IL-6、TNF-α的含量明显升高,同国内外研究结果一致。与模型组比较,红外组、艾灸组均有效缓解了CRF鼠的炎症状态。在探究艾灸及红外光治疗癌性疲劳的作用机理中,JAK-STAT信号通路的各效应分子的表达也受到不同程度影响。其中, 与模型组比较,红外组与艾灸组可明显降低CRF小鼠P-JAK1、P-STAT3蛋白表达,IL-6、JAK1及STAT3mRNA的表达,提示艾灸及红外灸可通过不同程度下调JAK-STAT信号通路,调节炎症因子,起到抗癌性疲劳的作用。此外,与红外组比较,艾灸组明显降低了血清中IL-6、TNF-α的含量,减少了Jak1 mRNA、STAT3 mRNA及IL-6 mRNA的表达,P-JAK1、P-STAT3的蛋白表达上有降低的趋势,说明艾灸组对JAK-STAT信号通路的影响上优于红外组,填补了国际上观察传统艾灸与红外灸对CRF疗效比较及相关机制的空白,也进一步揭示了艾灸的作用机理。
总之,IL-6介导的JAK-STAT信号通路相关的炎症反应在CRF的发生与进展中起重要作用。本研究表明,艾灸可不程度降低荷瘤及顺铂导致的癌性疲劳,其中红外光发挥了关键作用,其机制可能是通过下调IL-6、TNF-α及JAK-STAT信号通路的表达发挥作用,该研究结果可为艾灸治疗CRF提供一定科学依据。

