艾司洛尔对脓毒性休克患者血流动力学及预后的meta 分析
隋明亮,吴长江,胡贤著,黄超发,杨雅迪,杨进虎,汤卫兵
(上海交通大学医学院附属苏州九龙医院 重症医学科,江苏 苏州 215028)
0 引言
脓毒性休克是ICU内主要的致死病因之一,且治疗费用高[1-3]。2002年的巴塞罗那宣言倡导全球的拯救脓毒症运动(surviving sepsis campaign,SSC),在2004年公布了第一版SSC的指南,并相继在2008年、2012、2016年基于新的研究证据而更新[4-5]。希望通过提高临床医师对严重脓毒症和感染性休克的认识,降低病死率。尽管抗感染治疗和器官功能支持技术取得了长足的进步,但脓毒症的病死率仍居高不下。
据文献报道,β受体阻滞剂能够调节脓毒性休克患者的心血管变化,并可能在代谢、免疫和凝血水平上产生重要变化[6-8]。艾司洛尔可根据心率下降的百分比减少心输出量,而不会对氧合产生不利影响[9]。一些随机对照试验结果显示在脓毒症患者中输注艾司洛尔可改善组织代谢和ScvO2,减少ICU住院时间和28d死亡率[10-11]。而另一些随机对照试验得出结论是艾司洛尔对脓毒症患者ScvO2及血流动力学的没有影响[12,13]。目前,艾司洛尔治疗脓毒性休克患者是否真正改善患者的血流动力学及预后尚不能最终定论。本研究对现有随机对照试验采用Meta分析方法进行全面的客观评价,以期为临床应用提供决策依据。
1 资料与方法
1.1 一般资料
①符合国际脓毒性休克定义的诊断标准(2001年SCCM/ ESICM/ACCP/ATS/SIS、2012年严重脓毒症和脓毒性休克治疗指南、2016年严重脓毒症和脓毒性休克治疗指南[4,5,14,15])且心率≥95次/分的患者;②纳入研究中,试验组和对照组的基本情况基本一致,具有可比性。
1.2 干预措施
试验组:常规予以抗感染、液体复苏、对症及营养支持治疗,有脏器衰竭者给予相应支持治疗的基础上,加用艾司洛尔治疗;对照组:单用常规治疗。
1.3 排除标准
①研究对象为非脓毒性休克患者;②综述文献;③结果指标未包括结局指标;④以动物为研究对象的文献;⑤中文及英文以外的文献。
1.4 文献检索
计算机检索PuhMed、Cochrane library、EMBASE、MEDLINE、OVID、中国生物医学文献数据库(CBM)、中国知网(CNKI)、万方数据库和维普数据库中关于艾司洛尔治疗脓毒症临床疗效的随机对照试验(RCTs),凡文中提到随机、随机分组,即视为RCT。语种限定为英文和中文。检索时间2008年1月-2020年7月。英文检索词为“esmolol”“beta blockers”“septic shock”“sepsis”,中文检索词为“艾司洛尔”“β受体阻滞剂”“感染性休克”“脓毒性休克”。
1.5 文献筛选
文献由2名研究者严格按照制定的纳入和排除标准进行筛选,独立进行质量评价、数据提取并交叉核对,遇到分歧与第3名研究者讨论决定。同一研究多处发表时采用数据最完整的一篇纳入。未能获取全文信息的通过邮件与通信作者等联系。
1.6 质量评价
鉴于原始Jadad量表在分配方案隐藏上的不足,本研究采用改良后的Jadad量表进行文献质量评价。其中随机、分配隐藏和双盲分别占2分,退出与失访占1分。因此,修改后的Jadad量表总分为7分,1-3分视为低质量,4-7分可视为高质量[16]。
1.7 数据提取
数据提取采用自制表格,主要内容:①研究基本信息:纳入研究的编号、引用题录和通信作者等;②研究对象特征两组患者的基本情况;③试验设计和样本量;④干预措施:药物名称、剂量和给药时间;⑤结局指标:主要指标:28d病死率;次要指标:心率(HR)、平均动脉压(MAP)、中心静脉血氧饱和度(ScvO2)、血乳酸(LAC)、心脏指数(CI)、每搏量指数(S V I)、全心舒张末期血容积指数(GEDVI);⑥文献质量评价指标。
对于分类变量分别提取试验组和对照组各自的发生目标事件的人数和未发生目标事件的人数;对于连续性变量分别提取各组试验前后效应值的均数和标准差。
1.8 统计学方法
采用stata 12.0软件进行meta分析。计数资料采用相对危险度(relative risk,RR),连续性变量采用标准化均方差(standard mean difference,SMD )为效应量,区间估计使用95% 置信区间(confidence intervals,CI)表示。对纳入研究的异质性采用χ2检验,若I2<50%且P>0.10,尚不能认为研究间存在异质性,采用固定效应模型分析,若I2>50%且P≤0.10,提示多个同类研究的结果存在异质性,分析异质性来源后采用亚组分析或随机效应模型,通过敏感性分析检验结果的稳定性。P<0.05 表示差异具有统计学意义。
2 结果
2.1 文献检索及数据提取
初检获取文献286篇,通过阅读标题和摘要进行初筛后剩余26篇。进一步阅读全文,根据制定的纳入和排除标准,结合文献质量评价,最终纳入9篇[11-13,17-21]随机对照试验,文献筛选流程见图1。共入组795例患者,其中实验组398例,对照组397例。各纳入研究的基本情况见表1。
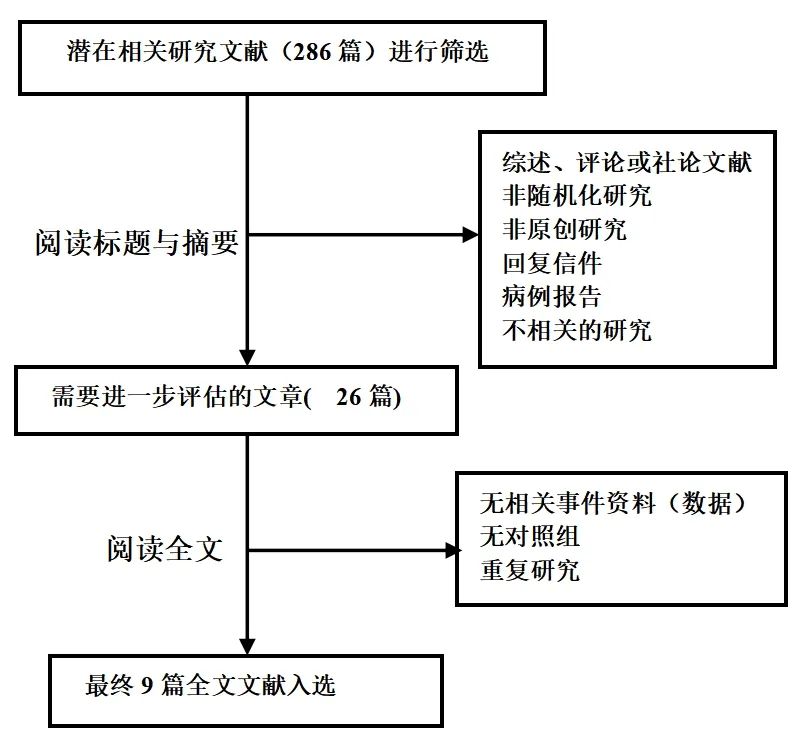
图1 文献筛选流程图
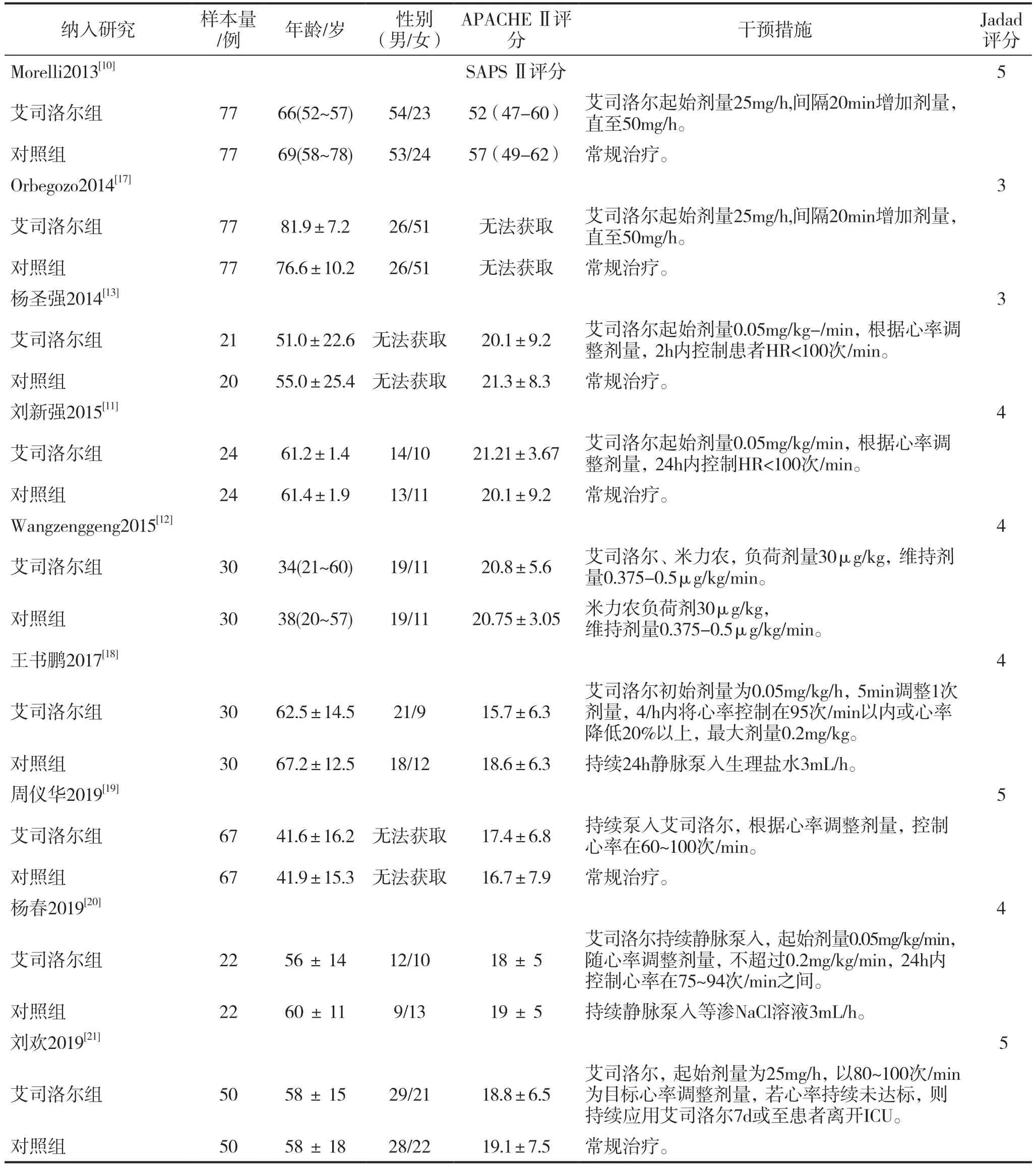
表1 纳入研究的基本特征
2.2 纳入文献的质量评价
采用修改后的Jadad量表对文献进行质量评价[16]。纳入的9个研究基线资料均具有可比性,研究均为随机对照试验,4个研究实施双盲,其他研究未提及盲法,2个研究报道了失访和退出例数。
2.3 统计分析结果
2.3.1 主要结局指标:28d 病死率
7个研究[10,11,12,18-21](n=600)报道了治疗后28天病死率,28d病死率组异质性检验的结果显示I2=18.5%,P=0.289,尚不能认为研究间存在异质性,故采用固定效应模型进行数据合并。文献的分析结果均表明在降低病死率方面,艾司洛尔组的疗效优于常规治疗[RR=0.67,95% CI(0.56,0.79),P<0.05],差异均具有统计学意义(图2)。
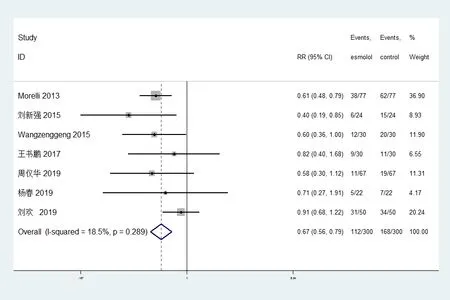
图2 艾司洛尔组与对照组28天病死率比较的森林图
2.3.2 次要结局指标
7个研究[10-13,18-20](n=541)观察了不同时间两组平均动脉压的变化;7个研究[10-13,18,20,21](n=507)均报道了艾司洛尔组与对照组对感染性休克患者心率的影响;5个研究[11,13,18,20,21](n=293)均报道了艾司洛尔对脓毒症休克患者血乳酸值的影响;3个研究[11,13,20](n=133)均报道了艾司洛尔对脓毒症休克患者中心静脉血氧饱和度的影响;各项研究有明显的异质性,故采用随机效应模型进行数据合并。Meta分析结果显示,48小时组MAP [SMD=-1.56,95% CI(-2.86,-0.25),Z=2.34,P=0.049];HR[SMD=-1.94,95% CI(-2.82,-1.06),Z=4.32,P<0.05];LAC[SMD=0.43,95% CI(-0.38,1.23),Z=1.04,P=0.299];ScvO2[SMD=1.38,95 %CI(-0.46,3.22),Z=1.47,P=0.142](图3)。艾司洛尔组心率和平均动脉压低于常规治疗组,差异均具有统计学意义。与常规组相比血乳酸和中心静脉血氧饱和度差异无统计学意义。
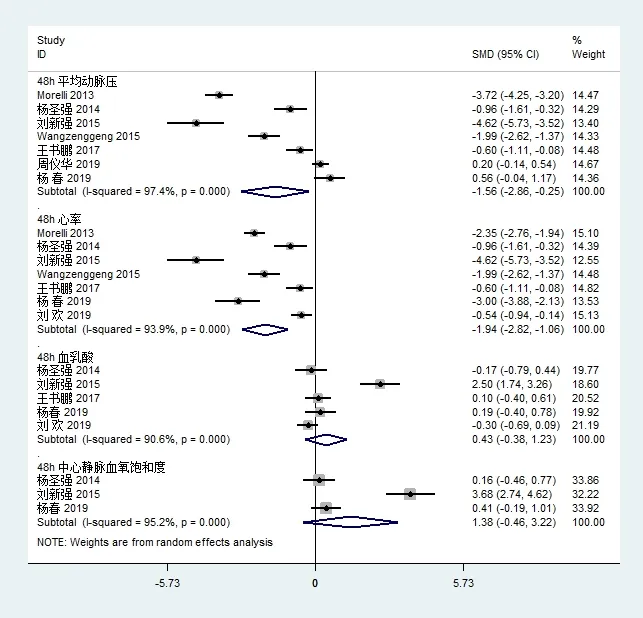
图3 艾司洛尔组与对照组平均动脉压、心率、血乳酸和中心静脉血氧饱和度比较的森林图
3个研究[12,13,20](n=145)观察了不同时间两组心排血指数(CI)的变化;5个研究[11-13,18,20](n=253)均报道了艾司洛尔组与对照组每搏量指数(SVI)的变化;2个研究[13,20](n=85)报道了艾司洛尔对脓毒症休克全心舒张末容积指数(GEDVI)的影响;各项研究有明显的异质性,故采用随机效应模型进行数据合并。48小时组CI[SMD=-0.83,95%CI(-1.82,0.15),Z=1.98,P=0.058];SVI[SMD=0.42,95%CI(-0.15,0.98),Z=1.44,P=0.15];GEDVI[SMD=0.81,95%CI(0.37,1.25),Z=3.57,P<0.05](图4)。
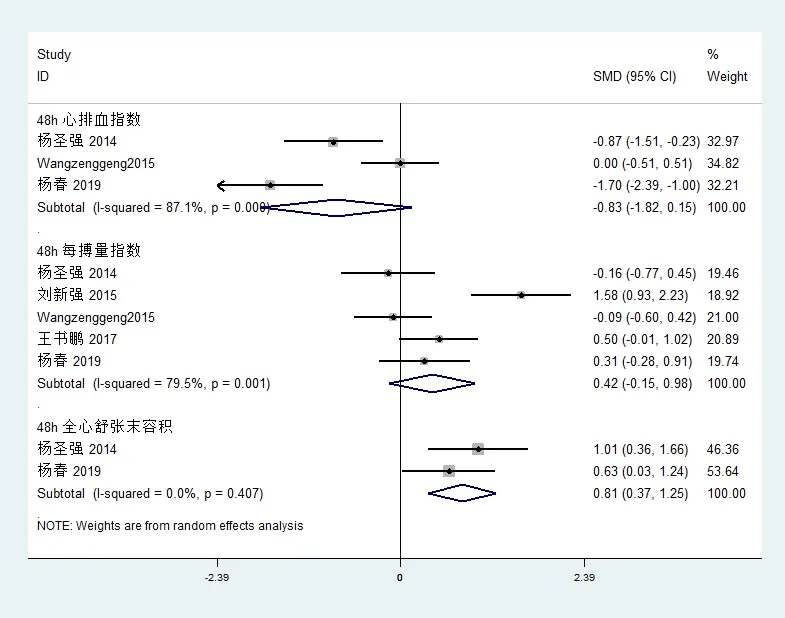
图4 艾司洛尔组与对照组心排血指数、每搏量指数、全心舒张末期血容积指数比较的森林图
2.3.3 相关文献主要结局指标的发表性偏倚评价
以死亡率相对风险比的对数为横坐标,以其对数的标准误为纵坐标绘制漏斗图同时行Begg检验,对纳入的7项研究[10,11,12,18-21]的发表性偏倚进行分析(图5),结果漏斗图基本对称,Begg检验结果为Pr>|z|=0.881,尚不能认为主要结局指标的各研究间存在发表偏倚。
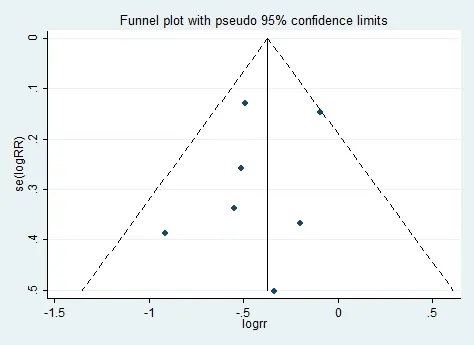
图5 纳入研究的漏斗图
3 讨论
本次系统评价的结果显示,短效β受体阻滞剂艾司洛尔可以降低脓毒性休克患者的心率、28d病死率,改善全心舒张末期血容积指数,可降低平均动脉压。但对中心静脉血氧饱和度、血乳酸、心脏指数、每搏量指数等无明显影响。
本研究结果显示艾司洛尔可降低脓毒性休克患者28d的病死率。但纳入的7篇RCT研究中,其中占比较大的两项研究:Morelli2013[10](n=154)等的研究,两组病人均有一部分患者输注了左西孟旦;而Wangzenggeng 2015[12](n=60)等的研究,实验组和对照组均使用了米力农。有研究发现左西孟旦及米力农可能改善脓毒性休克患者的死亡率[22,23]。本分析结果得出的降低28d病死率的结论有待多中心、大规模的RCT 研究进一步证实。但是,目前已有较多的临床研究支持此结论。Singer KE等[6]研究发现,入院前使用β受体阻滞剂可以降低脓毒症患者30d的病死率。Macchia A等[24]回顾性研究发现,长期接受β受体阻滞剂治疗的患者发生脓毒症后的死亡率更低。
在血流动力方面,评价结果显示艾司洛尔可降低脓毒性休克患者的心率和改善全心舒张末期血容积指数,但对患者的CI和SVI无明显影响。艾司洛尔显著降低脓毒性休克患者的心率,可以更好地延长心室舒张期,使得心室舒张末期血容积增加。Brown SM等[25]关于脓毒性休克患者超声心动图的一项研究显示,脓毒性休克患者舒张功能障碍发生率远高于收缩功能障碍。Sanfilippo F等[26]对脓毒症心脏舒张功能障碍的一项Meta分析显示,心脏舒张功能不全可预测脓毒性休克患者的死亡率,β受体阻滞剂可以改善脓毒症患者心脏的舒张功能,与本研究结果一致。
在本研究还显示艾司洛尔可降低脓毒性休克患者的MAP,但对全身供氧及组织灌注指标LAC和ScvO2无明显影响。MAP的合并结果接近等效线,差异虽有统计学意义,但得出的结论仍需更多大规模的RCT研究进一步证实。此结果至少说明随着用药剂量的不断加大,艾司洛尔可能表现出一定的负性肌力作用,应用过程中可考虑合用一些正性肌力药物,同时应严密监测血流动力学及组织灌注等指标。另外需要注意是,目前应用艾司洛尔的临床应用时机仍有争议[27]。脓毒性休克患者早期应用艾司洛尔应在充分液体复苏的基础上使用,以防止导致器官灌注不足,加重重要脏器损害。
目前关于艾司洛尔治疗脓毒性休克的多中心大样本随机对照试验数据欠缺,本次系统评价纳入的文献均为小样本临床试验,研究间给药时间、给药剂量等差异较大。纳入的7篇国内研究,多数在方法学上存在局限性,对分配隐藏及意向性分析报道不详,提示纳入研究存在选择偏倚及测量偏倚的可能。艾司洛尔能否改善脓毒性休克患者的预后,需要长期随访的大样本随机对照试验予以评价。

