利心冲剂通过SIRT3/PFKFB3/HIF-1α信号通路促进心肌梗死后心力衰竭小鼠心肌血管新生的作用机制
陆文江,刘雨辰,高 想,苏忆玲,王 力,陆 齐
心力衰竭是各种心血管疾病发展到严重阶段的临床综合征,严重威胁人类健康,且具有高患病率、高花费和预后差的特点,是严重的世界公共卫生问题之一[1-2]。随着介入技术的进步和新型溶栓药物的应用,心肌梗死后心力衰竭越来越常见。中医学认为心力衰竭的基本病理机制为心气虚乏、心阳式微、瘀阻水停[3],与现代医学心力衰竭的描述基本一致。现代医学认为,血液在体内运行主要是通过心脏推动的,由于心脏血管减少,纤维化增加,心脏泵血功能受损,导致心力衰竭[4],因此,促进血管新生、抑制纤维化显得极为重要。目前,临床治疗心力衰竭的药物主要分为强心苷和非强心苷[5]。然而,这些药物治疗心力衰竭作用有限,因而,寻找治疗心力衰竭的新型药物具有重要的临床意义。
中医学对心力衰竭的认识与治疗研究有数千年的历史,积累了宝贵的经验。利心冲剂为朱良春大师苦心研究数十年的经典处方,由益母草、葶苈子、补骨脂、黄精和黄芪组成,针对心气虚乏、心阳式微、瘀阻水停心力衰竭的病理变化,以黄芪和黄精补心气,补骨脂温阳气、振肾气治其本;以益母草益气活血利水,葶苈子泻肺利水、通利水停瘀阻治其标[6]。利心冲剂诊治心力衰竭的临床实践中取得了显著的疗效[7],但利心冲剂的作用机制尚未明确。本研究通过检测心肌梗死后心力衰竭小鼠心肌组织沉默调节蛋白3(SIRT3)/6-磷酸果糖-2-激酶/果糖-2,6-双磷酸酶3(PFKFB3)/缺氧诱导因子1α(HIF-1α)的表达,探讨利心冲剂促进心肌梗死后心力衰竭小鼠心肌血管新生的可能机制。
1 材料与方法
1.1 实验动物 无特定病原体(SPF)级C57BL/6J雄性小鼠250只,鼠龄均为8周龄,体质量18~20 g,购自南通大学动物房[合格证号:SCXK(沪)2017-0005]。动物实验符合南通大学动物伦理委员会要求,伦理审查批号为S20190520-011。
1.2 实验药物与试剂 利心冲剂由益母草、黄精、葶苈子、补骨脂、黄芪免煎颗粒按10∶5∶4∶4∶10调和而成(江阴天江药业有限公司生产,批号分别为18122691,19030231,19010271,18111191,18120871),均购自南通市中医院中药房;美托洛尔(阿斯利康制药有限公司生产,批号H32025391);SIRT3(武汉塞维尔公司生产,批号GB11354);血管内皮生长因子(VEGF,武汉塞维尔公司生产,批号GB11034);HIF-1α(武汉塞维尔公司生产,批号GB11031);PFKFB3(美国Abcam公司,批号AB181861);一抗、二抗(武汉塞维尔公司生产,批号GB23301);2,2-联喹啉-4,4-二甲酸二钠(BCA)蛋白试剂盒(武汉塞维尔公司生产,批号G2026);凝胶配制盒(武汉塞维尔公司生产,批号G2003);蛋白Marker(美国Therm公司生产,批号26616);RNA提取液(武汉塞维尔公司生产,批号G3013);异丙醇(昆山裕隆化工生产,批号80109218)。
1.3 实验仪器 酶标检测仪(Rayto公司,型号Rt2100c);电子天平(苏州克瑞斯公司,型号PX125DH);冷冻离心机(美国heal force公司,型号neofuge 13R);电泳仪(美国BIO-RAD公司,型号1645050);转膜仪(美国BIO-RAD公司,型号170-4070);冰箱(西门子,型号BCD-186);扫描仪(美国EPSON公司,型号V300);匀浆仪(日本PRO公司,型号01-02300PC);高速离心机(中国凯达公司,型号KH19A);荧光定量酶联免疫吸附(RT-qPCR)仪(美国ABI公司,型号Stepone plus);超纯水机(宏森科技公司,型号VE-10LH-E11);小动物心脏彩超(加拿大VisualSonics公司,型号Vevo®1100)。
1.4 动物模型制备 C57BL/6J雄性小鼠适应性饲养7 d,行左冠状动脉前降支结扎手术或对照手术。术前12 h禁食、4 h禁水。将气体麻醉(异氟烷)后小鼠固定在手术台上,乙醇消毒切口。在小鼠左胸部切一1.0 cm切口,钝性分离胸部肌肉,在心脏搏动最明显处使用血管钳分离肋间隙,同时将心脏迅速挤出,分离心包;于左心耳下1 mm处,以6-0 proline丝线结扎左冠状动脉前降支,进针时不要刺破心脏;将心脏快速回纳胸腔,挤出胸内血气,丝线关胸,即刻采用小动物心电图仪测量小鼠心电图,心电图可见Ⅱ导联ST段较手术前抬高0.2 mV以上视为造模成功;摘除麻醉面罩,小鼠1 min内苏醒。对照组给予相同手术但只穿线不结扎前降支。
1.5 分组、给药方法 C57BL/6J雄性小鼠结扎左前降支构建心肌梗死模型,4周后通过小鼠心脏彩超检测心力衰竭指标排除非心力衰竭小鼠。将小鼠随机分为对照组、模型组、利心冲剂低剂量组(28 g/kg)、利心冲剂高剂量组(56 g/kg)和美托洛尔组(0.06 g/kg),各20只小鼠。给药组小鼠给药方式为灌胃,对照组和模型组给予同体积生理盐水灌胃。各组小鼠连续给药4周,每日1次。
1.6 观察指标
1.6.1 心功能指标 采用小动物心脏彩超测定小鼠心功能,包括左室射血分数(LVEF)、左室短轴缩短率(LVFS)、左室收缩末期内径(LVESD)和左室舒张末期内径(LVEDD)。
1.6.2 小鼠体质量和心脏体质量比 使用异氟烷麻醉小鼠后,采用电子天平分别称取各组小鼠体质量,之后处死小鼠取出心脏,挤出血液,使用生理盐水充分漂洗沾干水分,分别称取各组小鼠心脏重量,计算心脏体质量比,之后将心脏置入-80 ℃冰箱冷冻备用。
1.6.3 小鼠心肌四氮唑(TTC)染色 取出小鼠心脏,使用自来水洗净血液,吸干水分后置入-80 ℃冰箱10 min。取出后延左室长轴切成1 mm薄片加入TTC染料,置于37 ℃水浴箱中水浴20 min,取出后甲醛固定,体视显微镜拍照。使用Image J处理图像,白色部分为梗死区,梗死区面积除以心肌总面积计算梗死比,同时进行组间比较。
1.6.4 Masson染色 将小鼠心肌切片脱蜡后使用自来水与蒸馏水依次冲洗,应用Regaud苏木精染色6 min,之后蒸馏水洗5 min,复染8 min。2%冰醋酸洗10 s,置于1%水溶磷钼酸液中4 min;直接应用苯胺蓝染5 min;再以2%冰醋酸水溶液浸洗;最后用中性树胶封固拍片,蓝色为纤维组织采用Image J处理,纤维化面积除以心肌总面积计算纤维化占比,同时进行组间比较。
1.6.5 苏木精-伊红(HE)染色 取心肌石蜡切片60 ℃烤片2 h,趁热将其移入二甲苯Ⅰ、Ⅴ中脱蜡2 h,分别采用二甲苯Ⅱ、Ⅲ、Ⅳ脱蜡过夜。采用100%,95%,90%,80%乙醇梯度水化,每次5 min,再使用蒸馏水漂洗3次,每次5 min。染色(苏木素)10 min,冲洗3 min,后分化10 s(1%盐酸乙醇),再次冲洗 5 min,复染 3 min(伊红),冲洗 1 min。依次使用80%,90%,95%,100%乙醇脱水,每次 5 min,待乙醇挥发后封片,使用显微镜观察小鼠心肌组织结构改变。
1.6.6 免疫组化CD31染色 将待检组织用4%的多聚甲醛室温固定过夜,固定好组织,使用薄刀片切成约2 mm薄片,加入目标抗体(CD31抗体)产生抗原抗体反应。CD31染色后,可见被CD31染成棕色的阳性细胞。计数血管密度(MVD)。人工计算5张图片棕色点数,之后总点数除以5张图片总面积得到单位血管点数,取平均值作为MVD。
1.6.7 RT-qPCR检测小鼠心肌炎性因子白细胞介素6(IL-6)、肿瘤坏死因子α(TNF-α)和核转录因子κB(NF-κB)表达 取心肌组织约100 mg,按步骤提取总RNA,之后逆转录,使用RT-qPCR 仪进行扩增,预变性,95 ℃ 1 min;PCR反应,40个循环,95 ℃ 10 s,60 ℃ 30 s,内参基因为GAPDH,转录水平采用公式2-△△Ct计算。引物均由武汉Servicebio公司设计合成:GAPDH正向引物为CCTCGTCCCGTAGACAAAATG,反向引物为TGAGGTCAATGAAGGGGTCGT;IL-6正向引物为TTCTTGGGACTGATGCTGGTG,反向引物为GCCATTGCACAACTCTTTTCTC;TNF-α正向引物为CCCTCACACTCACAAACCACC,反向引物为GCCATTGCACAACTCTTTTCTC;NF-κB正向引物为AAGCACAGATACCACCAAGACAC,反向引物为CGCACTGCATTCAAGTCATAGTC。
1.6.8 蛋白免疫印迹法测量心肌组织SIRT3、PFKFB3、HIF-1α和VEGF蛋白表达 将心肌组织应用冷磷酸缓冲盐溶液(PBS)洗涤3次,漂洗干净后切成小块置入匀浆管中彻底匀浆。以12 000 r/min离心10 min,收集上清液。测定上清液蛋白浓度,以4∶1比例加入缓冲液,使用100 ℃开水变性15 min,置入冰箱备用。按实验所需配液,配电泳液加入目的蛋白电泳2 h之后湿转膜90 min,使用牛奶封闭2 h取膜TBST冲洗2 min,孵一抗过夜之后用TBST将膜冲洗干净,避光孵二抗2 h再用TBST洗膜,配荧光液拍照,分别用PhotoShop和Alpha软件分析光密度值。
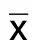
2 结 果
2.1 实验完成情况 喂养、给药过程中,对照组2只小鼠死亡,模型组10只小鼠死亡,利心冲剂低剂量组6只小鼠死亡,利心冲剂高剂量组3只小鼠死亡,美托洛尔组3只小鼠死亡。
2.2 各组小鼠LVEF、LVFS、LVEDD、LVESD比较 与对照组比较,模型组小鼠LVEF、LVFS降低,LVEDD、LVESD升高(P<0.01);与模型组比较,利心冲剂低剂量组小鼠LVEF、LVFS升高,LVEDD、LVESD降低(P<0.05);与利心冲剂低剂量组比较,利心冲剂高剂量组小鼠LVEF、LVFS升高,LVEDD、LVESD降低(P<0.05)。详见图1、表1。
图1 各组小鼠心脏彩超图(×200)
表1 各组小鼠LVEF、LVFS、LVEDD、LVESD比较(±s)
2.3 各组小鼠体质量、心脏重量和心脏体质量比比较 与对照组比较,模型组体质量下降,心脏重量增加,心脏体质量比升高(P<0.01);与模型组比较,利心冲剂低剂量组体质量增加,心脏重量和心脏体质量比降低(P<0.05);与利心冲剂低剂量组比较,利心冲剂高剂量组体质量增加,心脏重量和心脏体质量比降低(P<0.05)。详见表2。
表2 各组小鼠体质量、心脏重量和心脏体质量比比较(±s)
2.4 各组小鼠TTC染色改变 与对照组比较,模型组梗死区比例明显增加(P<0.01);与模型组比较,利心冲剂低剂量组梗死区比例降低(P<0.05);与利心冲剂低剂量组比较,利心冲剂高剂量组梗死区比例降低(P<0.05)。详见图2、表3。
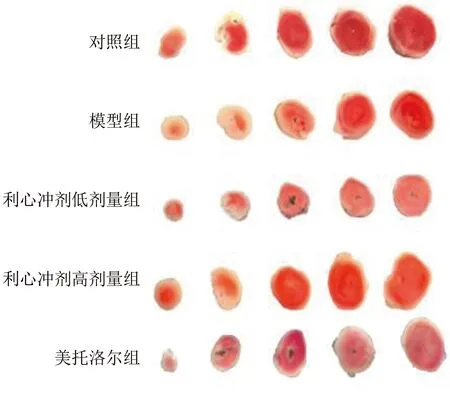
图2 各组小鼠梗死区TTC染色图(×200)
表3 各组小鼠梗死区比例比较(±s) 单位:%
2.5 各组小鼠Masson染色改变 与对照组比较,模型组Masson染色最深,心肌纤维化最严重(P<0.01);与模型组比较,利心冲剂低剂量组Masson染色改善明显,心肌纤维化减轻(P<0.01);与利心冲剂低剂量组比较,利心冲剂高剂量组Masson染色减轻最明显,心肌纤维化最轻(P<0.01)。详见图3、表4。
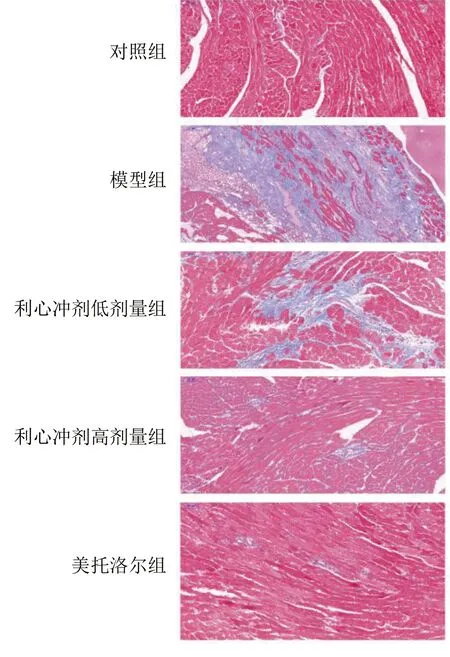
图3 各组小鼠心肌纤维化改变Masson染色图(×200)
表4 各组小鼠心肌纤维化比例比较(±s) 单位:%
2.6 各组小鼠心肌组织病理结构改变 模型组小鼠心肌细胞由正常的圆形或椭圆形变为长杆状且排列紊乱,可见细胞碎裂、坏死。利心冲剂各剂量组心肌细胞排列相对规则,细胞碎裂、坏死相对较少,其中利心冲剂高剂量组细胞排列整齐,细胞碎裂、坏死最少,与美托洛尔组形态相似。详见图4。

图4 各组小鼠心肌组织HE染色图(×200)
2.7 各组小鼠免疫组化CD31染色改变 与对照组比较,模型组MVD减少(P<0.01);与模型组比较,利心冲剂低剂量组MVD增加(P<0.05);与利心冲剂低剂量组比较,利心冲剂高剂量组MVD增加(P<0.05)。详见图5、表5。

图5 各组小鼠免疫组化CD31染色图(MVD,×200)
表5 各组小鼠MVD比较(±s) 单位:个/高倍镜
2.8 各组小鼠血清 IL-6、TNF-α、NF-κB比较 与对照组比较,模型组IL-6、TNF-α、NF-κB水平升高(P<0.01);与模型组比较,利心冲剂低剂量组小鼠IL-6、TNF-α、NF-κB水平降低(P<0.01);与利心冲剂低剂量组比较,利心冲剂高剂量组IL-6、TNF-α、NF-κB明显降低(P<0.01)。详见表6。
表6 各组小鼠心肌IL-6、TNF-α、NF-κB比较(±s)
2.9 各组小鼠心肌SIRT3、PFKFB3、HIF-1α和VEGF蛋白表达比较 与对照组比较,模型组小鼠SIRT3、PFKFB3、HIF-1α和VEGF蛋白表达变化不明显,差异无统计学意义(P>0.05)。与模型组比较,利心冲剂低剂量组SIRT3、PFKFB3、HIF-1α和VEGF蛋白表达增加(P<0.05);与利心冲剂低剂量组比较,利心冲剂高剂量组SIRT3、PFKFB3、HIF-1α和VEGF蛋白表达增加最明显(P<0.05)。详见图6、表7。

图6 各组小鼠心肌SIRT3、PFKFB3、HIF-1α和VEGF蛋白表达条带图(A为对照组;B为模型组;C为利心冲剂低剂量组;D为利心冲剂高剂量组;E为美托洛尔组)
表7 各组小鼠心肌SIRT3、PFKFB3、HIF-1α和VEGF蛋白表达水平比较(±s)
3 讨 论
本研究探讨利心冲剂治疗心肌梗死后心力衰竭小鼠的可能机制。结果显示,利心冲剂可能通过激活SIRT3/PFKFB3/HIF-1α信号通路,促进心肌梗死后心力衰竭小鼠血管新生[8-9],且与美托洛尔作用相似,本研究选择美托洛尔是由于其为临床抗心力衰竭的常用药,且具有促血管新生的作用。
SIRT3是与人类寿命长短有关的因子,可调节体内线粒体代谢等生理活动[10]。已有研究表明,SIRT3通过磷酸化调节内皮细胞(EC)糖酵解关键酶PFKFB3表达,调节内皮细胞糖酵解,正常情况下糖酵解是内皮细胞获取能量的主要方式[11],也是内皮细胞进行迁移和增殖的主要能量来源,通过调节糖酵解影响内皮细胞血管新生[12-13]。PFKFB3与HIF-1α存在正反馈调节,HIF-1α与VEGF启动子结合促进VEGF转录[14-15]和血管生成[16]。本研究结果显示,与模型组比较,利心冲剂各剂量组SIRT3、PFKFB3、HIF-1α、VEGF蛋白表达增多,血管新生增加,其中利心冲剂高剂量组SIRT3、PFKFB3、HIF-1α、VEGF蛋白表达最多,血管新生明显,且与美托洛尔组比较差异无统计学意义。因此,推测利心冲剂可能通过SIRT3/PFKFB3/HIF-1α信号通路,促进心肌梗死后心力衰竭小鼠血管新生,且具有剂量依赖性。既往研究显示,PFKFB3/HIF-1α信号通路可促进炎性因子表达[17]。本研究结果显示,与模型组比较,利心冲剂各剂量组IL-6、TNF-α、NF-κB减少,其中利心冲剂高剂量组增加明显,且与美托洛尔组作用相似。推测利心冲剂可能通过促进血管新生,进而改善心力衰竭小鼠组织氧供,抑制炎性因子表达[18-19]。利心冲剂可能通过其他通路直接抑制心肌炎性因子表达,需进一步研究明确。
目前血管新生和纤维化关系尚未明确,相关研究显示,抑制血管新生,可抑制纤维化,尤其在肝脏、眼科方面的研究[20-21]。有研究表明,肝脏细胞中血管窦毛细血管增生,可促进肝细胞纤维化,门脉血管新生,抑制肝细胞纤维化[22]。本研究结果显示,与对照组比较,模型组血管新生减少,纤维化增加;与模型组比较,利心冲剂各剂量组血管新生增多,纤维化降低,且具有剂量依赖性。推测利心冲剂可能通过SIRT3/PFKFB3/HIF-1α信号通路促进生理性血管新生,抑制纤维化。
综上所述,利心冲剂可能通过激活SIRT3/PFKFB3/HIF-1α信号通路促进血管新生,但利心冲剂中何种成分促进血管新生,是否通过其他通路促进血管新生仍需进一步研究。

