血清25-羟基维生素D及骨钙素水平与老年2型糖尿病合并迟发性性腺功能减退症的关系
马海林, 权 莉, 马 瑞, 蒋 升
(新疆医科大学第一附属医院内分泌科,乌鲁木齐 830054)
2 型糖尿病(Type2 diabetes mellitus,T2DM)是由于胰岛素抵抗,或胰岛素分泌不足所致的血糖水平升高,患者临床症状主要表现为多饮、多食、多尿、消瘦、乏力[1]。迟发性性腺功能减退症(Late-onset hypognonadism,LOH)是一种与患者年龄相关的,具有典型临床症状和血清睾酮(Testosterone,T)水平低下的临床生化综合征,表现为性欲和勃起功能低下、空间定向能力及肌力下降等,同时还伴有骨密度降低、代谢综合征等,易怒易疲劳,严重影响患者的生活质量和心理健康[2]。研究显示[3],LOH在T2DM患者中的发病率达33%,明显高于非糖尿病人群,随着世界人口老龄化问题日益严重,T2DM 合并LOH 发病率呈逐年上升趋势,已成为影响老年男性健康的重要疾病之一。目前临床上常采用口服降糖药、胰岛素或手术治疗,中国雄激素治疗委员会参照国内外LOH 指南,讨论后推荐补充睾酮治疗LOH。研究表明[4],维生素D 缺乏与糖尿病密切相关,25-羟基维生素D[25-hydroxyvitamin D,25(OH)D]是反映人体维生素D 水平的可靠指标,在人体下丘脑、睾丸、卵巢中均有表达,与人体性腺功能的调节和骨代谢密切相关。骨钙素(Osteocalcin,OC)是由成骨细胞产生和分泌的一种非胶原蛋白,与糖代谢之间存在关联,具有骨代谢调节激素的作用,OC作为骨代谢指标,能直接反映骨细胞活性,对能量代谢和雄性生殖系统具有调节作用[5]。本研究测定T2DM 合并LOH 患者血清25(OH)D、OC表达水平,分析二者与T2DM 患者合并LOH 的关系,探讨其对T2DM 患者合并LOH 的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料选取2018年5月—2021年5月新疆医科大学第一附属医院内分泌科收治的120 例老年T2DM 合并LOH 患者为观察组,以同时期90 例单纯T2DM 患者为对照组,以60 例健康体检者为健康组,研究对象均为男性。观察组:年龄60~78岁,平均年龄(62.69±10.63)岁,体质指数(Body mass index,BMI)22.36~28.45 kg/m2,平均 BMI(25.45±2.16)kg/m2。对照组:年龄60~75岁,平均年龄(63.26±9.78)岁;BMI 22.58~28.31 kg/m2,平均 BMI(24.87±2.23)kg/m2。健康组:年龄60~74岁,平均年龄(61.38±9.42)岁;BMI 22.58~26.31 kg/m2,平均 BMI(24.12±3.23)kg/m2,3 组一般资料比较差异无统计学意义。本研究通过新疆医科大学第一附属医院伦理委员会批准(批号:LN-182),患者及其家属知情同意。
1.2 纳入与排除标准纳入标准:(1)患者年龄≥60岁;(2)符合美国糖尿病协会糖尿病诊断及分型专家委员会修改后的T2DM 诊断标准[6],经相关检查确诊为T2DM;(3)符合LOH 的诊断[7]:睾酮(Testosterone,T)水平<8 nmol/L 或游离 T 水平<225 pmol/L,中老年男性雄激素缺乏调查表(Questionnaire for androgen deficiency in aging male,ADAM)为阳性,具有性欲和勃起功能低下、情绪改变并伴有脑力和空间定向能力的下降等症状;(4)患者及其家属均签署知情同意书。排除标准:(1)合并神经源性膀胱、尿道狭窄、前列腺癌等疾病者;(2)有垂体、性腺疾病病史者;(3)合并器官功能障碍者;(4)患有神经系统、自身免疫系统及精神疾病者;(5)自愿退出本研究或中途转院者;(6)拒绝配合本研究者。
1.3 方法
1.3.1 血清25(OH)D、OC 水平检测 抽取健康体检者及患者入院24 h内的外周静脉血3 mL,3 000 r/min离心10 min(离心半径13 cm),收集上层血清,保存于-80 ℃冰箱内待测。采用酶联免疫吸附试剂盒(ELISA,上海心语生物科技有限公司),按照试剂盒使用说明书进行操作,测定3 组血清25(OH)D、OC水平。
1.3.2 T2DM 合并LOH 患者与单纯T2DM 患者的临床资料收集 包括年龄、BMI、糖尿病病程、是否具有糖尿病家族史、是否合并基础疾病(高血压、高血脂)、是否吸烟饮酒、糖尿病治疗药物使用情况、血清25(OH)D、OC 水平。入院 24 h 内对患者空腹血糖(Fasting blood glucose,FBG)、餐后2 h 血糖(2-hour Postprandial blood glucose,2 hPBG)、糖化血红蛋白(Hemoglobin A1c,HbA1c)、白细胞(White blood cell,WBC)、红细胞(Red blood cell,RBC)、血小板(Platelet,PLT)、血红蛋白(Hemoglobin,HB)、血管内皮生长因子(Vascular endothelial growth factor,VEGF)、谷丙转氨酶(Althirdtransaminase,ALT)、白蛋白(Albumin,ALB)、总胆红素(Total bilirubin,TBIL)、肌酐(Creatinine,Cre)、尿素氮(Blood urea nitrogen,BUN)、尿酸(Uric acid,UA)、促卵泡生成素(Follicle-stimulating hormone,FSH)、黄体生成素(Luteinizing hormone,LH)、雌二醇(Estradiol,E2)、孕酮(Progesterone,P)、睾酮(Testosterone,T)等指标进行检测。
1.4 统计学处理采用SPSS 26.0 统计学软件进行数据处理,符合正态分布的计量资料以均数±标准差()表示,多样本计量资料比较采用单因素方差分析,两两样本比较采用LSD-t检验;计数资料以例(%)表示,组间比较采用χ2检验;采用多因素Logistic回归分析影响T2DM合并LOH的相关因素;绘制受试者工作特征曲线(Receiver operating characteristic curve,ROC)分析血清25(OH)D、OC 水平对T2DM 合并LOH的诊断价值,以P<0.05为差异有统计学意义。
2 结果
2.1 3 组血清25(OH)D、OC 水平比较与健康组比较,观察组、对照组25(OH)D、OC 水平均降低,差异均有统计学意义(P<0.05);与对照组比较,观察组25(OH)D、OC 水平均降低,差异均有统计学意义(P<0.05),见表1。
表1 3组血清25(OH)D、OC水平比较()
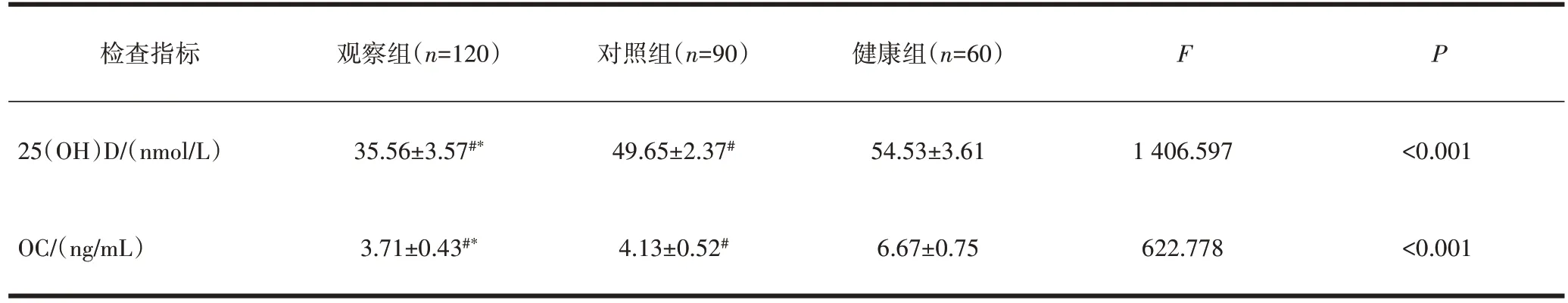
表1 3组血清25(OH)D、OC水平比较()
注:与健康组比较,#P<0.05;与对照组比较,*P<0.05。
检查指标 观察组(n=120) 对照组(n=90) 健康组(n=60)F P 25(OH)D/(nmol/L)OC/(ng/mL)35.56±3.57#*3.71±0.43#*49.65±2.37#4.13±0.52#54.53±3.61 6.67±0.75 1 406.597 622.778<0.001<0.001
2.2 影响T2DM 合并LOH 患者的单因素分析与对照组比较,观察组糖尿病病程延长,血清25(OH)D、OC、FSH、LH、T 水平降低,差异均有统计学意义(P<0.05),见表2。
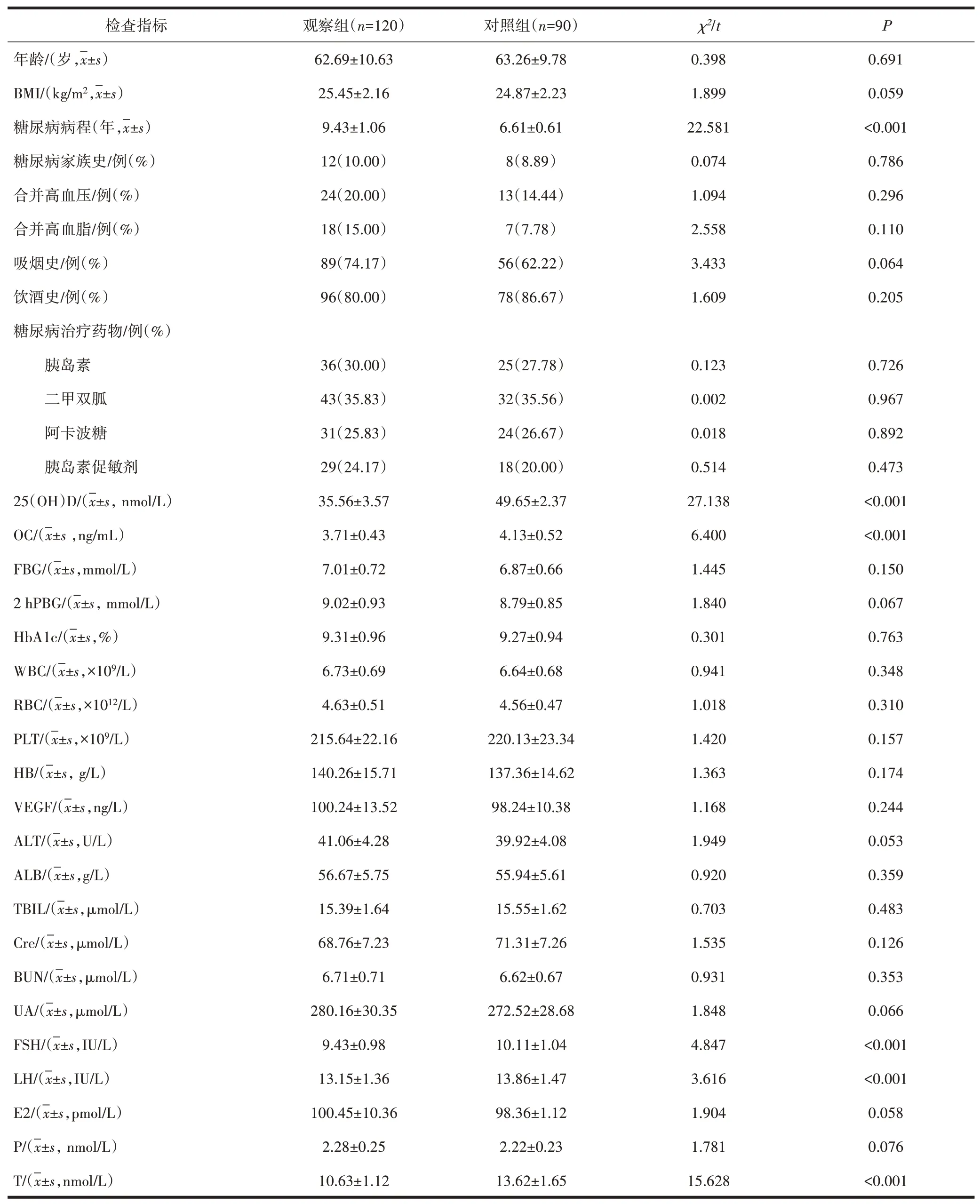
表2 影响T2DM合并LOH患者的单因素分析
2.3 影响 T2DM 合并 LOH 患者的Logistic 回归分析将T2DM 合并LOH 作为因变量(Y),将单因素分析有差异指标糖尿病病程、血清25(OH)D、OC、FSH、LH、T 水平作为自变量(X),进行Logistic回归分析赋值,赋值结果见表3。经Logistic回归分析,结果显示血清25(OH)D、OC、FSH、LH、T 水平均是影响T2DM合并LOH患者的相关因素(P<0.05),见表4。
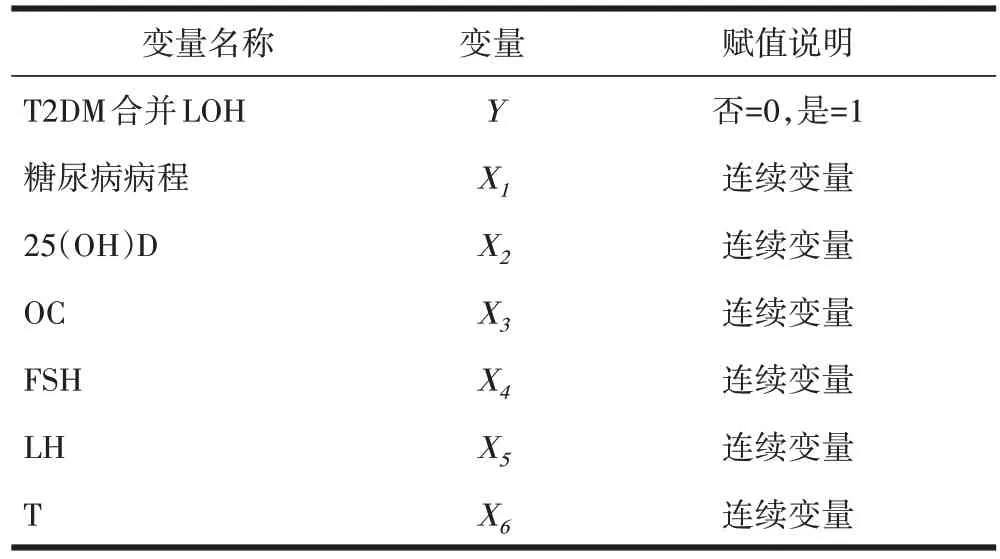
表3 Logistic回归分析法赋值

表4 影响T2DM合并LOH患者的Logistic回归分析
2.4 血清25(OH)D、OC 水平对T2DM 合并LOH 的诊断价值血清25(OH)D、OC 诊断T2DM 合并LOH的最佳截断点分别为38.62 nmol/L、3.95 ng/mL,ROC曲线下面积(the area under theROCcurve,AUC)分别为 0.865(95%CI:0.758~0.944)、0.886(95%CI:0.762~0.938),敏感度分别为84.17%、85.00%,特异度分别为72.22%、70.00%,血清25(OH)D、OC 联合检验的AUC为0.912(95%CI:0.824~0.957),敏感度与特异度分别为81.67%、78.89%,见图1、表5。
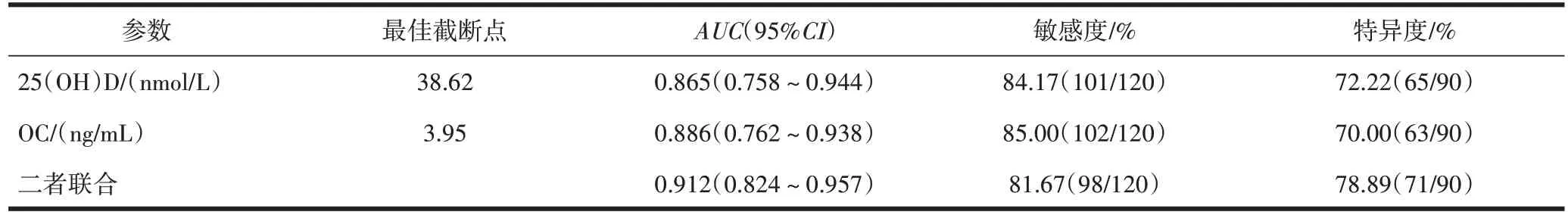
表5 血清25(OH)D、OC水平对T2DM合并LOH的诊断价值分析

图1 血清25(OH)D、OC水平诊断T2DM合并LOH的ROC曲线
3 讨论
T2DM 患者常伴有血清 T 水平低下,LOH 的发病以血清T水平降低为基础,与衰老过程中下丘脑—垂体—睾丸轴功能紊乱及睾丸功能减退有关,同时伴有多种临床症状,影响多个器官的功能[8]。目前T2DM 合并LOH 的发病机制尚不明确,多数学者认为与患者新陈代谢紊乱、神经系统病变、炎症反应、长期的高血糖损害性腺器官等多种机制有关,易受不良生活习惯、肥胖及代谢性疾病的影响[9-10]。
本研究结果提示 25(OH)D、OC 在 T2DM 合并LOH 患者血清中呈异常表达,二者共同参与T2DM 合并LOH 疾病的发生发展。维生素D 是一种多效性类固醇类激素,通过与受体结合发挥对结构基因表达的调节作用,参与多种疾病的生理病理过程,25(OH)D是评价人体维生素D 水平的最佳指标[11]。动物实验研究表明[12],饮食缺乏维生素D 喂养的雄性小鼠睾丸重量和精子质量降低,睾丸生殖细胞受到抑制,血清T 水平降低,当雄性和雌性小鼠均进行饮食缺乏维生素D喂养时,生育指数降低,活胎数量减少,提示维生素D及其受体影响了性激素分泌,从而损害睾丸发育和精子质量。魏明明等[13]研究发现,25(OH)D 缺乏组患者精子浓度和精子活力均低于25(OH)D 正常组,认为血清25(OH)D 除了影响精子的产生,亦对副性腺功能产生影响。OC是骨组织中的一种非胶原蛋白质,主要由成骨细胞分泌合成,属于骨代谢指标之一,可通过促进胰岛细胞增殖和胰岛素分泌,减少胰岛素抵抗,进而影响能量代谢,T2DM 合并LOH 患者体内糖脂代谢紊乱导致骨代谢紊乱、骨密度下降,引发OC水平异常[14]。Yang等[15]研究显示,血清OC与特发性低促性腺激素性性腺功能减退症患者睾丸体积呈负相关,与峰值T 值呈正相关,表明OC 可以调节T分泌,参与性功能减退的发生。
患者睾丸间质细胞表达的维生素D 受体会与靶基因启动子区域内的维生素D反应元件结合,调解睾丸间质细胞的增殖和分化,提升性激素合成酶的功能,此外维生素D可以通过改变类固醇生成基因的表达谱,促进睾丸激素的合成,调节性激素分泌平衡,进而影响患者性功能[16]。非羧基化OC可作用于胰岛β 细胞及脂肪细胞,促进胰岛素、脂联素的合成与分泌,对能量代谢起调节作用,此外非羧基化的OC 还可作用于睾丸间质细胞,促进T 合成关键酶Cyp17、Cyp11a 基因的表达,进而提高T 的合成能力,从而调节雄性性腺功能[17]。ROC曲线分析显示,血清25(OH)D、OC 联合诊断T2DM 合并LOH 的特异度高于二者单独检测,说明其与T2DM合并LOH的关系较为密切,可作为预测T2DM合并LOH新的生物标志物。
综上所述,血清25(OH)D、OC与T2DM 合并LOH具有一定的相关性,在T2DM合并LOH的诊断治疗中可给予重点关注。但本研究是横断面研究,因时间问题纳入样本量有限,后续可扩大样本量进行更深入的临床研究,进一步明确血清 25(OH)D、OC 在T2DM合并LOH中的具体作用机制。

