人宫颈癌干细胞分离、鉴定及其特性
吴琳琳,张 茹,李 英,熊 川
(武警四川省总队医院1体检科,2妇科,3军事医学与特种学科,四川 乐山 614000)
宫颈癌作为生殖道恶性肿瘤之一,死亡率较高,占全部恶性肿瘤总死亡人数的3.26%[1],其中宫颈鳞状细胞癌所占比重最高,为75%~80%[2]。为更好地研究宫颈癌和建立宫颈癌细胞系平台,探讨有效的分离、培养和监测原代宫颈癌干细胞的方法具有十分重要的临床价值[3]。目前临床上对宫颈癌的治疗取得了一定的进展,然而肿瘤转移、复发等会增加治疗失败率,是引起患者死亡的重要因素。有数据显示,宫颈癌手术患者5年内复发和转移风险为40%,这与化疗和/或放疗的获得性抵抗有关[4]。影响治疗和预后的一个重要因素为宫颈癌干细胞(Cervical cancer stem cells,CCSCs)的存在,它们位于肿瘤的局部区域,可启动和维持肿瘤的生长[5]。因此,针对宫颈癌的治疗可以通过阻止CCSCs 的克隆来降低或抑制肿瘤细胞对传统治疗的抵抗性,从而预防远处转移和局部复发[6]。目前,尚未找到可明确判断宫颈癌干细胞形态的特异性标记物,从而限制了靶向肿瘤干细胞在宫颈癌治疗方面的应用。因此有效地分离干细胞是宫颈癌干细胞研究的前提和关键。有研究显示,耐放疗宫颈癌Siha 细胞系中CD44+CD24+细胞比重显著升高[7]。故本研究旨在探讨CD44+CD24+原代细胞是否表现出肿瘤干细胞特性,为宫颈癌治疗提供实验理论依据。
1 材料与方法
1.1 实验动物选择体重20~22 g,4~6 周龄,SPF 级雄性Balb/c 裸小鼠24 只进行体内实验[动物许可证号:SCXK(京)2007-0009]。实验动物已获得乐山市赛科动物护理中心的批准。
1.2 组织标本选取2017年1月—2018年2月武警四川省总队医院妇科接受手术治疗的32例宫颈癌患者的组织标本作为实验组,另选取同期32 例子宫全切术患者的正常宫颈黏膜组织标本作为空白组。
1.3 试剂及仪器DMEM-F12 肿瘤干细胞培养液(美国,GIBCO 公司);FBS 胎牛血清和链霉素-青霉素双抗(美国,Thermo Fisher 公司);抗生物素蛋白-生物素-过氧化物酶复合试剂盒(美国,Vector Laboratories公司);大鼠抗小鼠初级抗体:CD24-FITC、CD24同型对照、CD44-PE、CD44 同型对照(美国,BD Pharmagen公司)。超净工作台(北京东联哈尔仪器制造,DICJ-2ND 型);流式细胞仪(美国BD 公司,FACS CantoⅡ型);CO2细胞培养箱(美国Thermo Scientific 公司,HERcell1501型)。
1.4 实验方法
1.4.1 分离培养宫颈癌原代细胞 无菌培养液洗净宫颈癌组织标本,无菌剪完全剪碎,加入胰蛋白酶消化30 min;4℃,3 000 r/min 离心 10 min,收集上清,PBS重悬,200 μm 细胞筛过滤,获得单细胞悬液,置于DMEM/F12 细胞培养基(成纤维细胞生长因子10 ng/mL+上皮生长因子20 ng/mL)中进行培养,第二天换新鲜培养液。细胞融合率超过80% 时,可传代1次。
1.4.2 流式细胞术细胞分选处理 取对数期生长的细胞,加入0.25%胰蛋白酶持续消化2~3 min,加入PBS,吹打细胞至完全吹散,置于5 mL 玻璃离心管,100 r/min,离心3 min,除去上清液后加入PBS 重悬,并对细胞计数。实验组中选择1×106个细胞分别与5 μL CD44-PE 抗体、5 μL CD24-FITC 抗体融合,40℃孵育30 min。对照组无需加入抗体。流式细胞仪完成检测与分选,每组细胞确定平行对照共10个,每个样品进行3 次测定,结果取3 次平均值。根据分选结果进行分组,未分选细胞为对照组,其余细胞分别为CD44+CD24+组、CD44-CD24-组。
1.4.3 免疫组织化学检测 10%福尔马林固定,石蜡包埋,5 μm 连续切片。选择抗生物素蛋白-生物素-过氧化物酶复合试剂盒进行免疫组织化学染色。初级抗体抗小鼠 CD44(稀释浓度 1∶30) 、抗小鼠 CD24(稀释浓度1∶800)室温孵化1 h或湿盒内过夜。二氨基联苯胺为染色剂,苏木精逆染色,Universal Imaging Porporation的图像分析仪计算灰度值。
1.4.4 四甲基偶氮唑盐(MTT)法检测细胞增殖 收集细胞与10%胎牛血清的DMEM-F12 培养基以1∶1 的比例混合,进行干细胞培养。每组复设8 孔,每次间隔1 d,弃除上清,加入MTT 试剂,检测细胞增殖情况,记录450 nm处的光密度(OD)值。
1.4.5 裸小鼠异种移植瘤模型实验 取雄性Balb/c 裸小鼠分为CD44+CD24+组、CD44-CD24-组和对照组,每组8只,取对数生长期浓度在1×104个/mL~1×107个/mL的CD44+CD24+、CD44-CD24-细胞各0.2 mL,在实验组裸小鼠腋下进行皮下接种,对照组不进行接种处理。每周观察1次,共观察12周。
1.4.6 平板集落形成实验 将3 组细胞稀释后接种于培养皿,加入完全培养液,置于饱和湿度、5% CO2、37℃培养箱中培养,14 d 后台盼蓝染色,显微镜下观察细胞菌落(>50 个细胞团)计数,计算细胞集落形成率(CFR)。

1.4.7 制备细胞端粒酶 EP 管分别收集1×1010个/mL 3 组细胞,离心,弃除上清液,加入裂解缓冲液,静止30 min,对其上清液中蛋白质含量进行半定量分析。
1.4.8 检测端粒酶活性 通过端粒重复序列扩增法(TRAP)结合电泳、银染法进行检测。利用美国国立生物技术信息中心(NCBI)数据库设计引物,由生工生物工程(上海)股份有限公司合成。反应体系(50 μL):脱氧核糖核苷三磷酸(dNTP)混合物4 μL,模板链(Ts)引物2 μL,TaqDNA聚合酶 2 U,10×缓冲液5 μL,溶入双氧水,30℃温育10 min,加入反向(Cx)引物2 μL。反应条件:95℃灭活30 s,1个循环;95℃变性5 s,50℃延伸30 s,72℃退火90 s,共40 个循环。10% 冰乙酸固定,40℃,0.2%硝酸银染色;碳酸钠0.28 mmol/L、甲醛0.02%的显影液显影。将对照组细胞端粒酶活性作为参照,其余两组计算其端粒酶活性相对强度。端粒酶活性相对强度=待测标本OD 值/未分选细胞OD 值。
1.5 统计学处理采用SPSS 23.0 统计软件进行分析,方差齐的计量资料以均数±标准差()表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步两两比较采用q检验。计数资料以例(%)表示,组间比较采用χ2检验,以P<0.05 为差异具有统计学意义。
2 结果
2.1 流式细胞术分选结果比较两组宫颈癌原代细胞中CD44+和CD24+阳性细胞百分比,差异具有统计学意义(P<0.05),见表1。
表1 流式细胞术分选结果/(,%)
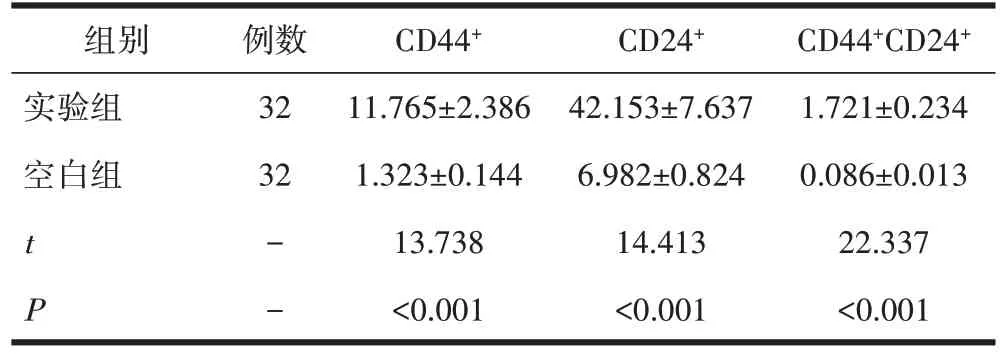
表1 流式细胞术分选结果/(,%)
组别实验组空白组例数32 32 t P- -CD44+11.765±2.386 1.323±0.144 13.738<0.001 CD24+42.153±7.637 6.982±0.824 14.413<0.001 CD44+CD24+1.721±0.234 0.086±0.013 22.337<0.001
2.2 各组CD44、CD24 表达分析免疫组织化学结果显示,实验组中CD44 和CD24 阳性表达率分别为87.50%、81.25%,与空白组比较差异具有统计学意义(P<0.05),见表2、图1。

表2 各组CD44、CD24表达情况比较/例(%)
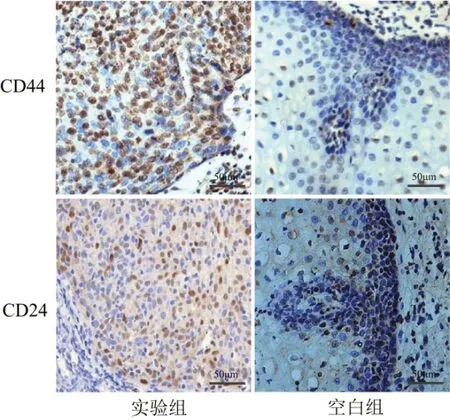
图1 CD44、CD24在两组中的表达情况(×400)
2.3 各组细胞体外增殖情况比较MTT 法结果显示,体外增殖 48、72、96 h,CD44+CD24+组细胞的增殖活性高于对照组和CD44-CD24-组细胞,差异具有统计学意义(P<0.05),见表3。
表3 各组细胞体外增殖MTT检测结果()
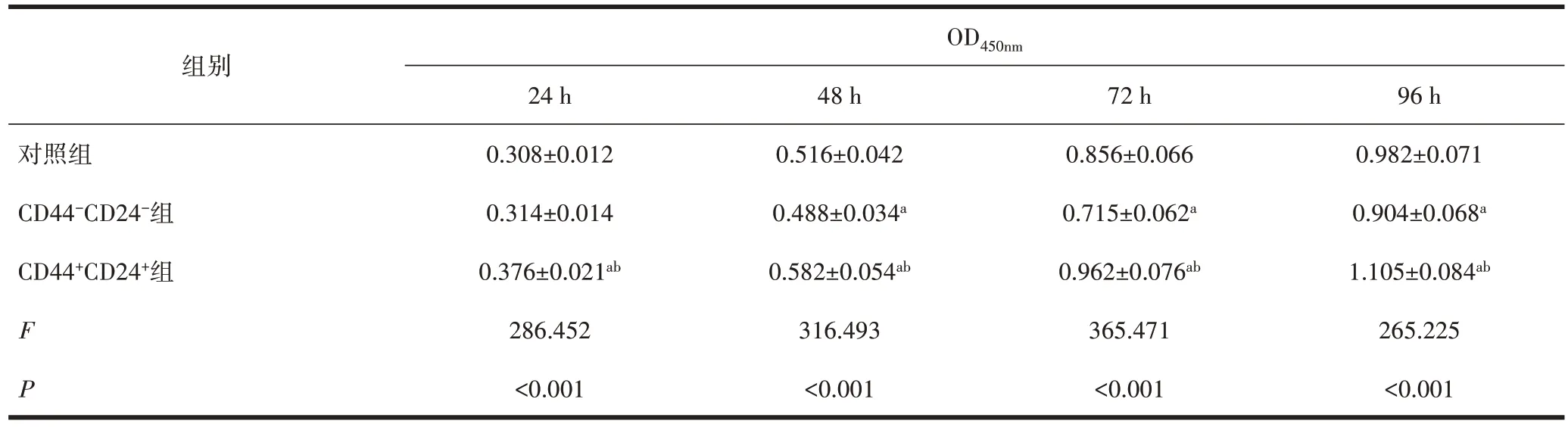
表3 各组细胞体外增殖MTT检测结果()
注:与对照组比较,aP<0.05;与CD44-CD24-组比较,bP<0.05。
OD450nm组别对照组CD44-CD24-组CD44+CD24+组F P 96 h 0.982±0.071 0.904±0.068a 1.105±0.084ab 265.225<0.001 24 h 0.308±0.012 0.314±0.014 0.376±0.021ab 286.452<0.001 48 h 0.516±0.042 0.488±0.034a 0.582±0.054ab 316.493<0.001 72 h 0.856±0.066 0.715±0.062a 0.962±0.076ab 365.471<0.001
2.4 各组细胞体内成瘤率比较裸小鼠异种移植瘤模型实验结果显示,细胞数量为1×105个/mL~1×107个/mL时,CD44+CD24+组接种后开始出现新生瘤体,与对照组、CD44-CD24-组比较成瘤率,差异具有统计学意义(P<0.05),见表4、图2。

表4 各组裸小鼠接种成瘤率比较/例(%)
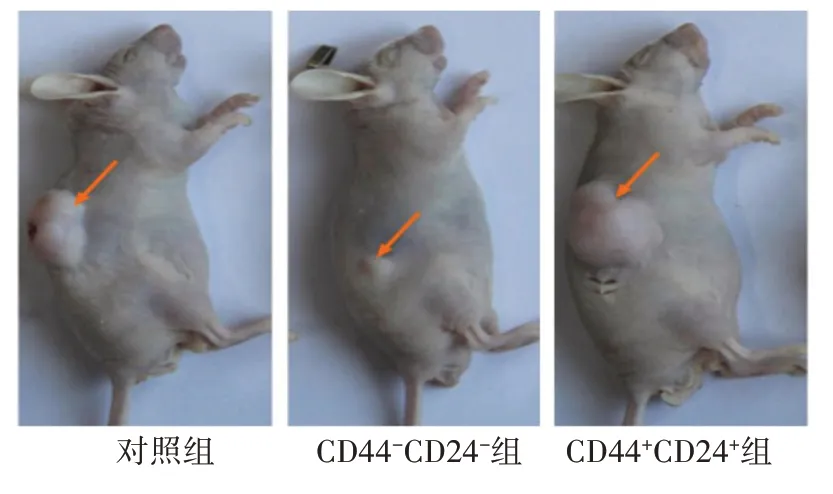
图2 裸小鼠4周后皮下移植瘤形成情况
2.5 细胞集落形成实验结果细胞培养14 d 后,CD44+CD24+组细胞集落形成率(0.423±0.131)%高于对照组(0.258±0.084)%;CD44-CD24-组细胞集落形成率(0.073±0.040)%低于对照组,差异均有统计学意义(P<0.05),见图3。

图3 3组细胞细胞集落结果图
2.6 各组细胞端粒酶活性结果比较CD44+CD24+组细胞端粒酶相对表达强度(4.79±0.78)高于对照组细胞(1.02±0.28),差异具有统计学意义(P<0.05)。CD44-CD24-组细胞端粒酶相对表达强度(0.46±0.09)低于对照组细胞(1.02±0.28),差异具有统计学意义(P<0.05),见图4。

图4 各组细胞端粒酶相对表达量
3 讨论
多年来,人类乳腺癌[8]、结直肠癌[9]等多项研究均证实了肿瘤干细胞的致癌作用。肿瘤干细胞起源同正常干细胞,受多因素、多阶段影响,且都处于未分化状态,能自我更新,还可无限增殖[10]。两者差异在于正常干细胞的增殖、凋亡始终保持平衡,主要是受其自我更新反馈调节机制的影响[11],而肿瘤干细胞会出现多基因突变,细胞增殖会丧失控制,最终生成肿瘤[12]。肿瘤干细胞致瘤性强,耐药性高,故化疗失败率高[13]。目前,肿瘤细胞种群分类与表面标记表达相结合的方式已被用于鉴定组织中是否存在干细胞[14]。2007年,Heidt等[15]首次分离出一种胰腺癌细胞亚型,这些细胞具有自我更新能力,同时存在高致瘤性、多向分化特性,且CD44、CD24表达较高,从而为癌症的研究提供了有价值的工具。CD44、CD24 为细胞黏附分子,在间质细胞、上皮细胞、肿瘤细胞表面表达丰富,与肿瘤细胞迁徙、分化、增殖、转移密切相关[16]。有研究显示,宫颈储备细胞是宫颈癌细胞的起源,属于干细胞范畴,作为一种多潜能细胞,具有类似于肿瘤干细胞的双向分化潜能[17],其具备的特性如增生、多潜能分化是引起宫颈上皮复杂病理变化的重要基础,而CD44、CD24 在各型宫颈储备细胞中也均呈现出强阳性表达[18-19]。
本研究流式细胞术结果显示,宫颈癌原代细胞中CD44+CD24+细胞少量表达,正常宫颈原代培养细胞中CD44+CD24+细胞含量极低,说明CD44、CD24 可作为宫颈癌干细胞表面标记物,进一步免疫组织化学染色结果显示,其阳性表达率高于空白组,说明CD44+CD24+宫颈细胞发生了形态学分子变化,导致癌变的发生。肿瘤干细胞鉴定最重要的是判断其是否具备干细胞自我更新能力、无限再生能力。本研究通过体外MTT 法、细胞集落形成实验以及体内裸小鼠移植瘤实验证实CD44+CD24+组细胞体外增殖活性高于CD44-CD24-组细胞。端粒酶是核糖核蛋白复合物,存在特殊逆转录活性,其结构包括端粒酶RNA、催化亚单位—端粒酶逆转录酶(TERT),可通过维持端粒的长度,使细胞保持体外长期传代、自我更新的生物学特性,其阳性表达关联着细胞无限增殖。本研究中,CD44+CD24+组细胞端粒酶相对表达强度和细胞集落形成率高于对照组,CD44+CD24+细胞端粒酶高水平表达也进一步说明宫颈癌CD44+CD24+细胞具有明显的肿瘤干细胞特性,提示高代培养的CD44+CD24+细胞具有较高的自我更新、无限增殖潜力。
综上所述,CD44和CD24有望成为CCSCs表面标记分子,为靶向宫颈癌肿瘤干细胞治疗提供一定的实验支持。

