高分辨电感耦合等离子体质谱法测定植物样品中的12种元素
李如燕, 常 青, 江 冶, 乔爱香, 曹 磊
(1. 自然资源部国土(耕地)生态监测与修复工程技术创新中心,江苏南京210018;2. 江苏省地质调查研究院,江苏南京210018)
0 引 言
随着经济的快速发展,大量重金属元素随工业垃圾、生活垃圾及农药类化学品以不同的形式进入土壤及大气中。根据土壤污染状况调查,我国土壤总超标率为16.1%,污染类型以无机型为主、有机型次之(环境保护部等,2014)。植物在生长发育过程中吸收土壤环境中的元素累积于体内(胡省英等,2003),土壤环境污染必然影响植物中多种无机元素的含量(廖启林等,2015;范健等,2016)。植物样品中多种无机元素的快速准确测定不仅可以了解植物在生长发育过程中对各元素的吸收、积累,还可对其生存的外部环境中的无机元素进行监测,为农业、畜牧业、食品工业和环境保护提供重要信息(诸堃等,2009;刘亚轩等,2013;叶丽等,2015)。
植物样品中多种无机元素的测定已有大量研究(侯冬岩等,2009;李刚等,2010;乔爱香等,2010;藏吉良等,2012;陈艾霞等,2013;李龙等,2013;黄子敬等,2017),植物样品的预处理方法主要分为干法、湿法消解和微波消解等(刘亚轩等,2013;彭立,2016)。植物样品成分复杂,需根据样品和待测元素的性质和特点来选择预处理方法(吴建之等,1999):① 干式灰化法所用试剂少、空白值低,但结构致密的样品不易完全灰化,部分元素在高温下挥发损失(王晓凤等,1998;刘亚轩等,2013),不适用于Hg、Se等易挥发痕量元素的测定;② 湿法消解样品分解较完全,但试剂消耗高,试剂空白对分析结果影响较大,操作费时费力(魏清才,2014),Cr、Ni、Pb等元素受试剂空白影响尤为严重;③ 微波消解在密闭环境中进行,可防止挥发性元素的损失,耗酸少,分解速度快(张小燕等,2000;张纽枝,2016),能提高工作效率和分析准确率,但由于植物样品中各元素含量差异较大,为顾及各元素的测定一般要采取多种前处理方法,耗时费力。因此,急需发展一种简单快速、绿色环保的前处理方法。
关于植物样品无机元素的测定技术,现有方法如原子吸收光谱法(AAS)(陈召桂等,2014;柯娴等,2014)、原子荧光光谱法(AFS) (姚剑亭等,2008;邓德红等,2016)、X射线荧光光谱法(杨振飞等,2018;桑晓霞等,2020)、电感耦合等离子体原子发射光谱法(ICP-AES) (刘松等,2019;杨进彬,2019)以及电感耦合等离子体质谱法(ICP-MS)(魏正蓉等,2020;曾勇等,2020)等各有利弊,均无法在植物样品中同时测定Cd、Cr、Ni、Cu、Pb、Zn、Co、Mo、As、Hg、Se、Mn这12种无机元素,需经多次样品处理和多种仪器设备测定。典型的配套方案有:AFS测定As、Hg、Se,ICP-AES测定Ni、Cu、Zn、Mn,ICP-MS测定Cr、Cd、Pb、Co、Mo。
选择微波消解作为样品的预处理方式,通过改进预处理过程,研究出一套简单快速的植物样品前处理方法。密闭体系下消解和除去高温蒸酸的操作,避免了Hg、Se等元素的损失,缩短了处理时间和步骤,提高了前处理效率;选择灵敏度和分辨率极高的HR-ICP-MS作为检测仪器,研究各元素的质谱干扰,优化仪器各种参数,尽可能消除质谱干扰与非质谱干扰,提高测定的准确度;选择多种国家植物样品标准物质作为检测对象,微波消解处理后用HR-ICP-MS同时测定Cd、Cr、Ni、Cu、Pb、Zn、Co、Mo、As、Hg、Se、Mn12种元素。经验证,方法的检出限、精确度和准确度均满足《生态地球化学评价样品分析技术要求(试行)》(DD 2005-03)(中国地质调查局,2015)。
1 实验测试
1.1 仪器及工作参数
质谱仪为ELEMENT 2 型HR-ICP-MS(美国Thermo Fisher ),其工作参数见表1。

表1 ELEMENT 2等离子体质谱仪的工作参数Table 1 Operating parameters of the plasmamass spectrometer ELEMENT 2
相比四级杆等离子体质谱仪,HR-ICP-MS具有极高的灵敏度和分辨率,擅长在高分辨率下对多原子离子干扰(如40Ar35Cl对75As,40Ca16O和40Ar16O对56Fe的干扰)进行消除。在低分辨率下,HR-ICP-MS具有高灵敏度;在中高分辨率下,改变静电狭缝的宽度可大大提高仪器的分辨率,降低响应信号。对于质谱干扰较强的元素可通过改善分辨率将其与干扰元素分开,对于响应信号过强的元素可通过提高分辨率以改善信号。
1.2 微波消解条件的选择
植物样品前处理使用ETHOS UP微波消解仪(意大利Milestone)。样品消化一般采用程序升温法,植物样品基质复杂,程序升温可避免样品因有机质含量高导致试样反应太过剧烈而大量溢出。加热时间和温度不宜过长、过高,否则会使管体变软而发生事故。根据样品的性质调整工作条件,经多次对比试验,按表2的消解程序进行消解,待消解液澄清透明,定容至50 mL后即可上机测定。

表2 微波消解程序Table 2 Microwave digestion program
1.3 试剂与材料
100 mg/L混合标准溶液(美国SPEX),1 mg/mL单元素标准贮备液(国家标准物质中心),仪器调谐液(含B、Ba、Co、Fe、Ga、In、K、Li、Lu、Na、Rh、Sc、Tl、U、Y 各1 ng/mL,介质为5% HNO3),HCl、HNO3(优级纯),内标溶液(含Rh和Ir各1 ng/mL,介质为2%HNO3);国家一级生物标准物质(GBW10010、GBW10014、GBW10015、GBW10020、GBW10048),超纯水(电阻率为18 MΩ·cm),一次性50 mL PE比色管。
1.4 标准曲线的绘制
取100 mg/L混合标准溶液和1 mg/mL单元素标准贮备液逐级稀释,获得一系列标准点(表3)。

表3 标准溶液含量Table 3 Standard solution content
1.5 样品的制备及测定
称取0.200 0 g (±0.000 2 g )样品置于40 mL聚四氟乙烯微波消解罐中,用少量去离子水冲洗消解罐内壁,加入3 mL硝酸和1 mL盐酸,摇匀拧紧盖子后放入已设定好消解程序的微波消解仪中。消解完成待其自然冷却至室温后,在通风橱中拧开盖子,用去离子水冲洗内盖,随后将消解液转移至塑料比色管中,用去离子水定容至50 mL,摇匀、静置。
用调谐液对仪器进行优化,使仪器达到最佳使用条件,然后使用蠕动泵分别引入内标溶液和样品溶液,经三通接口混合后进入雾化器雾化。
2 结果与讨论
2.1 同位素和分辨率的选择
一般来说,ICP-MS在测定样品时存在非质谱干扰和质谱干扰,大多数植物样品的基体比较复杂,具高盐、高有机物、高含量等特点,易造成非质谱干扰,影响分析结果的准确性。外标法和内标法可用于非质谱干扰的校正(侯鹏飞等,2020),内标法可用于信号漂移和基体效应的校正。实验所用ELEMENT 2型HR-ICP-MS仪具有低(LR)、中(MR) 和高(HR)3档分辨率,对应的分辨率分别为 300、4 000、10 000(以10%峰谷定义,R=m/Δm),对于所测大多数元素选择最高分辨率即可消除多原子离子干扰、难熔氧化物干扰等质谱干扰,但无法消除同量异位素干扰,所以Cd的测定需用数学校正法扣除Sn引起的干扰(侯鹏飞等,2019)。
校正公式为:
114Cd =114X-0.027118Sn
(1)
通常选择干扰相对小而丰度较大、灵敏度高的同位素进行测定。对于HR-ICP-MS来说,高分辨率是以牺牲灵敏度为代价的。对于已知含量较高的元素,为避免高含量对检测器的损害,可采用高分辨率进行测定;对于含量较低的元素,为保证较高灵敏度,应选择较低的分辨率。12种待测元素的潜在干扰情况、元素在样品中的大致含量以及同位素与分辨率的选择见表4。

表4 测定同位素与分辨率的选择Table 4 Selection of isotope and resolution for determination
2.2 样品消解方法的确定
微波密闭消解法在高温、高压条件下使有机物快速分解,是一种均匀、快速的内部加热方法,能在短时间内完全消解样品。选择微波消解法来分解样品,按照样品的分析过程消解国家一级生物标准物质GBW10014和GBW10048,比较硝酸、硝酸-过氧化氢、盐酸、王水和逆王水等消解体系的消解能力发现,除盐酸外,其他消解液均能将样品完全消解,得到澄清透明的溶液。植物样品的有机物含量非常高,需用强氧化性的酸进行消解,盐酸无法将有机物完全分解。各消解液测定的相对误差见表5。

表5 不同消解液下各元素的相对误差Table 5 Relative error of elements in different digestion solutions
逆王水的消解能力较强,绝大数元素的测定结果与标准值吻合,考虑各元素测定的准确度,选择逆王水体系消解样品。优化逆王水的用量,按照样品的消解过程分别采用1、2、4、6 mL逆王水消解GBW10014和GBW10048,均得到澄清透明的溶液,测定结果见表6。消解液用量较大时得到的溶液酸度较高,容易腐蚀进样系统。综合考虑测定的准确性和酸度,选择消解液的用量为4 mL。

表6 消解液用量对GBW10014和GBW10048测定的影响Table 6 Influence of the amount of digestion solution on GBW10014 and GBW10048 determination
研究表明,ICP-MS无法承受含有大量可溶性固体的样品溶液,总溶解固体(TDS)含量较高时在短时间内就会出现明显的信号漂移,容易引起误差(贾维斯等,1997)。为减少溶液中的TDS含量,一般采用减少称样量、稀释样品或者内标校准的方法,但称样量的减少可能会导致所称样品代表性不够,样品稀释过大又会影响痕量元素的测定,从而增大测定误差,内标校准的确能够消除一些TDS带来的增强或抑制效应,但是TDS含量高时内标元素的响应值会远低于校准曲线响应值,影响测定结果。
选择Rh和Ir作内标元素,试验了不同称样量对GBW10014和GBW10048中各元素测定的影响。测定结果表明,当称样量为0.1、0.2 g时,即稀释因数(稀释因数=稀释体积/称样量)为500、250时,内标元素的响应值在校准曲线响应值的80%以上;当称样量为0.1 g时,样品稀释较大会影响Hg、Se等痕量元素的测定,导致Pb、Ni、Cr等元素的空白影响变大,结果偏高,分析精密度变差;当称样量为0.4 g时,由于样品中的TDS含量较高,内标元素的响应值要低于校准曲线响应值的80%,且Cr、Ni、Cu等元素的信号受到抑制,测定结果明显偏低。考虑到样品的代表性和测定结果的准确度,选择称样量为0.2 g,稀释因数为250。
2.3 方法的检出限
按上述样品消解步骤制备了10份空白溶液,在最优化的仪器条件下,测定 Cr、Mn、Co、Ni、Cu、Zn、As、Se、Mo、Cd、Hg、Pb共12种元素的含量,将各测定结果换算为样品中的含量,计算多次平行测定的标准偏差,然后按《环境监测分析方法标准制修订技术导则》(HJ-168)计算方法的检出限:
MDL=t(n-1,0.99)×S
(2)
当n=10时,t=2.821,以4倍检出限作为测定下限(表7)。

表7 各元素的检出限及定量限Table 7 Limits of detection and quantification of the 12 elements
2.4 方法的精密度
选用国家一级生物标准物质GBW10048,根据样品消解步骤分别制备12份样品,在优化后的仪器上测定溶液中各元素的含量,并计算各元素含量的相对标准偏差(RSD)(表8)。结果各元素的RSD均<10 %(n=12),满足植物样品中多元素分析对精密度的要求。
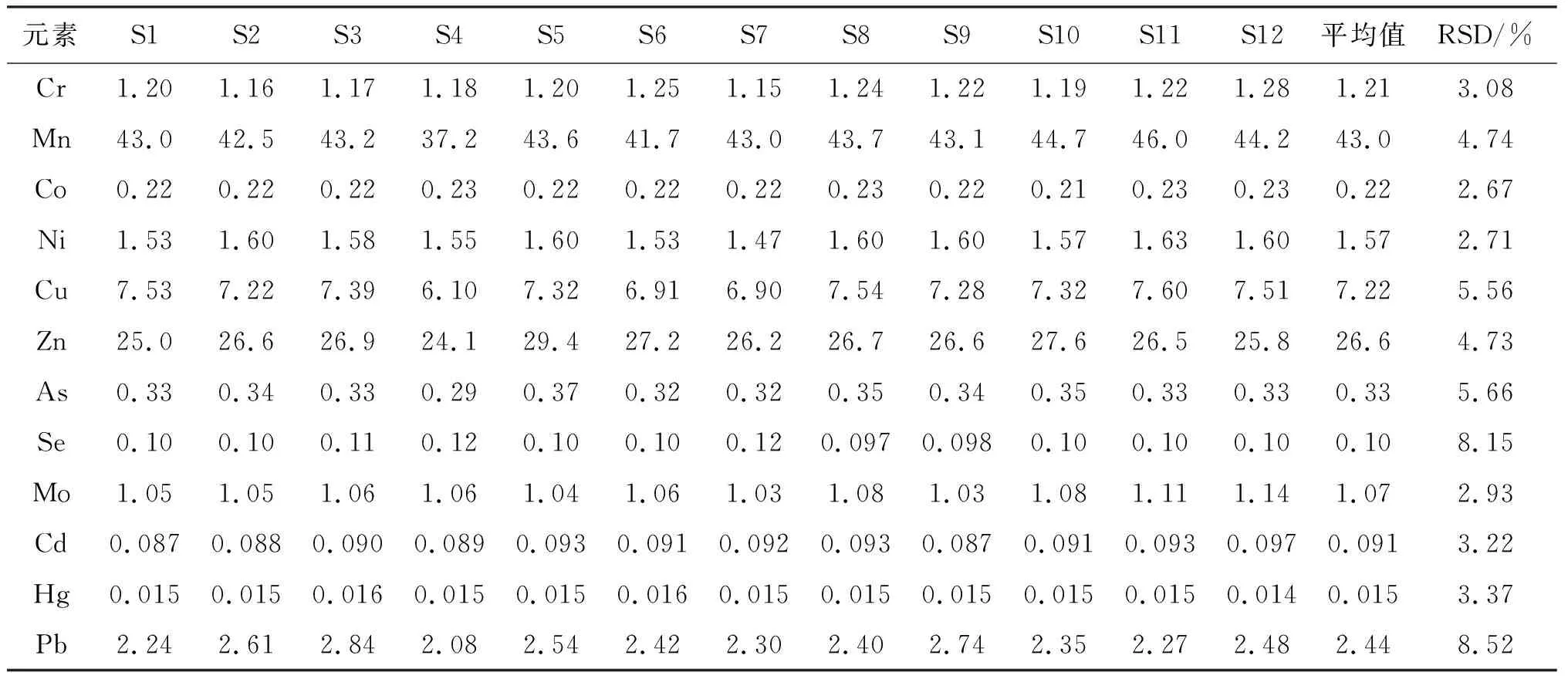
表8 方法的精密度Table 8 Precision of the method
2.5 方法的准确度
制备5种国家一级生物标准物质(GBW10010、GBW10014、GBW10015、GBW10020、GBW10048)溶液(表9),样品经处理后分别测定3 次,再以其平均值作为测定值,大多数样品的元素测定结果与标准值吻合,结果在不确定度范围内,个别样品的个别元素因其定值的不确定性导致测定结果相差较远。方法的准确度能满足实际样品的测定需求。

表9 方法的准确度Table 9 Accuracy of the method
3 结 论
(1) 采用逆王水消解体系微波消解后,使用HR-ICP-MS直接测定植物样品中的Cd、Cr、Ni、Cu、Pb、Zn、Co、Mo、As、Hg、Se、Mn 12种元素,建立了一种简单快捷的植物样品多元素分析方法。
(2) 选择合适的分辨率和内标元素可消除待测元素的多原子离子及双电荷离子的质谱干扰、仪器信号漂移、样品的基体效应。
(3) 国家一级标准物质的测定结果表明,该方法简单便捷、稳定可靠,线性范围宽、检出限低,方法的精密度和准确度均满足实际测定中对植物样品的分析要求,实现了植物样品中微量、痕量元素的同时测定,对植物样品的多种无机元素测定具有广泛的应用前景。

