细胞分裂周期因子25-A与胃癌化疗药物奥沙利铂联合5-氟尿嘧啶耐药的相关性研究
程波,刘巧珍,曹清
(江西省九江市第三人民医院,江西 九江 332000)
胃癌是临床上较为常见的消化道恶性肿瘤之一,相关报道指出,胃癌的发病率和病死率位居我国恶心肿瘤前位[1]。临床以奥沙利铂为基础的联合化疗是治疗晚期胃癌的主要手段,但大部分患者会出现原发或继发耐药,严重影响化疗效果[2]。目前,关于奥沙利铂联合用药在胃癌耐药中的分子机制研究较少,本研究旨在从蛋白水平初步分析胃癌中细胞分裂周期因子25A(cell division cycle 25-A,CDC25A)的表达水平,进一步分析其表达水平与胃癌耐药的相关性,以期为早期胃癌的发现和晚期胃癌化疗方案的制定提供支持,现报道如下。
1 资料与方法
1.1 临床资料 选取2016年7月至2020年11月本院收治的100 例胃癌患者作为观察组,其中男56例,女 44 例;年龄 31~77 岁,平均年龄(53.45±10.51)岁;TNM分期:ⅢB 46例,ⅢC 37例,Ⅳ17例;分化程度:低分化35例,中分化28例,高分化37例;有淋巴结转移54例,无淋巴结转移46例。纳入标准:观察组研究对象均为本院首诊或入院前未经放、化疗等相关治疗;化疗方案为奥沙利铂联合5-氟尿嘧啶,治疗2 个疗程后评估疗效;临床分期均为ⅢB~Ⅳ期;观察组患者均经病理明确诊断为胃癌。排除标准:合并其他恶性肿瘤;临床及病理资料不全或缺失;合并严重基础疾病。根据化疗后疗效评估标准,参照世界卫生组织针对实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST),分为完全缓解、部分缓解、稳定及进展[3],并根据其分为敏感组(完全缓解+部分缓解)和耐药组(稳定+进展)。另选取同期于本院行胃镜检查的100胃炎患者作为对照组,其中男52例,女48例;年龄30~76岁,平均年龄(54.08±9.81)岁。纳入标准:对照组患者均在本研接受治疗;胃镜活检标本均经病理明确诊断为胃炎。排除标准:合并其他恶性肿瘤;萎缩性胃炎或其他特殊类型胃炎;合并严重基础疾病;临床/病理不全或缺失。两组性别、年龄比较差异无统计学意义,具有可比性。本研究经本院医学伦理委员会审核批准。所有患者均对本研究知情同意,并签署知情同意书。
1.2 方法 采集两组患者的胃黏膜组织,通过免疫组织化学SP法检测CDC25A的表达水平,严格按照SP 检测流程进行:经考片、脱蜡、水化处理后,置于浓度3%的双氧水中孵育10 min,然后进行微波抗原修复,滴加一抗后将切片置于4 ℃下过夜。随后加入辣根过氧化物酶(horseradish peroxidase,HRP)标记的二抗,室温孵育2 h 后,用2031 加强型二氨基联苯胺(diaminobenzidine,DAB)显色,孵育1 h,苏木精复染,脱水,透明,最后用中性树胶封固。其中SP 检测试剂盒来自北京中山生物技术有限公司;CDC25A 抗体(ab19204)来自 Abcam 公司;小鼠P27抗人单克隆抗体购自北京中山生物技术有限公司;DAB购自福州迈新技术开发有限公司。用光学倒置显微镜观察免疫组化结果。
1.3 观察指标 免疫组化结果判定标准:CDC25A均以镜下胞浆呈现黄褐色或深黄色颗粒为阳性细胞,每张切片镜下选取3个高倍视野,根据每张切片阳性细胞所占比例和细胞染色程度评分,最后采用半定量积分法综合判断结果。①按阳性细胞所占比例:0分细胞不显色;1分阳性细胞所占比例≤25%;2分阳性细胞所占比例>25%~49%;3分阳性细胞所占比例≥50%。②按细胞染色程度:0分细胞不显色,1分细胞呈浅黄色,2分细胞呈深黄色,3分细胞呈深褐色。评分相加:>3分计为阳性,≤3分计为阴性。
1.4 统计学方法 采用SPSS 19.0 统计学软件进行数据分析,计量资料以“”表示,组间比较采用双样本方差假设t检验,计数资料以率(%)表示,组间比较采用χ2检验,采用Spearman 进行相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 两组CDC25A阳性表达比较 观察组CDC25A阳性率为86.00%(86/100),高于对照组的21.00%(21/100),差异有统计学意义(χ2=84.916,P=0.000)
2.2 CDC25A 表达与胃癌临床病理特征的关系CDC25A 在胃癌组织中的表达水平与分化程度、淋巴结转移、TNM分期有关(P<0.05),与性别、年龄、解剖位置无关,见表2。
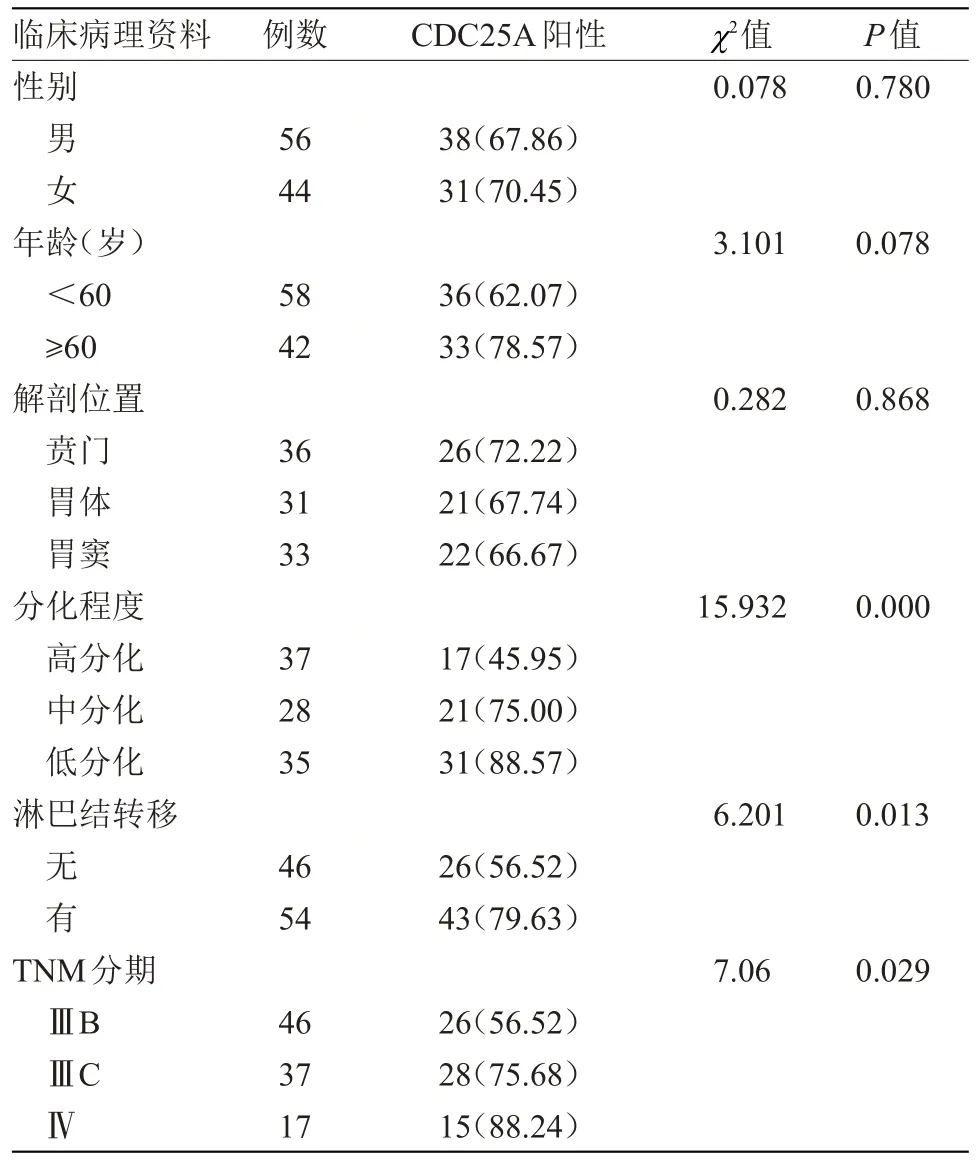
表2 CDC25A与胃癌临床病理特征的关系[n(%)]Table 2 Relationship between CDC25A and clinicopathological features of gastric cancer[n(%)]
2.3 CDC25A 与胃癌化疗药物奥沙利铂联合5-氟尿嘧啶耐药性的相关性 100例胃癌患者中有47例对奥沙利铂联合5-氟尿嘧啶耐药,耐药率为47.00%。敏感组CDC25A阳性表达率低于耐药组,差异有统计学意义(P<0.05)。Spearman 相关性分析显示,CDC25A表达水平与胃癌化疗药物奥沙利铂联合5-氟尿嘧啶耐药成正相关(r=0.582,P<0.05),见表3。

表3 CDC25A与胃癌化疗药物奥沙利铂联合5-氟尿嘧啶耐药性的相关性Table 3 Correlation between CDC25A and drug resistance of oxaliplatin combined with 5-fluorouracil in gastric cancer
3 讨论
肿瘤的发生与多基因密切相关,但大部分肿瘤均存在细胞周期调节絮乱,主要表现为促进细胞增殖或对DNA 损伤的不应答。CDC25A 是细胞周期蛋白依赖性激酶(cyclin-dependentkinase,CDK)的上游调节蛋白,具有双特异磷酸酶活性,已被证实可调节细胞周期和影响细胞凋亡[4]。奥沙利铂联合5-氟尿嘧啶是目前胃癌常用的化疗方案,但该类治疗方案尚未能有效改善晚期转移性胃癌的总生存时间。
本研究结果显示,观察组CDC25A 阳性率高于对照组,差异有统计学意义(P<0.05),提示CDC25A在胃癌组织中表达水平较高,其主要与CDC25A能直接作用于细胞周期蛋白依赖性激酶有关[5]。CDC25A 在胃癌中的表达水平与分化程度、淋巴结转移、TNM 分期相关,主要由于CDC25A 可通过去磷酸化激活CDK1活性,加快细胞周期转换,完成细胞的有丝分裂,促进肿瘤发展[6]。另外,本研究100例胃癌患者中有47 例对奥沙利铂联合5-氟尿嘧啶耐药,而敏感组的CDC25A 阳性率低于耐药组,差异有统计学意义(P<0.05)。Spearman 相关性分析显示,CDC25A 表达水平与胃癌化疗药物奥沙利铂联合5-氟尿嘧啶耐药呈正相关。说明CD25A 的表达能影响胃癌化疗药物奥沙利铂联合5-氟尿嘧啶的耐药性。5-氟尿嘧啶通过在体内转化,可干扰蛋白质的合成,改变DNA 的稳定性,从而抑制肿瘤的发展[7];而奥沙利铂属于第3 代铂类化疗药物,其药理机制与顺铂类似,均可靶向作用于细胞中的DNA,从而阻断肿瘤细胞DNA的复制,进而诱发细胞凋亡[8]。研究[9]认为,肿瘤耐药性可能与细胞微环境改变、膜转运蛋白介导的药物外排及细胞内药物浓度改善、细胞凋亡和增殖异常有关,而CDC25A与细胞凋亡密切相关,可能是其高表达水平能影响奥沙利铂联合5-氟尿嘧啶耐药性的主要原因。
综上所述,CDC25A基因表达水平与分化程度、淋巴结转移、TNM 分期相关,可反映胃癌临床病理特征,且与胃癌化疗药物奥沙利铂联合5-氟尿嘧啶耐药性密切相关。

