奥洛他定与枸地氯雷他定治疗慢性荨麻疹的临床疗效和安全性对比研究
杨惠芳
(赣南医学院第一附属医院皮肤科,江西 赣州 341000)
慢性荨麻疹(chronic urticaria,CU)是一种主要由肥大细胞作用,以皮肤风团、红斑、伴较为剧烈瘙痒为主要特点的皮肤病[1],且易反复发作。CU患者具有变态反应性与自身免疫性特点,致病机制较为复杂,现阶段普遍认为,CU与免疫、慢性感染、遗传等因素相关[2],参与其中的免疫细胞包括肥大细胞、嗜碱性粒细胞、嗜酸性粒细胞、T 细胞等[3-4]。CU 属于自限性疾病,疾病发作后患者皮肤表现的风团、红斑一般会在24 h内自行消退,但相关症状可持续数周甚至数月,部分病情较为严重的患者会出现不同程度的全身症状,如腹痛、腹泻、恶心、疼痛不适、呼吸困难、头晕等,甚至导致焦虑症、抑郁症等心理疾病[5-6],严重影响患者的正常生活。目前,临床以抗组胺药物治疗为主,枸地氯雷他定为H1受体拮抗剂,具有较好的抗炎、抗过敏效果,是治疗CU 的常用药物。奥洛他定是一种新型的H1受体拮抗剂,在国外应用时间较长,目前关于这两种H1受体拮抗剂的应用效果对比研究相对较少。基于此,本研究旨在比较奥洛他定与枸地氯雷他定治疗CU的临床疗效和安全性,现报道如下。
1 资料与方法
1.1 临床资料 选取2019 年7 月至2020 年6 月本院收治的100例CU患者作为研究对象,按照随机数字表法分为研究组和对照组,每组50例。研究组男27 例,女 23 例;年龄 22~65 岁,平均(40.18±6.31)岁;病程3~85 个月,平均(24.16±4.28)个月。对照组男 28 例,女 22 例;年龄 22~67 岁,平均(41.04±6.54)岁;病程2~88 个月,平均(25.05±4.51)个月。两组临床资料比较差异无统计学意义,具有可比性。本研究经本院医学伦理委员会审核批准。纳入标准:均符合《中国荨麻疹诊疗指南(2018 版)》[7]中CU 的相关诊断标准并确诊;病程>6 周者;每周发作≥2 次者;符合奥洛他定、枸地氯雷他定用药指征者;积极配合诊疗与随访工作者;精神状态正常者。排除标准:近1 个月内接受过激素、免疫抑制剂、抗组胺药物等治疗者;免疫功能障碍者;合并其他类型过敏性疾病者;合并重要脏器器质性疾病者;处于特殊生理期的女性;物理因子引起的相关性CU者;合并血液系统疾病者;言语沟通障碍者。
1.2 方法 对照组给予枸地氯雷他定片(广州海瑞药业有限公司,国药准字H20090138,规格:8.8 mg)口服治疗,每次8.8 mg,每天1次。研究组给予盐酸奥洛他定片(北京四环科宝制药有限公司,国药准字H20143415,规格:5 mg)口服治疗,每次5 mg,每天2次。两组均连续用药4 周,期间暂停其他药物。嘱患者治疗期间保持清淡饮食,避免食用致敏性食物;观察和记录风团直径数量、皮疹持续时间、病情发作情况等,记录不适症状,定期回院复诊。明确患者病情控制情况与药源性不良反应发生情况。
1.3 观察指标
1.3.1 临床疗效 参考欧洲MILOR 计分法量化评估患者风团大小与数量、瘙痒程度等,其中瘙痒程度:分值 0~3 分,0 分为无痒感,1 分为轻度痒感,2分为中度但可耐受痒感,3分为重度无法耐受痒感;风团大小:分值0~3分,0分为无风团,1分为直径<0.5 cm,2分为直径在0.5~2 cm,3分为直径>2 cm;风团数量:分值 0~3 分,0 分为无风团,1 分为 1~5个风团,2分为6~12个风团,3分为12个以上风团。于用药前、用药4周后对每位CU患者上述症状进行量化评估,疗效指数=(治疗前后评分差值/治疗前评分)×100%,疗效指数≥90%为治愈;疗效指数在60%~89%为显效;疗效指数在20%~59%为有效;未达上述标准为无效。总有效率=(治愈+显效+有效)例数/总例数×100%。
1.3.2 CU症状积分 于治疗前及治疗4周后,统计两组CU患者风团数量、风团大小、瘙痒程度症状积分,症状积分参考“1.3.1”中相关积分标准。
1.3.3 血清指标 于治疗前、治疗4周后,采集患者外周静脉血3 ml,送入检验科采用3 000 r/min离心机离心处理10 min,取血清,利用生化分析仪(美国贝尔曼库尔特公司,型号:DU5800 型)并采用免疫层析法检测免疫球蛋白E(immunoglobulin E,IgE),试剂盒由武汉明德生物科技股份有限公司生产,采用酶联免疫法吸附法检测白细胞介素-23(interleukin-23,IL-23)及肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),试剂盒由上海康朗生物科技有限公司生产,严格按照试剂盒说明书开展相关操作。
1.3.4 不良反应 比较两组药源性不良反应发生情况,如乏力、口干、头晕头痛。
1.4 统计学方法 采用SPSS 23.0统计学软件处理数据,计量资料以“”表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较 研究组治疗总有效率为98.00%,高于对照组的86.00%,差异有统计学意义(P<0.05),见表1。

表1 两组临床疗效比较[n(%)]Table 1 Comparison of clinical efficacy between the two groups[n(%)]
2.2 两组治疗前后CU症状积分比较 治疗前,两组风团数量、风团大小、瘙痒程度症状积分比较差异均无统计学意义;治疗4 周后,两组风团数量、风团大小、瘙痒程度症状积分均低于治疗前,且研究组低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组治疗前后CU症状积分比较(,分)Table 2 Comparison of Cu symptom scores between the two groups before and after treatment(,scores)

表2 两组治疗前后CU症状积分比较(,分)Table 2 Comparison of Cu symptom scores between the two groups before and after treatment(,scores)
注:与本组治疗前比较,aP<0.05
组别研究组(n=50)对照组(n=50)t值P值治疗4周后0.90±0.14a 1.57±0.35a 12.568<0.001风团数量治疗前2.40±0.21 2.35±0.23 1.135 0.259治疗4周后0.82±0.19a 1.44±0.32a 11.780<0.001风团大小治疗前2.48±0.19 2.46±0.21 0.499 0.619治疗4周后0.80±0.17a 1.51±0.35a 12.903<0.001瘙痒程度治疗前2.38±0.22 2.40±0.21 0.465 0.643
2.3 两组治疗前后血清因子水平比较 治疗前,两组IgE、IL-23、TNF-α 水平比较差异均无统计学意义;治疗4周后,两组IgE、IL-23、TNF-α水平均低于治疗前,且研究组低于对照组(P<0.05),见表3。
表3 两组治疗前后血清炎症因子水平比较()Table 3 Comparison of serum inflammatory factor levels between the two groups before and after treatment()
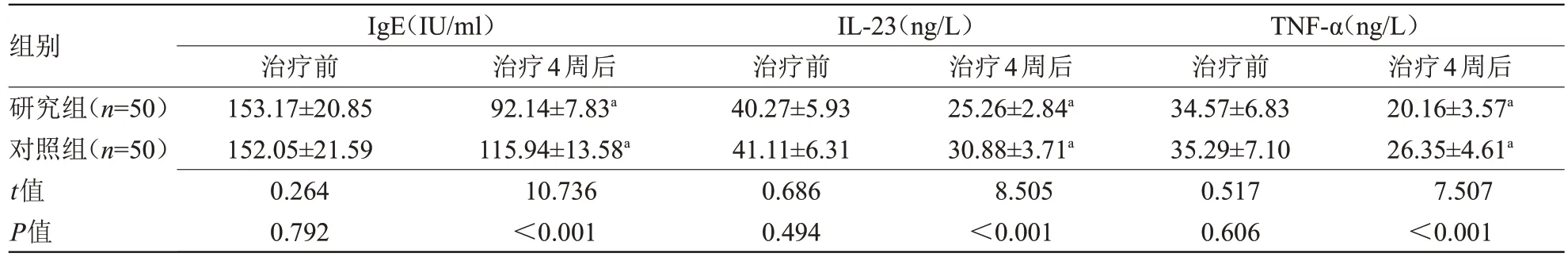
表3 两组治疗前后血清炎症因子水平比较()Table 3 Comparison of serum inflammatory factor levels between the two groups before and after treatment()
注:IgE,免疫球蛋白E;IL-23,白细胞介素-23;TNF-α,肿瘤坏死因子-α。与本组治疗前比较,aP<0.05
组别研究组(n=50)对照组(n=50)t值P值治疗4周后20.16±3.57a 26.35±4.61a 7.507<0.001 IgE(IU/ml)治疗前153.17±20.85 152.05±21.59 0.264 0.792治疗4周后92.14±7.83a 115.94±13.58a 10.736<0.001 IL-23(ng/L)治疗前40.27±5.93 41.11±6.31 0.686 0.494治疗4周后25.26±2.84a 30.88±3.71a 8.505<0.001 TNF-α(ng/L)治疗前34.57±6.83 35.29±7.10 0.517 0.606
2.4 两组药源性不良反应发生率比较 研究组出现口干1 例,乏力1 例,不良反应总发生率为4.00%(2/50);对照组出现头痛头晕1例,口干1例,不良反应总发生率为4.00%(2/50),组间不良反应发生率比较差异无统计学意义。
3 讨论
CU是临床较为常见的皮肤病,多与环境、物理因子、饮食、药物等因素相关,尘螨、海鲜、蛋、奶、河鲜、青霉素、四环素、阿司匹林、酒等是临床诊疗中较为常见的诱发因素[8-9]。近年来随着时代发展,社会环境的改变,CU 发病率逐渐升高。目前,CU 的发病机制尚未完全明确,但其被证实与炎症介质,如白三烯、组胺、花生四烯酸代谢产物等介导的变态反应相关[10]。一项回顾性研究[11]表明,机体T 淋巴细胞、B淋巴细胞及TNF-α、白细胞介素-6等炎症因子均参与了CU的发生与发展过程,直接影响CU患者的预后效果。另外,CU 的发生与细胞免疫密切相关,奥洛他定和枸地氯雷他定给药后均能改善机体细胞免疫状态,促进机体T 淋巴细胞的增殖释放,继而激活机体单核巨噬细胞系统功能,抑制炎症因子与免疫因子的释放,调节细胞免疫失衡状态[12-13]。有研究发现,IL-23、TNF-α 等水平与 CU 疾病活性呈正相关,其中IL-23广泛存在于CU患者皮损处,且有研究提出,二者参与CU的发病机制作用的假说,但尚待进一步证实[14-15]。本研究结果显示,治疗4 周后,两组 IgE、IL-23、TNF-α 水平均低于治疗前,且研究组低于对照组,差异有统计学意义(P<0.05),与张蕾等[16]研究结果一致。提示奥洛他定治疗CU可改善患者血清免疫球蛋白及血清炎症因子水平。枸地氯雷他定在CU 治疗中应用较为广泛,属于哌啶类药物,为第二代抗组胺药,也是目前治疗CU 的一线药物,用药效果与安全性已被证实[17]。地氯雷他定给药后能转化为地氯雷他定,通过与H1受体高亲和性结合抑制过敏物质的释放,从而控制CU 症状体征,同时还能对肥大细胞功能产生作用,降低机体组胺等炎症物质的水平,有效改善机体炎症状态。奥洛他定是一种新型的、高度选择性拮抗H1受体的药物,能稳定肥大细胞细胞膜,通过抑制Ca2+内流,抑制组胺释放,减少机体白细胞介素水平,从而发挥与枸地氯雷他定一致的抗过敏、抗炎作用。与此同时,奥洛他定还能有效抑制机体白三烯、血小板活化因子、趋化因子等炎症介质,进一步增强抗炎效果。有研究[18]显示,奥洛他定能通过抑制肿瘤坏死因子对黏附分子的刺激,发挥降低机体组胺水平的作用。本研究结果显示,治疗4 周后,研究组风团数量、风团大小、瘙痒程度症状积分均低于对照组,治疗总有效率高于对照组,差异均有统计学意义(P<0.05)。两组用药期间不良反应发生率比较差异无统计学意义。提示奥洛他定治疗CU 的临床疗效优高于枸地氯雷他定,可显著改善患者的临床症状,但用药安全性均较高。第二代抗组胺药种类较多,被批准应用于临床的此类药物均为不良反应轻微,对脏器损害风险低的药物,因而奥洛他定和枸地氯雷他定的用药安全性毋庸置疑,而关于两种药物用药安全性比较,尚待未来临床纳入大样本量进行深入研究。
综上所述,奥洛他定与枸地氯雷他定治疗慢性荨麻疹的安全性均较高,但奥洛他定在提高临床疗效,降低症状积分,改善血清免疫和炎症因子水平方面优势突出,值得临床推广应用。

