烟曲霉孢子侵染小鼠骨髓源巨噬细胞的转录组研究
徐凤娇 娄新宇 王远舟 韩子宇 仲国维
(1.南京医科大学公共卫生学院,南京 211166;2.南京市雨花台区疾控中心检验科,南京 210012)
烟曲霉(Aspergillusfumigatus)是环境中常见的一种条件致病真菌,可引起免疫正常人群过敏症状,免疫功能低下人群可进展为侵袭性肺曲霉病,有一定的死亡率[1]。巨噬细胞可吞噬并清除入侵的分生孢子。该过程主要依靠巨噬细胞膜表面受体与孢子细胞壁表面的β-(1,3)葡聚糖配体的相互识别[2],其中涉及到的受体有Toll样受体(Toll like receptors, TLRs)、树突状细胞相关C型植物凝集素1(dectin-1)、衔接蛋白髓样分化因子88(MyD88)等[3]。受体对配体的识别迅速触发了巨噬细胞对烟曲霉分生孢子的吞噬作用[4-5]。吞噬作用通常依赖肌动蛋白和肌球蛋白等运动蛋白以及酪氨酸激酶和磷酸肌醇-3-磷酸激酶等介导的细胞骨架系统局部重排,形成吞噬杯对孢子进行吞噬[6]。
巨噬细胞对吞噬后的孢子发挥杀灭作用依赖于免疫通路诱导的细胞因子的释放以及其自身产生的活性氧中间体。研究发现,大鼠肺泡巨噬细胞表面受体TLR2、TLR4均能介导核因子(nuclear factor-κB, NF-κB)的活化,核因子可进一步通过激活转录并释放白介素IL-1β和肿瘤坏死因子α(TNF-α)[7]。酵母中dectin-1能与TLR2协同诱导巨噬细胞系TNF-α、IL-1β、IL-12以及趋化因子MIP-2等细胞因子的产生,另外还可诱导NADPH氧化酶(NOX)的活化来调节细胞免疫应答[8]。烟曲霉孢子侵染巨噬细胞系也会激活NADPH氧化酶,产生活性氧簇ROS,而ROS可通过诱导自噬降解细胞内的烟曲霉孢子[9]。
我们通过小鼠骨髓源巨噬细胞(bone marrow-derived macrophages, BMMs)来进一步研究发掘巨噬细胞响应烟曲霉孢子侵染过程中发挥重要作用的基因,首先提取了小鼠原代骨髓细胞并在体外将其培养诱导分化成BMMs;其次,用烟曲霉A1160c菌株的孢子去侵染BMMs;最后,将感染组与未感染对照组的BMMs进行RNA测序和比较分析,寻找感染过程中和孢子吞噬、免疫信号通路以及孢子清除相关的重要差异表达基因。
1 材料和方法
1.1 实验材料
本研究所用材料及来源如下:生物安全柜、细胞培养箱(Thermo),RPMI1640培养液和胎牛血清(Gibco),青霉素-链霉素、胰蛋白酶(Beyotime),TRIzol reagent、MCSF(Invitrogen),C57BL/6小鼠(Slaccas)。烟曲霉野生型对照菌株为A1160c株,来自于本实验室菌库。本研究所用培养基为YAG丰富培养基,具体配制见参考文献[10]。将A1160c孢子接种到YAG平板上,37℃培养2 d左右,用含有0.02%吐温-80水溶液收集孢子,40 μm滤膜过滤掉菌丝,PBS洗两次,血球计数板调整计数后待用。
1.2 BMMs的分离、培养和感染
依据之前报道[11-12]的方法。从8至12周龄的C57BL/6小鼠获得股骨和胫骨,75%乙醇消毒并用PBS冲洗,剪断骨两端。用1 mL注射器吸取RPMI 1640完全培养基冲洗取出骨髓细胞,吹散并过200目细胞筛,离心弃上清。加入2 mL红细胞裂解液重悬静置5 min,离心弃上清。沉淀用PBS清洗两次,将骨髓细胞重悬于含有2 mmol/L L-谷氨酸、50 mg/L庆大霉素、100 U/mL青霉素/链霉素、10%胎牛血清和20 ng/mL巨噬细胞集落刺激因子(MCSF)的RPMI 1640完全培养基中,分装于6孔细胞培养板(1×106个细胞/孔)中,置于37℃和5% CO2的细胞培养箱中培养。第3天补充新鲜培养基。细胞孵育6 d后进行孢子感染实验。感染时,用1×107个孢子/孔的数量来感染BMMs(分生孢子与BMMs的比例为10∶1)作为实验组,同时未做感染处理的细胞作为对照组,每组样品3个生物学重复,同时孵育8 h。之后通过用冰冷的PBS洗涤BMMs来停止感染,收集细胞,迅速液氮淬灭。
1.3 文库构建和上机测序
用TRIzol©Reagent从样品中分离总RNA,Nanodrop 2000检测RNA的浓度和纯度。建库试剂盒为NEBNext©UltraTM RNA Library Prep Kit。通过 Oligo(dT)磁珠富集带有polyA尾的mRNA。加入NEB Fragmentation Buffer用二价阳离子将得到的mRNA随机打断成200 bp左右的小片段。以片段化mRNA为模版,用M-MuLV逆转录酶和随机引物合成cDNA第一条链。随后RNase H降解RNA链并合成cDNA第二条链。纯化后的双链cDNA经过加入End Repair Mix将其补成平末端、3'末端加A尾并连接测序接头adapter。用AMPure XP beads筛选350 bp左右的cDNA,进行PCR扩增并再次使用AMPure XP beads纯化PCR产物,最终获得文库。文库定量并稀释至1.5 ng/μL。使用HiSeq PE Cluster Kit v4-cBot-HS在cBot Cluster Generation System上进行样本聚类。在聚类完成后,把不同文库按照有效浓度及目标下机数据量pooling后进行Illumina测序(Illumina Hiseq X-Ten,Origin-gene Bio-pharm)。
1.4 转录组数据生成和分析
首先用Cutadap修剪reads中的adapter序列、5'端含有非AGCT的碱基、测序质量值小于Q20的reads、含N的比例达到10%的reads以及长度小于25 bp的小片段。用FastQC (http://www.bioinformatics.babraham.ac.uk/projects/fastqc/)对修剪后的序列进行质量验证。用Hisat2将所得的reads与参考基因组小鼠GRCm38(Ensemble92)比对,将比对到参考基因组上的数据用StringTie装配。
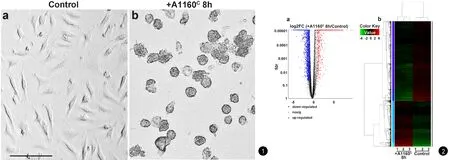
在用edgeR package筛选差异表达基因检测过程中,以1 将获取的C57BL/6小鼠骨髓细胞经诱导后,在第6天通过光学显微镜观察细胞形态。从图1可以看出,未被分生孢子感染的对照组BMMs形态多样且呈不规则形(见图1a),说明巨噬细胞分化和贴壁生长状态良好;而被烟曲霉A1160c分生孢子侵染8 h的BMMs,由于吸附和吞噬了大量烟曲霉分生孢子,细胞形态膨胀成圆形(见图1b)。 图1 烟曲霉A1160c分生孢子侵染BMMs. a. 对照未处理BMMs; b. A1160c分生孢子侵染8 h(分生孢子与巨噬细胞的比例为10∶1)之后的BMMs(比例尺为100 μm) 图2 对照组BMMs与A1160c感染组BMMs之间差异基因表达统计. a. 差异基因表达的火山图:红色代表上调,蓝色代表下调,黑色代表不显著;b. 差异表达基因的分层聚类树状图:红色代表上调,绿色代表下调 将A1160c分生孢子感染组的BMMs与未处理组BMMs的转录组测序数据进行分析比较,总共有4 870个基因被鉴定为DEGs (differentially expressed genes)(P<0.05,-1>log2FC> 1),包括1 787个上调基因和3 093个下调的基因,下调DEGs数量明显多于上调DEGs数量(见图2和https://github.com/eWingEye/CNN_Aspergillus)。 本次结果中,BMMs与烟曲霉分生孢子识别相关的细胞表面Toll样受体Tlr2及其互作基因Tollip分别上调2.94和4.26倍;C型植物凝集素受体Clec4e和Clec5a的表达分别上调31.40和2.43倍。而与BMMs吞噬孢子相关的差异表达基因有Src和Myh10,分别上升4.36倍和2.40倍。 基于KEGG通路注释,BMMs响应分生孢子侵染过程中的免疫信号通路包括Toll样受体信号通路、NF-κB信号通路(见图3)、Janus激酶/信号转导与转录激活子(Janus kinase/signal transducers and activators of transcription, JAK/STAT)信号通路、B细胞受体和T细胞受体信号通路均被不同程度地激活。 图3 NF-κB通路差异表达基因 KEGG通路注释图。图中有红色/蓝色边框的基因属于差异表达基因,其中红色代表上调基因,蓝色代表下调基因 分析上述免疫通路中表达上调的基因,其中起免疫正调控的基因有白介素及其受体如Il1a、Il1b、Il7r等,分别上调72.29、8.42和7.29倍;肿瘤坏死因子TNF家族中的Tnf、Traf1、Tnfsf14(Light)、Tnfrsf13c、Ltb等,分别上调53.57、7.95、3.85、3.73和3.49倍;酪氨酸激酶中的Lck和Tec都上调3.31倍;T-细胞激活连接蛋白Lat上升13.23倍;核因子NF-κB家族中的Nfκb1(p50)和Relb分别上调2.20和2.34倍;黏膜相关淋巴组织淋巴瘤转位基因Malt1上升14.27倍;生长抑制DNA损伤基因Gadd45b升高44.97倍;环氧化酶Ptgs2(cox-2)升高340.07倍;原癌基因Jun升高17.36倍;糖原合成酶激酶Gsk3b升高2.06倍;细胞表面抗原Cd83、Cd200、Cd40、Cd109和Cd28等,分别上调19.52、16.77、9.82、9.18和7.67倍。发挥免疫负调控作用的基因如Il1rn、Tnfaip3、Socs1、Socs3、Cish、Ctla4、Cblb、Cdkn1a、Lilrb4、Nfκbia(Iκba)等,分别上调31.88、16.05、4.50、4.35、4.39、4.12、3.83、3.45、3.27和3.64倍。此外,趋化因子及其受体受体Cxcl1、Cxcl2、Cxcl10、Ccl2、Ccl3、Ccl4、Cxcr5、Ccrl2、Ccr6和Ccr7等的表达也分别增加了136.93、825.54、14.21、19.36、81.10、130.43、4.62、78.17、4.93和4.90倍。 与活性氧簇ROS产生的相关基因中,Nos2、Nlrp3、Hif1a和Bax,分别上调24.15、4.47、2.01和2.34倍;Glul和Nostrin都降低了55%。抗凋亡因子Bcl2、Bcl2l1和Mcl1的表达水平也均上调。 巨噬细胞通过表面模式识别受体如TLRs和dectin-1识别烟曲霉孢子细胞壁上的β-(1,3)葡聚糖,并对细胞骨架进行重组,从而产生依赖酪氨酸激酶和磷酸肌醇-3-磷酸激酶活性的孢子吞噬,进一步通过相关细胞因子的分泌和天然免疫应答对真菌产生免疫响应[13]。本研究显示,烟曲霉孢子激活了BMMs的Toll样受体基因Tlr2、C型凝集素受体基因Clec4e和Clec5a。这说明Tlr2、Clec4e和Clec5a是本研究中BMMs的主要识别受体,尤其是Clec4e基因转录上调了31.40倍。另外,非受体酪氨酸激酶Src和肌球蛋白Myh10表达上调,说明巨噬细胞对烟曲霉孢子产生了吞噬作用[6]。 BMMs接触孢子后,信号被细胞表面受体传至NF-κB、JAK-STAT、B细胞和T细胞受体等免疫信号通路,导致这些通路在不同程度上被激活。免疫调控基因如白介素Il1、肿瘤坏死因子Tnf家族、酪氨酸激酶、NF-κB家族和细胞表面抗原等转录水平的上调,都表明烟曲霉孢子的侵染引发了BMMs的强烈免疫响应。其中,被激活的核因子NF-κB可将刺激信号传递到细胞核中激活Tnf和Il1b等细胞因子的转录水平,Il1b能够促进产生趋化因子及其受体,而Tnf可以活化和调节巨噬细胞提高其清除病原的能力以及增强超氧阴离子产生等[14](见图3)。另外,NF-κB通路抑制基因Nfκbia(Iκba)、Nfκbie和Nfκbib的转录水平也上调,这表明该通路同时被负调控,对维持细胞稳定性起重要作用。 缺氧状态下,缺氧诱导因子HIF-1作为转录因子调节多种基因的转录[15]。转录组数据中Hif1a的上调说明BMMs内有可刺激细胞产生ROS的低氧环境。一氧化氮合酶编码基因Nos2转录上调,推测可直接合成NO辅助杀菌。NO可促进促凋亡蛋白BAX的表达[16],而ROS可以作为NLRP3炎症小体被激活的信号[17-19]。转录组测序结果中也发现了Bax和Nlrp3基因的上调,这间接提示BMMs内有NO生成。一氧化氮合酶运输因子NOSTRIN能将一氧化氮合酶从质膜运输到囊泡中,从而减少NO的释放[20]。谷氨酰胺能够抑制NO的过度产生[21]。测序结果显示Nostrin和谷氨酰胺合成酶Glul基因下调,说明BMMs需要NO来引发炎症反应和对烟曲霉孢子的杀灭。综上,我们的研究增加了对烟曲霉感染过程中小鼠骨髓源巨噬细胞基因表达和信号通路调控的认识。2 结 果
2.1 烟曲霉A1160c孢子感染BMMs
2.2 BMMs感染组与对照组间的差异表达基因数量
2.3 与吞噬、免疫和ROS产生相关基因的改变

3 讨 论

