妊娠早期血清补体C1q/肿瘤坏死因子相关蛋白3对妊娠期糖尿病的影响及预测价值:一项前瞻性研究
张丽倩,郭艳巍,许倩,杨珽2,,毛淑芳
妊娠期糖尿病(gestational diabetes mellitus,GDM)以胰岛β细胞功能受损和胰岛素抵抗为特征,是妊娠期间首次被识别的任何程度的葡萄糖不耐受[1]。随着生育年龄推迟、不合理饮食习惯及肥胖的流行,GDM发病率呈逐年上升趋势[2],我国GDM发病率为13.0%~20.9%[3-6]。随着母体血糖的升高,孕产妇、胎儿及新生儿不良结局的发生风险均增加[7]。分娩后部分GDM患者血糖水平可以恢复正常,17%~63%的妇女在分娩后5~16年发展为2型糖尿病,子代在成年早期发生代谢综合征的风险也升高[8-9]。对GDM患者进行筛查、诊断和治疗可改善不良妊娠结局及新生儿短期预后[10],但不能改善对新生儿长期不良结局的影响,且GDM筛查时机尚存争议[11]。因此,在妊娠早期对GDM进行预测并及时进行有效干预尤为重要。
妊娠期糖代谢的紊乱是GDM发生的基础,但发生机制尚不完全清楚。肥胖与胰岛素抵抗、糖尿病的发生密切相关,而补体C1q/肿瘤坏死因子相关蛋白3(complement-C1q/tumor necrosis factor-related proteins,CTRP3)作为脂肪因子超家族中的一员,参与了肥胖、胰岛素抵抗等多种内分泌过程[12-15],推测脂肪细胞因子引起的代谢紊乱可能与GDM的发生有关。一项关于妊娠24~28周女性的研究发现,GDM组孕妇血清
CTRP3水平低于糖耐量正常(normal glucose tolerance,NGT)组,CTRP3与胰岛β细胞功能呈正相关,与胰岛素抵抗呈负相关[16],提示血清CTRP3可能参与了GDM的发生、发展过程。但妊娠早期血清CTRP3是否影响GDM的发生及其对GDM的预测价值如何,尚未完全明确。本研究主要探讨妊娠早期血清CTRP3对GDM的影响及预测价值,为GDM防治提供新思路。
1 资料与方法
1.1 临床资料 前瞻性连续选取2018年6月至2019年3月在承德医学院附属医院产科门诊正规产检的妊娠早期女性为研究对象。研究对象均签署知情同意书。本研究已通过承德医学院附属医院医学伦理委员会的批准(批准文号LL027)。
1.2 纳入标准 承德市常住居民,年龄18~45岁,自然受孕,单胎,孕周6~14周,计划在承德医学院附属医院分娩。
1.3 排除标准 患有1型或2型糖尿病、慢性高血压,妊娠前有经药物治疗的血脂异常、心血管疾病等,活动性或慢性肝、肾或其他器官疾病,近3个月内有急性或慢性感染史,有吸烟史、饮酒史,近期服用影响糖代谢的药物。
1.4 研究方法
1.4.1 一般资料采集 妊娠女性首诊时,通过面对面访谈的形式完成基本信息的采集,内容包括年龄、民族、身高、孕周、孕产史及妊娠前1个月体质量。身高测量精确到1.0 cm,体质量测量精确到0.5 kg。体质指数(body mass index,BMI)= 体质量(kg)/身高(m)2。
1.4.2 实验室检查指标 研究对象均在妊娠6~14周,空腹8~12 h后第2天晨起8:00~9:00采集肘上静脉血,用于检测空腹血糖(fasting plasma glucose,FPG)、空腹胰岛素(fasting insulin,FINS)、糖化血红蛋白(glycated hemoglobin,HbA1c)、三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)、 低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)。另用无抗凝剂的试管采集肘上静脉血5 ml,室温静置1 h后在2~8 ℃以3 500 r/min离心10 min,离心半径15 cm。取上清液2 ml置于-80 ℃冰箱冻存,用于测定CTRP3。使用商用酶联免疫试剂盒(人C1q/肿瘤坏死因子相关蛋白3酶联免疫试剂盒,CUSABIO公司,中国)测定CTRP3,所有样本设置复孔检测,如果检测结果相差>15%时再次复测。检测范围:0.156~10.000 μg/L,灵敏度0.039 μg/L,批内差变异系数(CV)<8%,批间差CV<10%,与其他相关蛋白无交叉反应。
1.5 GDM筛查及诊断标准 妊娠24~28周行75 g口服葡萄糖耐量试验(75 g oral glucose tolerance test,75 g OGTT)筛查GDM。FPG、1 h血糖、2 h血糖诊断GDM的界值分别为5.1 mmol/L、10.0 mmol/L、8.5 mmol/L。3项中的1项达到标准则诊断为GDM,血糖正常者为NGT。根据筛查结果分为GDM组和NGT组。
1.6 统计学方法 采用SPSS 19.0软件建立数据库并进行统计分析,不符合正态分布的计量资料以M(P25,P75)表示,并行独立样本Wilcoxon秩和检验;计数资料以率或构成比描述并行χ2检验;GDM的影响因素分析采用多因素Logistic回归分析(多因素Logistic回归分析的检验水准为α入=0.05,α出=0.10),构建GDM预测模型并用Hosmer-Lemeshow拟合优度检验评价其校准度。采用MedCalc 19.0.7软件绘制CTRP3及联合预测模型预测GDM的受试者工作特征(ROC)曲线,计算灵敏度、特异度、ROC曲线下面积(AUC)及其95%CI,AUC间的比较采用Delong检验。以P≤0.05为差异有统计学意义。
2 结果
2.1 研究对象的一般资料、实验室检查指标及GDM发病情况 本研究共纳入妊娠早期女性393例,因胚胎停育或胎儿畸形终止妊娠者10例、失访7例、未检测75 g OGTT者7例、1例GDM患者在纳入分析时年龄超过45岁,最终纳入分析368例,年龄20~45岁,中位年龄29.0(27.0,32.0)岁,30岁及以上者占41.8%(154/368);基线孕周7~14周,中位基线孕周〔12.4(12.0,13.0)〕周,有分娩史的孕妇占42.1%(155/368);妊娠前BMI≥24 kg/m2的孕妇占36.1%(133/368)。
妊娠24~28周75 g OGTT结果显示,368例孕妇中81例诊断为GDM(GDM组),GDM发病率为22.0%,287例为NGT(NGT组)。两组研究对象的年龄、妊娠前BMI及FPG、FINS、HbA1c、TG比较,差异均有统计学意义(P<0.05),而民族构成、基线孕周及TC、HDL-C、LDL-C比较,差异均无统计学意义(P>0.05),见表1。
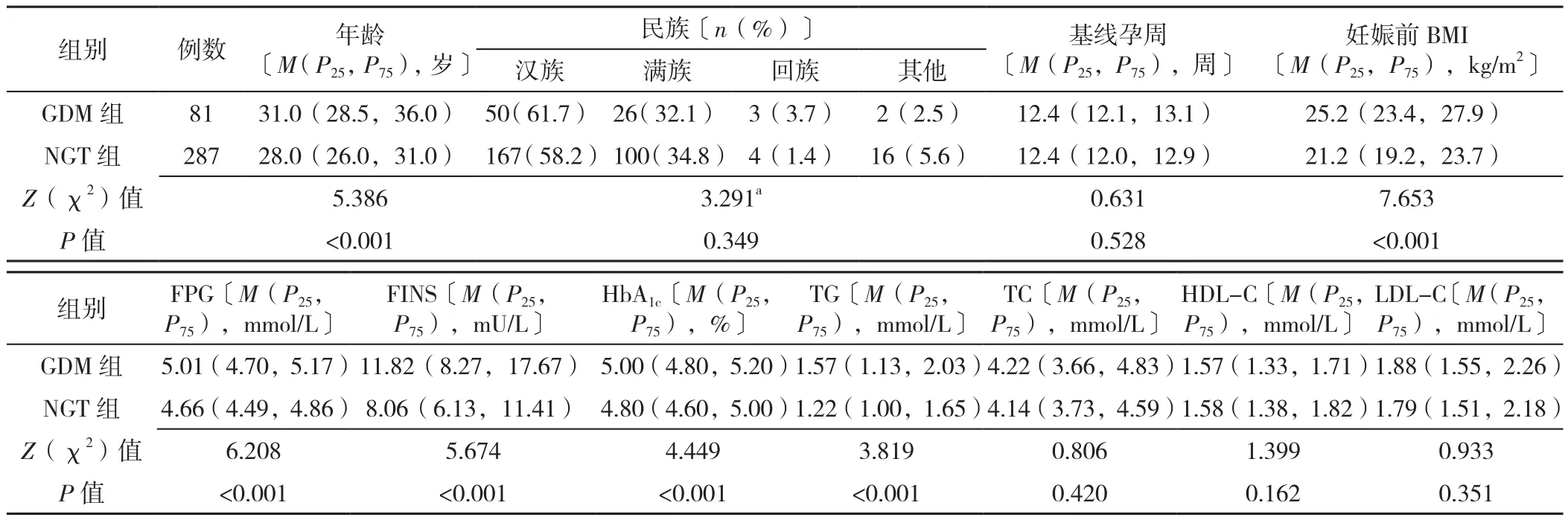
表1 GDM组与NGT组孕妇的一般资料及实验室检查指标比较Table 1 Comparison of general demographic characteristics and laboratory indices between women in early pregnancy with gestational diabetes mellitus and normal glucose tolerance
2.2 GDM组与NGT组孕妇妊娠早期血清CTRP3水平比较 GDM组孕妇妊娠早期血清CTRP3水平为0.528 0(0.461 3,0.634 0)μg/L,低于NGT组的0.604 8(0.510 8,0.666 0)μg/L,差异有统计学意义(Z=3.368,P=0.001)。
2.3 妊娠早期不同血清CTRP3水平妇女的GDM发病率比较 将妊娠早期妇女按血清CTRP3的四分位数水平分为4个亚组,分别为89、94、92、93例。依据妊娠24~28周75 g OGTT结果,4个亚组孕妇GDM发病率比较,差异有统计学意义(P<0.05),见表2。

表2 妊娠早期不同血清CTRP3水平亚组GDM发病率比较〔n(%)〕Table 2 Comparison of the incidence of gestational diabetes mellitus among women in early pregnancy by serum CTRP3 ratio level
2.4 血清CTRP3水平与GDM关系的多因素Logistic回归分析 以妊娠24~28周GDM筛查结果为因变量(赋值:GDM=1,NGT=0),以年龄、妊娠前BMI、FPG、FINS、HbA1c、TG及CTRP3为自变量(自变量赋值:实测值)进行多因素Logistic回归分析,结果显示,CTRP3是GDM发生的影响因素(P≤0.05),见表3。根据多因素Logistic回归分析结果,采用妊娠早期母体特征、糖代谢指标及CTRP3建立GDM的联合预测模型,即P=1/{1+1/exp[-(0.135× 年龄 +0.227×妊娠前BMI+1.515×FPG+0.712×HbA1c-2.289×CTPR3-20.190)]}。Hosmer-Lemeshow拟 合优度检验结果显示,联合预测模型预测值与实际值差异无统计学意义(χ2=8.416,P=0.394),联合预测模型有较好的校准能力。

表3 GDM影响因素的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of influencing factors of gestational diabetes mellitus
2.5 血清CTRP3及其与联合预测模型对GDM的预测价值 早期血清CTRP3与联合预测模型预测GDM的截断值、灵敏度、特异度见表4。联合预测模型预测GDM的AUC大于血清CTRP3,差异有统计学意义(Z=5.634,P<0.001),见表4、图1。

表4 妊娠早期血清CTRP3与联合预测模型预测GDM的临床价值Table 4 Predictive values of serum CTRP3 ratio and its combined use with age,pre-pregnancy BMI,fasting plasma glucose,and glycosylated hemoglobin for gestational diabetes mellitus among women in early pregnancy
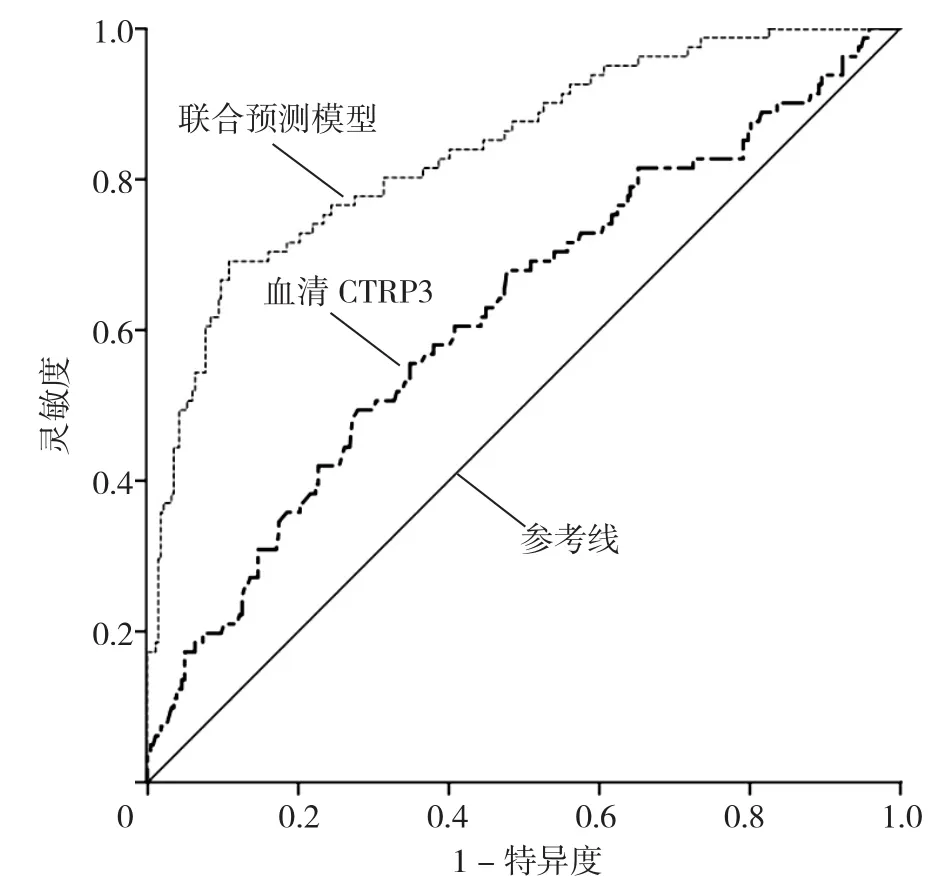
图1 妊娠早期血清CTRP3及联合预测模型预测GDM的ROC曲线Figure 1 ROC analysis of serum CTRP3 ratio and its combined use with age,pre-pregnancy BMI,fasting plasma glucose,and glycosylated hemoglobin in predicting gestational diabetes mellitus among women in early pregnancy
3 讨论
3.1 本研究孕妇有较高的GDM发病率 近年来,GDM的发病率在世界范围内呈现逐年增加趋势,但不同研究结果差异较大。本研究显示GDM发病率为22.0%,高于国内外多数研究结果[3-6,17-18],但与国内报道的北京通州地区采用相同诊断标准诊断出的GDM发病率(22.7%)相近[19]。本研究纳入的研究对象中位年龄为29.0岁,30岁及以上者占41.8%。已有多项研究发现,高龄是GDM发生的独立危险因素[20-21],高GDM发病率可能与生育政策调整、主动推迟生育等所致高龄孕妇比例增加有关[22]。肥胖是GDM发生的独立危险因素,GDM的发生风险随妊娠前BMI的增加而增加[23]。本研究妊娠前超重及肥胖(BMI≥24 kg/m2)的比例为36.1%,高于同类研究人群(25.04%)[20],这可能是导致本研究GDM发病率较高的另一个主要原因。
3.2 妊娠早期母体血清CTRP3水平影响GDM的发生 既往研究发现,妊娠24~28周GDM组孕妇和NGT组相比,血清CTRP3水平明显降低,FPG、FINS升高,GDM组血清CTRP3与FPG呈负相关,提示妊娠期血清CTRP3与GDM有关[16]。本研究结果与之相符,研究发现GDM组妊娠早期FPG、FINS均高于NGT组,CTRP3水平降低,提示妊娠早期CTRP3的降低可能导致了糖代谢紊乱,血糖的升高导致胰岛β细胞功能开始亢进以分泌更多的胰岛素来进行代偿,随着妊娠进展,胰岛β细胞功能受损会逐步显现,进而导致GDM的发生。本研究显示,随着妊娠早期母体血清CTRP3水平的升高,GDM发病率降低;多因素Logistic回归分析显示,妊娠早期血清CTRP3水平与GDM发生有关系,提示CTRP3为GDM的一个独立保护性因子,妊娠早期即可能参与了GDM的发生过程,但具体机制尚不清楚。PETERSON等[24]研究发现,CTRP3通过激活丝/苏氨酸蛋白激酶信号传导通路来抑制葡萄糖6磷酸酶和磷酸烯醇式丙酮酸羧激酶的表达,进而抑制糖异生;CTRP3能升高3T3-L1模型小鼠前脂肪细胞对葡萄糖的摄取能力且不依赖于胰岛素的存在而发挥生物学效应,提示CTRP3作为一种独立因素参与血糖的调节。
3.3 妊娠早期母体血清CTRP3对GDM的预测价值合理的生物标志物可能会改善妊娠早期GDM的预测。考虑到肥胖与胰岛素抵抗和GDM的发展相关,脂肪因子可以进一步改善模型的表现[25]。本研究显示,血清CTRP3预测GDM发生的AUC为0.622,以≤0.524 2 μg/L为截断值的灵敏度为49.38%,特异度为72.13%,说明CTRP3具有预测GDM的价值,可能成为预测GDM的一个候选妊娠早期生物标志物。尽管其对GDM的单独预测价值一般,但在联合母体因素及糖代谢指标后,AUC从0.622升高到0.841,特异度为89.20%,预测价值明显提高,因此CTRP3作为新兴标志物对GDM的预测价值不容忽视。
本研究纳入人群来自河北省承德市一家三甲医院的产检孕妇,未采用多中心研究,且样本含量较小,会影响研究对象的代表性,限制研究结果的推广。
综上所述,妊娠早期母体血清CTRP3升高可降低GDM的发生风险,是GDM的独立预测因子,与母体特征及代谢指标联合对GDM具有较好的预测价值。
作者贡献:张丽倩、毛淑芳提出研究思路,确定主要研究目标,负责研究设计并对研究监督管理,研究实施,前瞻性选取病例,收集并整理临床资料,撰写论文初稿;郭艳巍、毛淑芳进行研究质量控制及审校;张丽倩、杨珽参与病例资料收集;张丽倩、许倩负责研究的实施、评估、技术操作;毛淑芳确定论文终稿,对论文负责。
本文无利益冲突。

