宏微视角下认识物质“位—构—性”之间的关系
浙江 刘忠英
在高中化学学科的核心素养之中,宏观辨识与微观探析是最能体现化学学科特点的一个核心素养维度。对于物质来说,“结构决定性质,性质反映结构”是化学学科的学科思想。脱离了物质结构谈物质性质,化学无异于经验学科,知识也就成了一盘散沙,物质结构正是物质性质的灵魂所在。物质结构的涵义比较丰富,包括原子结构、分子结构、晶体结构等,在分析问题过程中,对物质的结构指向要明确。物质在从微观聚集成为宏观的过程中,其聚集的方式、表现出的性质也与其结构直接相关。原子聚集成宏观物质的方式,可总结如表1所示。

表1 原子聚集成宏观物质的方式
从表1中可以看出,原子形成宏观物质的方式,一般与元素的原子结构有关,对于活泼金属元素,要形成化合物只有一种方式——失去电子形成简单阳离子,再与阴离子形成离子化合物,所以含活泼金属元素(或者铵根)的化合物多为离子化合物,这也是判断离子化合物的重要依据。而对非金属元素而言,聚集为宏观物质的路径要多一些,非金属性强的元素可以得到电子形成单核阴离子,也可以和氧元素等非金属“组团”得到电子,形成复杂的阴离子,再通过离子键与阳离子形成离子化合物,还可以直接通过共用电子对形成小分子。实现微粒聚集的推动力是微粒间的作用力,微粒不同,作用力也不同,体现出宏观物质的性质也不同,如由离子聚集而成的物质熔沸点一般比较高,熔融态下可以导电;由分子聚集而成的物质一般熔沸点低,硬度小。
一、原子结构和元素性质
原子形成化合物的最终目的是实现最外层2个电子或8个电子达到稳定结构(Be、B等原子形成的部分化合物例外),一种元素的原子达到稳定结构后,化合价的数值(得失电子的数目或者共用电子对的数值)是确定的。原子结构中,原子核对核外电子有吸引作用,核外电子层之间有排斥作用,原子的核外电子排布还可以反映出原子的半径大小,从而可以判断出元素的金属性与非金属性的强弱,金属性与非金属性的强弱可以由其发生的一些化学反应的事实得到印证。具体来说:元素非金属性越强,其最高价氧化物对应的水化物酸性越强,氢化物也越稳定;元素金属性越强,其最高价氧化物对应的水化物的碱性越强,其单质越容易置换出水或酸中的氢。中学阶段的一些试题侧重于从微观角度来比较原子序数、最外层电子数、原子半径、离子半径,从宏观角度认识物质中的元素的主要化合价、金属性和非金属性等性质。
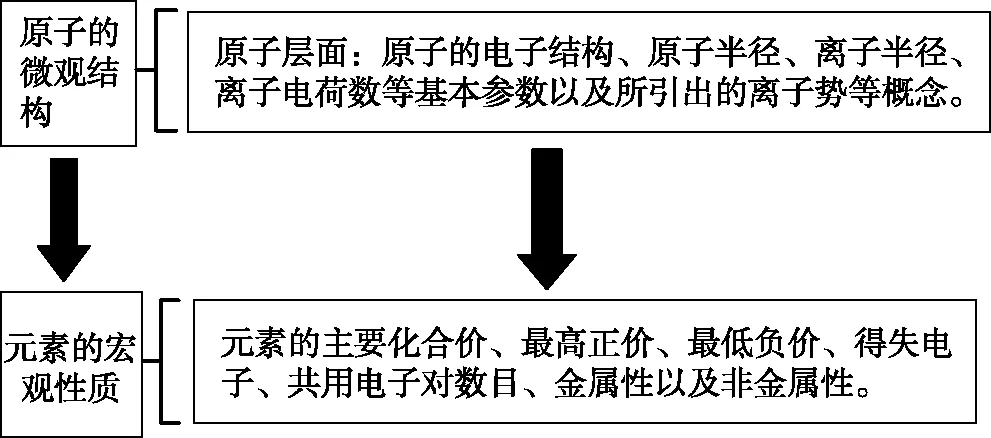
图1 原子结构与元素性质的关系
常见的元素推断题所涉及的元素大多属于短周期主族元素,若题干说明是前20号元素,则表示所涉及元素中有K或Ca元素。元素推断题很好地考查了元素“位—构—性”的统一性,表2就常见情况做了归纳,读者可自行推断相关元素。
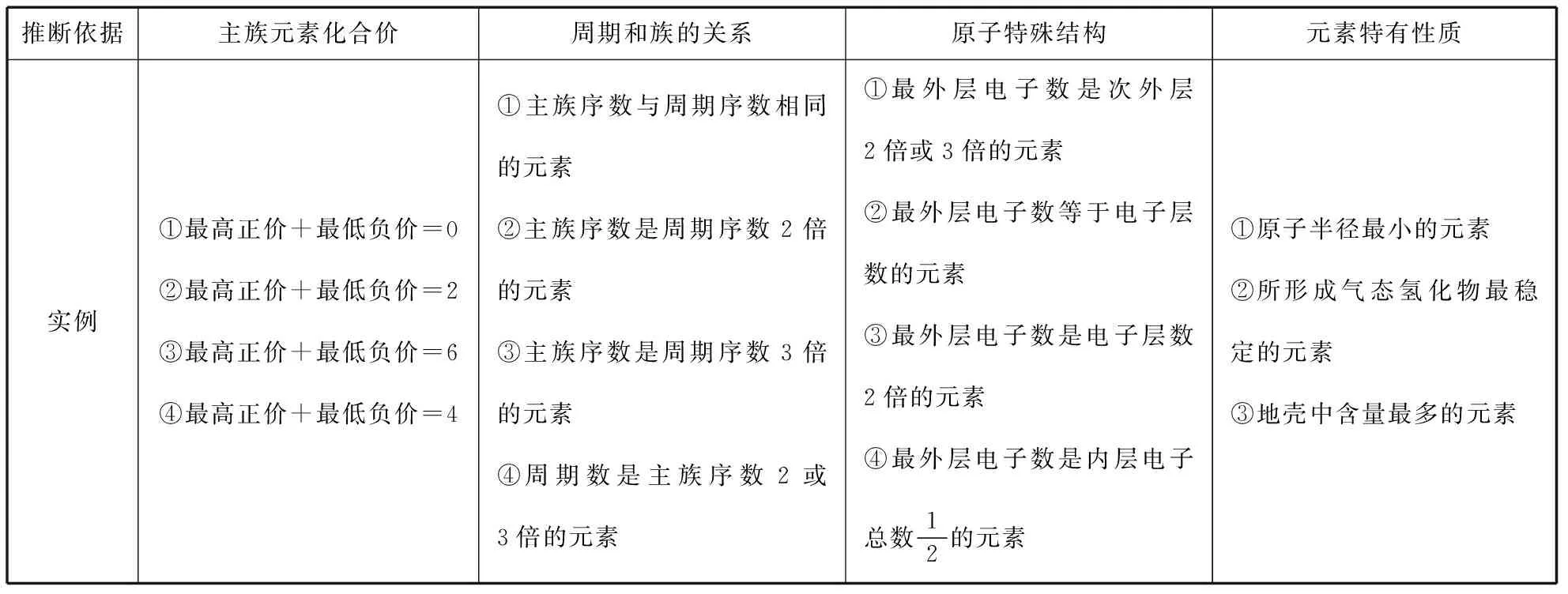
表2 常见“位—构—性”试题中的信息
【例1】(2020·全国卷Ⅱ·13)一种由短周期主族元素组成的化合物(如图2所示),具有良好的储氢性能,其中元素W、X、Y、Z的原子序数依次增大、且总和为24。下列有关叙述错误的是
( )
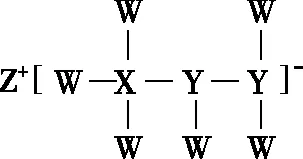
图2
A.该化合物中,W、X、Y之间均为共价键
B.Z的单质既能与水反应,也可与甲醇反应
C.Y的最高化合价氧化物的水化物为强酸
D.X的氟化物XF3中原子均为8电子稳定结构
【参考答案】D
【解析】根据题干信息以及化合物结构,Z的原子序数最大且可形成+1价阳离子,Z为Na;X可形成4个共价键,W可形成1个共价键,Y可形成3个共价键,由阴离子结构可知,X得到1个电子,X最外层电子数为3,位于ⅢA族,且W、X、Y、Z的原子序数依次增大、总和为24,可知W为H、X为B、Y为N,满足1+5+7+11=24。H、B、N均以共价键结合,A项正确;单质钠与水、甲醇均反应生成氢气,B项正确;Y的最高化合价氧化物的水化物为硝酸,属于强酸,C项正确;BF3中B的最外层电子数为3+3=6,故D项错误。
【例2】(2020·全国卷Ⅲ·13)W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。下列叙述正确的是
( )
A.非金属性:W>X>Y>Z
B.原子半径:Z>Y>X>W
C.元素X的含氧酸均为强酸
D.Y的氧化物水化物为强碱
【参考答案】D
【解析】由“化合物XW3与WZ相遇会产生白烟”可联想NH3与HCl的反应并结合原子序数可知,W、X、Y、Z分别是H、N、Na、Cl。非金属性:Cl>N>H>Na,A项错误;同周期元素从左向右原子半径依次减小,同主族元素自上而下原子半径依次增大,原子半径:Na>Cl>N>H,B项错误;元素X的含氧酸有硝酸和亚硝酸,亚硝酸是弱酸,C项错误;Y的氧化物水化物为氢氧化钠,氢氧化钠是强碱,D项正确。
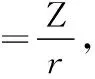
离子势也与离子的水解能力有关。一个典型的例子是高中学生所学习的Fe2+与Fe3+。常温下,Fe2+一般在pH约为6时水解生成Fe(OH)2沉淀,而Fe3+则在pH约为2时水解生成Fe(OH)3沉淀。由此可以看出,由于+3价铁离子与+2价亚铁离子相比,半径小,电荷数高,故离子势大,其与水分子作用时,可以将其更显著地极化,水解出氢氧化物沉淀。
二、分子结构与物质性质
分子除稀有气体分子之外,一般情况下由原子之间通过共价键形成,再聚集为宏观物质。分子的性质和分子结构、分子间作用力有关。分子间作用力是除化学键外,基团或分子间相互作用的总称。它是由荷兰物理学家范德华最早提出的,所以又被称为范德华力。分子间作用力比化学键要弱得多,约小一两个数量级,每摩尔分子间作用力一般作用能从几个到几十个千焦,故分子晶体的熔沸点低,一般为气态或液态。但分子间作用力的空间范围比化学键要大,约为0.3~0.5 nm,这种作用力一般没有方向性和饱和性,它是气体分子可以凝聚成液体或固体的原因。分子的一些物理性质如溶解性、熔沸点等都与分子间的作用力有关,而分子间的作用力与分子的极性、相对分子质量有关。一般来说,结构相似的分子,相对分子质量越大,分子间作用力也越大,分子的熔沸点也越高。相对分子质量相近的情况下,极性分子之间的作用力要强于非极性分子之间的作用力。值得注意的是,分子在分解的时候,需要破坏共价键,说明分子的稳定性与共价键的强弱有关。表3展示了分子的结构与性质之间的关系。
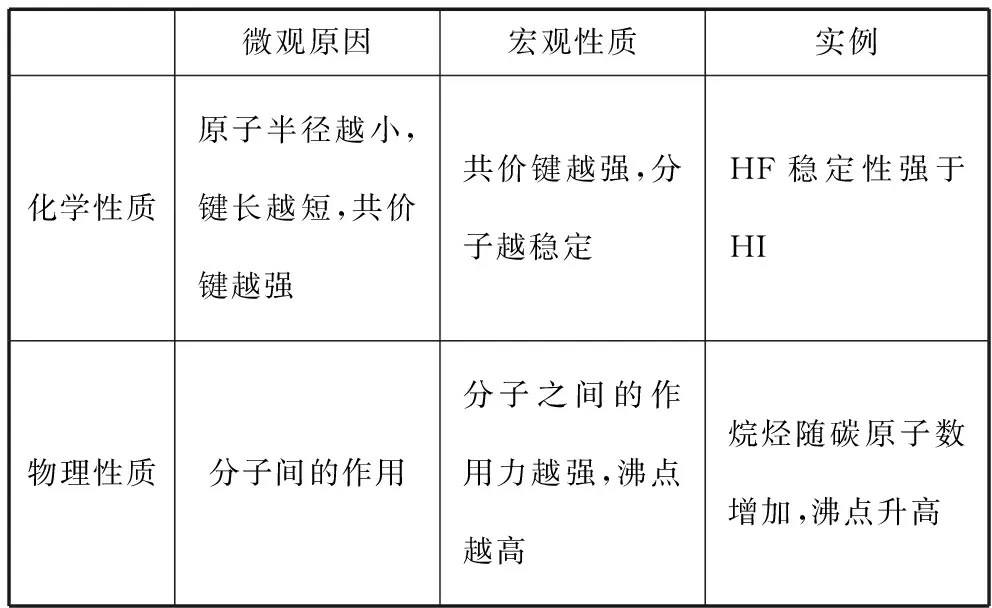
表3 分子的微观结构与宏观性质
【例3】(1)(2020·浙江7月选考·26节选)气态氢化物热稳定性HF大于HCl的主要原因是________。
(2)(2021·浙江6月选考·26节选)已知3种原子晶体的熔点数据如表4:

表4
金刚石熔点比晶体硅熔点高的原因是________。
【参考答案及解析】由于原子半径F
原子间以化学键结合成分子,较之原子结构,分子结构更接近宏观,因此,分子的结构对物质的物理、化学性质有着更为直接、显著的影响。溶质与溶剂在结构上越相似,溶质越容易溶于溶剂,是化学学科一条重要的规律。
【例4】下列溶剂中,最能溶解离子型溶质的是
( )
A.CCl4B.CH3OH C.C5H12D.(C2H5)2O
【参考答案】B
【解析】ACD选项的物质均为非极性或极性很小溶剂,不易溶解极性大的离子型溶质。
需要指出的是,在液态和固态HF、H2O和NH3的分子之间,存在着一种比分子间作用力稍强的相互作用力氢键。分子间形成的氢键会使物质的熔点和沸点升高,这是因为固体熔化或液体气化时必须破坏分子间的氢键,从而需要消耗较多能量的缘故。氢键可分为分子间氢键与分子内氢键两大类。一个分子的X—H键与另一个分子的Y原子相互作用而成的氢键,称为分子间氢键。例如水、甲酸、乙酸等缔合体就是通过分子间氢键而形成的。除了这种同类分子间的氢键外,不同分子间也可形成氢键,例如:
根据红外光谱的研究结果,分子间氢键一般是成直线型(其理由见前面氢键的方向性的论述)。因此水结成冰时,其晶体为四面体构型。即每一个水分子都位于四面体中心,在它周围有四个水分子分别以氢键和它相连。
【例5】物质的下列性质或数据与氢键无关的是
( )
A.甲酸蒸气的密度在373 K时为1.335 g·L-1,在297 K时为2.5 g·L-1
C.乙醚微溶于水,而乙醇可与水以任意比混溶
D.HF分解时吸收的热量比HCl分解时吸收的热量多
【参考答案】D
【解析】甲酸分子中含有羟基,在较低温度下,分子间以氢键结合成多分子缔合体[(HCOOH)n],而在较高温度下氢键被破坏,多分子缔合体解体,所以甲酸的密度在低温时较大;邻羟基苯甲酸易形成分子内氢键,而对羟基苯甲酸易形成分子间氢键,分子间氢键增大了分子间作用力,使对羟基苯甲酸的熔沸点比邻羟基苯甲酸的高;乙醇分子结构中含有羟基,可以与水分子形成分子间氢键,从而增大了乙醇在水中的溶解度,使其能与水以任意比互溶,而乙醚分子结构中无羟基,不能与水分子形成氢键,在水中的溶解度比乙醇小得多;HF分解时吸收的热量比HCl分解时吸收的热量多的原因是H—F键的键能比H—Cl键的大,与氢键无关。
原子结构是物质结构的基础,在化学中又主要体现为核外电子排布对物质宏观性质的影响。许多表面看似复杂的问题从原子结构的角度就能得到非常直观明了地解释。原子结构与元素性质密切相关,而原子结构与元素在周期表的位置也直接相关。在周期表中,元素原子的结构、元素位置、元素的金属性或非金属性三者可以互相推断,但原子结构才是决定元素性质和位置的根本与关键。


