通督启神针法对APP/PS1小鼠学习记忆行为及海马Aβ沉积、炎症因子的影响
郑愉心,赵嘉培,刘欢欢,郑 玲,黄赛娥
(1.福建中医药大学,福建 福州 350122;2.福建省康复产业研究院,福建 福州 350122;3.厦门市第五医院,福建 厦门 361101;4.福建中医药大学附属康复医院,福建 福州 350003)
阿尔兹海默症(Alzheimer’s disease,AD)是一种与年龄相关的神经退行性疾病,具有进行性记忆缺陷和认知障碍,并伴有不同程度的人格和行为改变[1]。据报道,全球约有4 000万人患有痴呆症[2]。AD是痴呆中最常见的病症,是全球最受关注的医疗保健问题之一。因此,迫切需要确定具有明确功能机制的有效和安全的治疗方法。
导致AD病理的潜在机制尚未明确,具有多种假设。主要病理特征为大脑内淀粉样蛋白(Amyloid β-protein,Aβ)沉积而形成的老年斑(Senileplaques,SP)、微管相关蛋白(Tau protein,Tau)聚集形成的寡聚物、神经炎症[3]。而炎症与大脑中Aβ蛋白之间存在密切联系,Aβ持续激活胶质细胞释放促炎因子,如TNF-α,从而导致循环性的通过产生慢性自我维持的炎症反应来激活胶质细胞和神经毒性损伤[4- 5]。此过程可能加速AD的病情发展。
核因子激活的B细胞的κ-轻链增强(NF-κB)是一种参与调节免疫和炎症反应的二聚体。由NF-κB1(p50/p105)、NF-κB2(p52/p100)、RelA(p65)、RelB和c-Rel组成了NF-κB家族成员[6]。它们可变成同源或异源二聚体,常常在细胞质中而保持无活性。活化后的NF-κB会易位到细胞核中,导致许多炎症基因表达[7- 8]。NF-κB信号通路已被证明与AD相关[9]。在AD患者大脑中淀粉样斑块周围的神经元中观察到增强的免疫反应性[10]。在AD患者的海马和内嗅皮层观察到NF-κB表达的增加[11]。在体外研究,神经元和胶质细胞中的Aβ均激活NF-κB[12]。TNF-α是AD脑中主要的炎症因子,其在中枢神经系统中功能表达是通过NF-κB信号传导控制的[13]。这表明NF-κB的激活在介导到的炎症中起着重要作用。
电针作为中国传统替代医学技术。目前在动物实验以及临床治疗中,已被认为是治疗AD中安全有效的方法之一[14]。其在预防和改善神经性疾病(痴呆、脑缺血等)具有重要作用[15]。临床和实验证据表明,电针治疗后,AD的认知功能改善优于药物[16]。现有研究结果揭示[17],对神经退行性疾病的作用与其抗炎活性相关。Feng等[18]证明,电针干预后,与认知能力下降相关的炎症因子表达水平降低,如TNF-α、IL-6。然而,电针改善AD认知和神经炎症的直接影响尚未明确。因此,探讨通督启神针法是否通过调控NF-κB通路介导的促炎细胞因子,进而改善APP/PS1双转基因小鼠学习记忆功能以及降低Aβ沉积。
1 材料和方法
1.1 仪器与试剂
1.1.1 仪器 莫里斯水迷宫(上海欣软信息科技公司);华佗牌针灸针(0.25 mm×13 mm,苏州医疗用品厂有限公司);SDZ-Ⅲ型电针仪;动物超声(Vevo2100,Canada);电泳仪及转移系统(Bio-Rad 04BR301394,Singapore);Image J pro 6.09(Bio-Rad 721BR18682,U.S.A)。
1.1.2 试剂 山羊抗兔(SA00001-2;1∶5 000;Proteintech公司);抗鼠二抗(SA00001-1;1∶5 000;Proteintech公司);β-actin(6609-I-lg;1∶8 000;Proteintech公司);Beta Amyeloid(25524-1-AP;1;2 000;Proteintech公司);TNF-α(17590-1-AP;1∶1 000;Proteintech公司);NF-κB(80477;1∶1 000;Cell Signaling Technology公司);抗体稀释液(北京碧云天有限公司);超敏化学发光检测试剂盒(EVERBRIGHT公司)。
1.2 实验动物和分组
实验经福建中医药大学动物管理制度和使用委员会批准而进行,由杭州子源实验动物科技有限公司[SCXK(浙)2019-0004]所提供2月龄APP/PS1基因小鼠以及WT小鼠,在福建中医药大学实验动物中心SPF级实验室[SYXK(闽)2019-0007]将小鼠进行繁殖培育,饲养条件:温度22 ℃,湿度50 %~70 %,模拟标准昼夜系统(12 h光照+12 h黑夜),给予自由饮食和饮水。使用鼠尾提取DNA进行PCR基因分型。具体引物如下:APP(正向:AGGACTGACCACTCGACCAG;反向:CGGGGGTCTAGTTCTGCAT);PS1(正向:AATAGAGAACGGCAGGAGCA;反向:GCCATGAGGGCACTAATCA T)。PCR循环条件,95 ℃变性 5 min,98 ℃ 30 s、65 ℃ 30 s和72 ℃ 45 s此过程循环20次,98 ℃ 30 s、5 ℃ 30 s和72 ℃ 45 s此过程循环15次,72 ℃ 5 min,10 ℃保持。PCR产物在1.5 %琼脂糖凝胶上分离,然后使用GelRed,最后得到APP/PS1基因小鼠16只。
雌雄双转基因鼠按照随机数字表法进行分组:将16只APP/PS1基因小鼠分成模型组、电针组,每组均为8只;WT小鼠为对照组8只。
1.3 莫里斯水迷宫(MWM)测试
Morris水迷宫试验是一项评估啮齿动物学习记忆功能的可靠测试。在1个开放的、内壁为白色的圆形水池,池内注水高度30 cm,保持水温(20±2)℃,将水池平均分为4个象限,第3象限为目标象限,平台位于目标象限的中间,每个象限各有1个形状和颜色不同的标识物,用于小鼠观察学习[19]。小鼠将于干预前进行Morris水迷宫检测。测试分为两个阶段,先持续4 d的定向航行实验,记录小鼠90 s内寻找平台总时间,未能找到,将小鼠引导放置于平台上学习15 s,第5天为空间探索实验,撤出平台,记录小鼠90 s内穿越平台次数。
1.4 治疗方法
对6月龄的APP/PS1双转基因小鼠(固定在小鼠袋中)分别在百会、印堂和水沟穴位进行电针干预,小鼠穴位解剖位置(参照“实验动物针灸穴位图谱”,百会穴向下,印堂穴向上平刺进针,两穴位针刺深度5 mm[20],每次干预30 min后人中穴快速点刺,针具为一次性针灸针,设定电压峰值为2 V,以针体轻轻抖动为度,疏密波,频率1/20 Hz。电针干预4周,每次30 min,1次/d。
1.5 新物体识别测试(NOR)
新物体识别测试是一种研究小鼠学习记忆行为的检测方法[21],包括适应期、训练期和测试期。适应期每只小鼠置于箱内10 min;训练期将A1、A2相同的物体放入箱内,小鼠在里面活动10 min;测试期,将A2换成B1(A、B两物体相似)分别测试1 h、24 h老鼠对新旧物体的探索时间。
1.6 Western Blot检测
采用组织裂解液裂解海马组织,获取海马蛋白提取物,按BCA试剂盒说明书,检测样本蛋白浓度。将蛋白样品于10%、12% SDS-PAGE凝胶中进行分离。转移到PVDF膜上。转移的膜与一抗在4 ℃下孵育过夜。次日,将这些膜与二抗一起孵育。
1.7 统计学处理
测试所收集的数据经SPSS25.0统计软件分析,实验数据以均数±标准差表示。对各组数据进行正态性检验,方差齐,采用单因素方差分析,两两比较采用LSD检验,以P<0.05为差异有统计学意义。
2 结果
2.1 PCR基因鉴定结果
APP/PS1双转基因小鼠:A2-A5,B1-B5,C1-C3,D1-D4,共计16只。见图1。
2.2 干预前模型组与电针组均表现出学习记忆功能障碍
在Morris定向航行实验中,随着实验的天数增加,各组小鼠进入目标象限中平台的逃避潜伏期均呈降低趋势,且模型组与干预前电针组差异无统计学意义。与对照组比较,在训练的第3、4天,模型组逃避潜伏期明显处于较高水平(P<0.01或P<0.05),电针组逃避潜伏期明显较高(均P<0.01)。各组小鼠的游泳速度差异无统计学意义。见表1~2。

表1 3组小鼠入水逃避潜伏期比较

表2 3组小鼠游泳速度的比较
在空间探索实验中,与对照组比较,模型组穿越第3象限次数减少(P<0.01),电针组穿越第3象限次数减少(P<0.01)。而模型组与电针组之间差异无统计学意义。提示,APP/PS1小鼠已出现明显的学习记忆障碍。见表3。

表3 3组小鼠穿越平台次数
2.3 通督启神针法对APP/PS1小鼠学习记忆的影响
对APP/PS1小鼠进行百会、印堂和水沟电针干预。新物体识别测试用于评估通督启神针法是否改善APP/PS1双转基因小鼠的学习记忆功能。1 h和24 h学习记忆测试结果显示,与对照组比较,模型组对新物体的探索时间明显减少(P<0.01),表明仍有学习记忆能力障碍;与模型组比较,电针组干预后对新物体的偏好指数提高(P<0.05),表明通督启神针法具有提高APP/PS1小鼠的学习记忆功能的作用。见表4。

表4 3组小鼠1 h、24 h对新物体的偏好指数比较
2.4 通督启神针法降低APP/PS1双转基因小鼠海马Aβ表达
通过蛋白质印迹方法检测Aβ表达水平。与对照组相比较,模型组脑内海马Aβ表达水平显著增加(P<0.01);与模型组比较,电针组干预后,脑内海马Aβ表达水平降低(P<0.01);与对照组比较,电针组干预后,脑内海马Aβ表达水平较高(P<0.05)。见表5、图2。

表5 3组小鼠海马区Aβ/β-actin蛋白表达水平比较
2.5 通督启神针法减轻APP/PS1双转基因小鼠的炎症因子
神经炎症是导致APP/PS1双转基因小鼠认知障碍的关键因素[22]。检测NF-κB和TNF-α炎症因子蛋白的表达水平。与对照组比较,模型组海马TNF-α和NF-κB蛋白表达水平均增多(P<0.01);与模型组比较,电针组海马中TNF-α和NF-κB分别显著减少(P<0.01或P<0.05);与对照组比较,电针组海马中TNF-α蛋白表达水平较高(P<0.05);而NF-κB蛋白表达水平差异无统计学意义。见表6~7和图3~4。
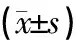
表6 3组小鼠海马区TNF-α/β-actin蛋白表达水平比较

表7 3组小鼠海马区NF-κB/β-actin蛋白表达水平比较
3 讨论
通督启神针法是中医学常用的针刺手法,通过刺激特定穴位,起到调节阴阳、醒脑开窍的作用。《灵枢》云:“凡刺之法,必先本于神。”中医理论认为,AD的发病与脏腑功能息息相关,脑髓不足、痰瘀阻络可加重脑功能异常。督脉腧穴是治疗脑相关疾病的首选穴位,针刺督脉穴,治疗与“脑”部及精神类相关的疾病有所疗效[23]。百会隶属督脉,位于头顶正中,有安神健脑之效。印堂为督脉经奇穴,位于两眉苑之中,有安神定志的作用。人中又名水沟,为督脉要穴,位于鼻之下、唇之上,鼻唇沟正中,具有醒神开窍之效。李志刚教授提出“通督启神”疗法,选取百会、印堂和人中3穴[24]。因此3穴合用,起通督启神之作用。前期有学者研究证实电针3穴可以改善APP/PS1小鼠的认知缺陷[25]。
据统计,中国人口的痴呆发病率迅速上升,给家庭和社会带来沉重的负担[26]。尽管目前已经批准了5种治疗AD的药物,但只能延缓AD的病情发展,且临床研究证实这些药物具有许多不良反应[27]。针刺作为一种中国传统替代医学疗法之一,疗效显著、安全性高,被广泛用于AD的治疗[28]。然而,通督启神针法是如何提高AD的学习记忆功能机制,并未阐明清楚。因此,研究表明通督启神针法可能改善APP/PS1双转基因小鼠学习记忆功能与炎症相关性的分子机制。
在Morris水迷宫测试中,4月龄早期小鼠已出现学习记忆功能障碍,在新物体识别测试中,电针组干预后显著改善了APP/PS1双转基因小鼠的学习记忆功能。干预结果中显示,通督启神针法治疗具有安全有效性。但是对于中、晚期的APP/PS1双转基因小鼠学习记忆功能的改善,电针治疗是否有如此疗效,还需要进一步研究;本实验在干预后进行行为学以及取材做病理学研究,难以估算电针治疗APP/PS1疗效的持续性,还需要进一步研究。
Aβ沉积是AD的重要病理特征,在AD患者和相应的动物模型中,海马和大脑都检测到Aβ沉积,学习记忆功能障碍[29]。神经炎症是导致AD发病机制的关键因素。Aβ斑块和tau缠结刺激了炎症反应,诱导神经胶质细胞因子的表达。在临床研究与动物研究中被证实,许多炎症介质如IL-1β、TNF-α被认为在AD的炎症中起着至关重要的作用,这些炎症因子在血浆、大脑和脑脊液中检测表达均升高[30]。此外,NF-κB直接参与了APP蛋白水解。β-分泌酶-1(BACE1)的活性。启动子在Aβ过量存在的情况下受NF-κB依赖性通路控制[31],而抑制NF-κB信号通路可以增强α-分泌酶活性,降低Aβ沉积,改善认知功能,此过程是APP的非淀粉样蛋白原加工[32]。TNF-α炎症因子又作为NF-κB的下游靶标,这为治疗AD提供了新的治疗方向。因此,抑制NF-κB信号通路不仅可以有效抑制AD中的个体促炎介质,如IL-1β和TNF-α,还可以减少Aβ的产生,提高学习记忆功能。有研究表明[33],电针能抑制与认知能力下降相关的促炎细胞因子表达水平IL-1β、TNF-α等。此研究中结果显示,电针干预后,NF-κB、炎症因子TNF-α蛋白表达水平降低,Aβ表达水平降低,但是电针组干预后NF-κB与对照组差异无统计学意义,而TNF-α蛋白表达、Aβ表达水平与对照组存在差异,表明通督启神针法确有疗效,能抑制由NF-κB信号通路介导的炎症因子,减少Aβ表达,但是或许还有其他机制与炎症因子相关联进而调控Aβ表达水平,还需要进一步研究探索。
综上,本研究证实了通督启神针法可有效减少海马区Aβ沉积,抑制NF-κB通路的激活,降低TNF-α炎症因子的表达,提高APP/PS1双转基因小鼠学习记忆能力。这可能与其抑制NF-κB通路、降低炎症因子TNF-α表达有关。该研究为通督启神针法治疗AD提供理论基础。

