淫羊藿苷改善糖尿病小鼠血管功能的作用及其机制
王喜鸟,姚文慧,潘珍珍,董洁炎,刘 硕,丁选胜
(中国药科大学基础医学与临床药学学院,南京 211198)
糖尿病是以胰岛素分泌不足和糖脂代谢紊乱为特征的异质性慢性代谢疾病,常伴随多种血管并发症,具有高患病率、高致残率、高致死率的特点。2020 年中国成人糖尿病流行病学最新数据显示[1],中国大陆糖尿病患病率逐年增加,患者总数约为1.298 亿。糖尿病血管并发症是糖尿病患者发病率、住院率和病死率增加的主要原因[2]。
淫羊藿苷(icariin,ICA)是从传统中药淫羊藿中提取的淫羊藿总黄酮的主要有效成分之一,相对分子质量为676.662,难溶于水。ICA 具有多种生物活性,如抗肿瘤[3]、抗骨质疏松[4]、抗抑郁症[5]、改善阿尔茨海默病认知功能[6]等。此外,研究显示ICA 对糖尿病[7]及糖尿病并发症[8]、血管内皮功能紊乱[9-10]均有一定疗效,但ICA 在糖尿病早期血管功能障碍中的作用尚未有研究,其改善血管内皮功能的分子机制尚未清楚阐明。因此,本实验主要考察ICA 对四氧嘧啶诱导糖尿病小鼠的血管内皮舒缩功能的保护作用及可能的分子机制,为揭示糖尿病血管并发症的病理机制及创新药物研发提供科学依据。
1 材 料
1.1 药品及试剂
淫羊藿苷(icariin,ICA,纯度大于98%,扬子江药业集团有限公司,批号:18102102),ICA 药液配制方法:称取ICA 粉末480 mg 于研钵中研磨,使其溶于0.5% CMC-Na 40 mL 溶液中,即为ICA 高剂量混悬液,取此混悬液20 mL 加入0.5% CMC-Na溶液20 mL 稀释混匀即为ICA 低剂量混悬液。四氧嘧啶(alloxan)、硝普钠(sodium nitroprusside,SNP)、氯化乙酰胆碱(acetylcholine,Ach)(Macklin公司);盐酸去氧肾上腺素(phenylephrine,Phe,Aladdin 公司);氯化钾(上海凌峰化学试剂有限公司);p38 MAPK、GAPDH 抗体(Protein Tech 公司);p-p38 MAPK抗体(美国Cell Signaling Technology 公司);eNOS 抗体(沈阳万类生物有限公司);p-eNOS抗体(百远生物科技有限公司)。其他试剂均为市售分析纯。
1.2 仪 器
SYC超级恒温水槽(南京科尔仪器设备公司);Medlab-U/4C501H 生物信号采集处理系统(南京美易科技有限公司);EPS300 电泳仪(上海天能科技有限公司)。
1.3 动物和细胞株
SPF 级昆明种小鼠,雄性,体重(20 ± 2)g,由北京斯贝福生物技术有限公司提供,许可证号:SCXK(京)2019-0010。所有动物实验均符合动物伦理委员会标准。
1.4 细胞株
人脐静脉内皮细胞(HUVECs)购自美国模式培养物集存库(ATCC),培养在含10%胎牛血清的RPMI 1640培养基中。
2 方 法
2.1 四氧嘧啶诱导糖尿病小鼠模型的建立
雄性昆明种小鼠24 只,体重18~22 g,适应性饲养1 周后随机挑选6 只小鼠作为正常对照组(control),其余小鼠用于造模。造模方法:将所有待造模小鼠禁食不禁水12 h 后,按200 mg/kg 的剂量腹腔注射2%四氧嘧啶溶液(将四氧嘧啶溶于无菌生理盐水,现用现配),对照组小鼠注射等同体积的生理盐水。造模72 h 后,将所有小鼠禁食不禁水8 h,取小鼠尾静脉血用血糖仪测定小鼠空腹血糖,随即挑选血糖大于等于11.1 mmol/L 的小鼠纳入糖尿病模型[11]。
2.2 动物分组及给药
将造模成功的糖尿病小鼠随机分为3组:模型组(model)、ICA 低剂量组(ICA-L,60 mg/kg)和ICA高剂量组(ICA-H,120 mg/kg)。每日灌胃给药1 次,ICA 的给药容积为0.1 mL/10 g 体重,连续给药2周。
2.3 小鼠血糖、体重、摄食量及饮水量记录
分别于给药前、给药2周后用血糖仪测定各组小鼠的空腹血糖(fasting blood glucose,FBG)。每日记录各组小鼠体重,计算各组小鼠的摄食量和饮水量,观察各组小鼠的体重、摄食量和饮水量变化情况。
2.4 小鼠离体胸主动脉血管舒缩功能的测定
2.4.1 胸主动脉血管环的制备 各组小鼠脱颈椎处死后,分离胸主动脉并立即置于预冷(4 ℃)的K-H液中,去除外周结缔组织并分离周围脂肪后将血管剪成3~4 mm 长的动脉环,小心地将其穿于2根不锈钢钩上,再悬挂于盛有K-H 液的浴皿内,下端钢丝用另一不锈钢钩固定,上端连接张力换能器,浴皿中持续通入O2,气泡以每秒3~5 个为宜,连接恒温水槽以保持(37±0.5)℃的恒温状态,将张力换能器连接至多道生理记录仪,调节胸主动脉血管环静息张力为500 mg 后,每隔15 分钟更换一次K-H 液进行平衡,平衡1 h 后向浴皿中加入Phe(1 × 10-6mol/L)预收缩两次,待洗脱至基线后开始后续试验。
2.4.2 ICA 对Ach 诱导的糖尿病小鼠胸主动脉血管环舒张效应的影响 各组小鼠动脉环平衡后,向浴皿中加入Phe(1×10-6mol/L)使动脉环收缩至基线,再分别累计加入不同浓度的Ach,使浴皿中Ach 的终浓度分别为1×10-9、1×10-8.5、1×10-8、1×10-7.5、1 × 10-7、1 × 10-6.5、1 × 10-6、1 × 10-5.5、1 × 10-5mol/L,记录血管舒张幅度。
2.4.3 ICA 对SNP 诱导的糖尿病小鼠胸主动脉血管环舒张效应的影响 各组小鼠动脉环平衡后,向浴皿中加入Phe(1×10-6mol/L)使动脉环收缩至基线,再分别累计加入不同浓度的SNP,使浴皿中SNP 的终浓度分别为1 × 10-10、1 × 10-9.5、1 × 10-9、1 × 10-8.5、1 × 10-8、1 × 10-7.5、1 × 10-7、1 × 10-6.5、1 ×10-6mol/L,记录血管舒张幅度。
2.4.4 ICA 对Phe 诱导的糖尿病小鼠胸主动脉血管环收缩效应的影响 各组小鼠动脉环平衡后,分别累计加入不同浓度的Phe,使浴皿中Phe 的终浓度分别为1 × 10-9、1 × 10-8.5、1 × 10-8、1 × 10-7.5、1×10-7、1×10-6.5、1×10-6、1×10-5.5、1×10-5mol/L,记录血管收缩幅度。
2.4.5 ICA 对KCl 诱导的糖尿病小鼠胸主动脉血管环收缩效应的影响 各组小鼠动脉环平衡后,分别累计加入不同浓度的KCl,使浴皿中KCl 的终浓度分别为10,20,40,60,80,100 mmol/L,分别记录血管收缩幅度。
2.5 Western blot法检测蛋白表达水平
选取对数生长期的HUVECs 细胞,接种于6 孔板中,贴壁后换为无血清的RPMI 1640 培养基饥饿24 h。细胞分为4 组:正常组(Control)、高糖组(35 mmol/L 高糖,HG)、ICA-L(35 mmol/L HG +10 μmol/L ICA)、ICA-H(35 mmol/L HG+30 μmol/L ICA),分别用高糖和ICA 处理48 h 后收集细胞,经RIPA 裂解液裂解细胞15 min,12 000 r/min 离心10 min,吸取上清液,使用BCA 试剂盒进行蛋白定量,根据蛋白定量结果将4 组细胞裂解液浓度调至一致,分别加入5 × SDS PAGE 上样缓冲液,涡旋混匀,金属浴95 ℃煮10 min。蛋白样本进行SDS-PAGE 凝胶电泳,通过湿转法将蛋白转移至PVDF 膜后置于10%脱脂牛奶中室温封闭2 h;TBST 洗去牛奶后,先后孵育抗eNOS(1∶1 000)、peNOS(1∶1 000)、p38 MAPK(1∶1 000)、p-p38 MAPK(1∶1 000)和GAPDH(1∶1 000)抗体和辣根过氧化物酶标记的二抗(1∶10 000)。用高敏ECL发光液孵育条带并显影,采集的图片采用Image J软件进行灰度分析。蛋白表达量采用灰度校正值显示(各条带灰度/GAPDH灰度)。
2.6 统计学方法
所有试验结果使用GraphPad Prism 8.0 统计软件进行统计学分析,两组数据间比较采用独立样本t检验进行分析。P<0.05认为差异具有统计学意义。结果以均值±标准差(±s)表示,n表示样本数。柱状图和折线图采用GraphPad Prism 8.0软件绘制。
3 结 果
3.1 ICA 对四氧嘧啶致糖尿病小鼠血糖、体重、摄食量、饮水量的影响
与正常组小鼠相比,模型组小鼠的体重自给药第2 天开始逐渐降低,给药2 周后较正常组极显著性降低(P<0.001),ICA高低剂量组均明显抑制小鼠体重减轻(P<0.001),结果见图1。
给药2 周后,与正常组相比,模型组小鼠的空腹血糖、摄食量和饮水量均有明显增加。ICA-L 和ICA-H组可以显著改善糖尿病小鼠的饮水量增多,对空腹血糖和摄食量有一定改善作用,但无统计学差异,结果见表1。
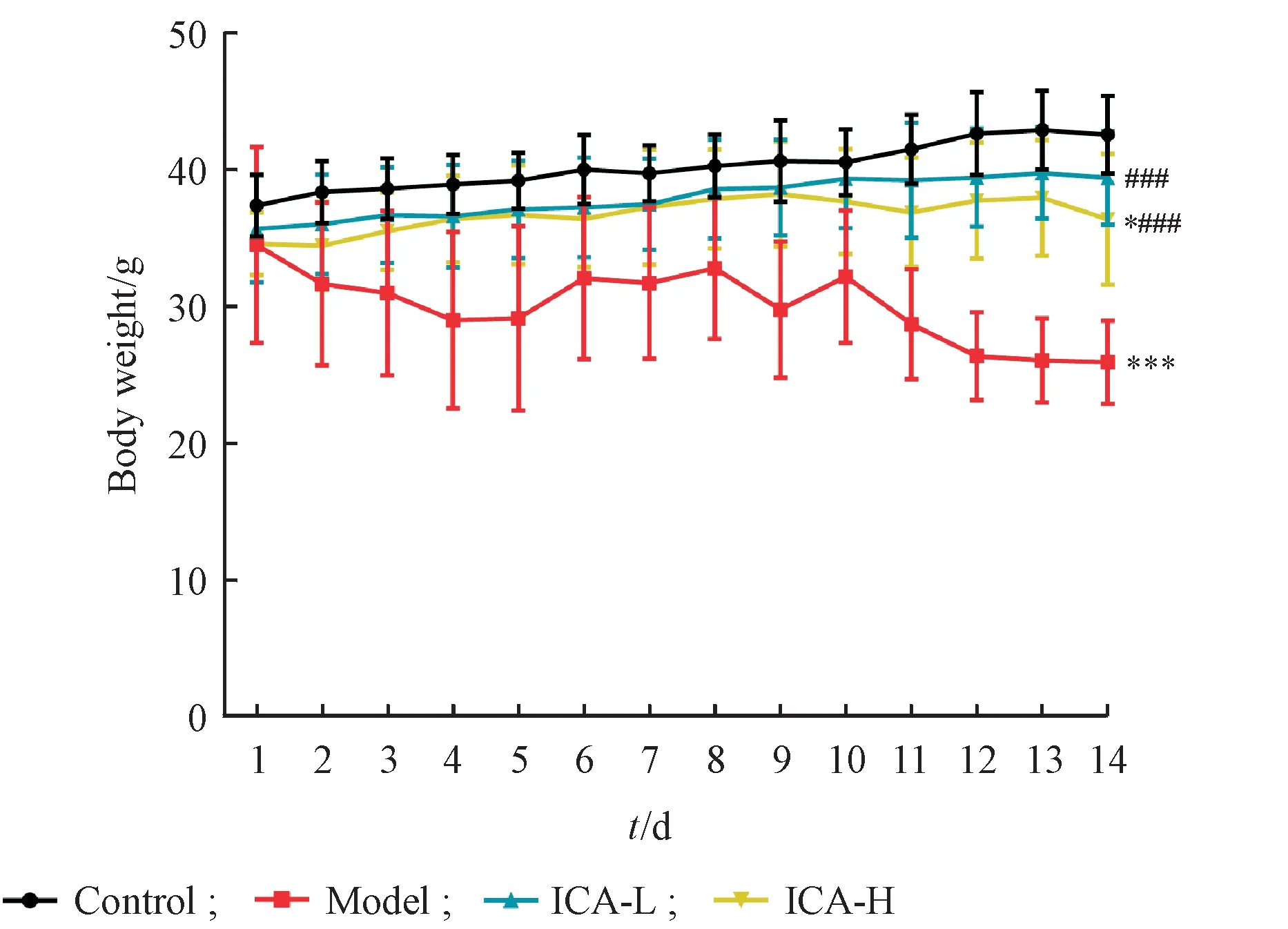
Figure 1 Effect of icariin on body weight in alloxan-induced diabetic mice(± s,n = 6)
Table 1 Effects of icariin(ICA)on fasting blood glucose(FBG),food intake and water intake in alloxan-induced diabetic mice(± s,n = 6)

Table 1 Effects of icariin(ICA)on fasting blood glucose(FBG),food intake and water intake in alloxan-induced diabetic mice(± s,n = 6)
*P <0.05, **P <0.01,***P <0.001 vs control group; #P <0.05, ###P <0.001 vs model group; $$P <0.01 vs ICA-L group
Group Control Model ICA-L ICA-H Dose/(mg/kg)--60 120 FBG/(mmol/L)6.67±1.76 24.95±1.46***23.38±7.76**19.52±8.54*Food intake/(g/10 g)1.76±0.28 2.40±0.64**2.12±0.23**2.24±0.27***Water intake/(mL/10 g)3.05±1.04 9.16±2.34***6.46±0.99***###7.69±1.03***#$$
3.2 ICA 对四氧嘧啶致糖尿病小鼠离体胸主动脉血管环舒缩功能的影响
3.2.1 ICA 对Ach 诱导的糖尿病小鼠胸主动脉血管环舒张效应的影响 与正常组相比,糖尿病小鼠胸主动脉对Ach 诱导的内皮依赖性舒张显著降低(P<0.001);与模型组相比,ICA(60 mg/kg)给药后可以一定程度上提高Ach 诱导的糖尿病小鼠胸主动脉舒张率,但无统计学差异;ICA(120 mg/kg)给药后显著改善Ach 诱导的糖尿病小鼠胸主动脉舒张反应(P<0.01),结果见图2。
3.2.2 ICA 对SNP 诱导的糖尿病小鼠胸主动脉血管环舒张效应的影响 ICA 对SNP 诱导的小鼠胸主动脉舒张试验结果显示,各组之间不同诱导剂量的舒张率无显著性差异,说明四氧嘧啶诱导的糖尿病小鼠血管非内皮依赖性舒张反应受损不明显(P>0.05),结果见图3。
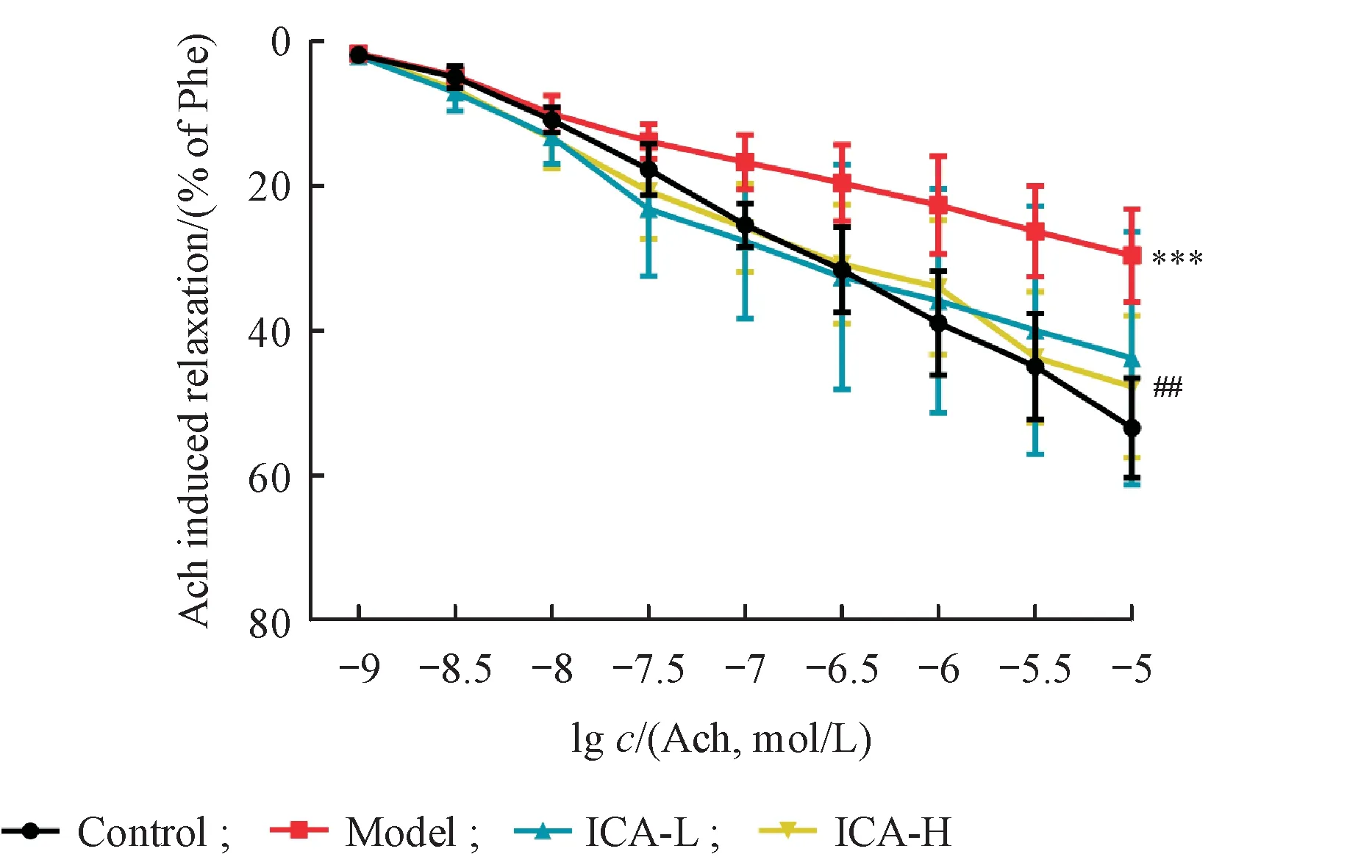
Figure 2 Effect of icariin on Ach induced vasodilation of aortas in alloxan-induced diabetic mice(± s,n = 6)
3.2.3 ICA 对Phe 诱导的糖尿病小鼠胸主动脉血管环收缩效应的影响 与正常组相比,模型组、ICA-L和ICA-H组小鼠随诱导剂量的增加收缩率逐渐上升,差异具有极显著性(P<0.001)。与模型组相比,ICA(60 mg/kg)给药后可以一定程度上降低Phe 诱导的糖尿病小鼠胸主动脉收缩率,但无统计学差异(P>0.05);ICA(120 mg/kg)给药后显著降低Phe 诱导的糖尿病小鼠胸主动脉收缩(P<0.05);说明ICA(120 mg/kg)可以改善糖尿病状态下Phe 诱导的小鼠胸主动脉收缩,结果见图4。
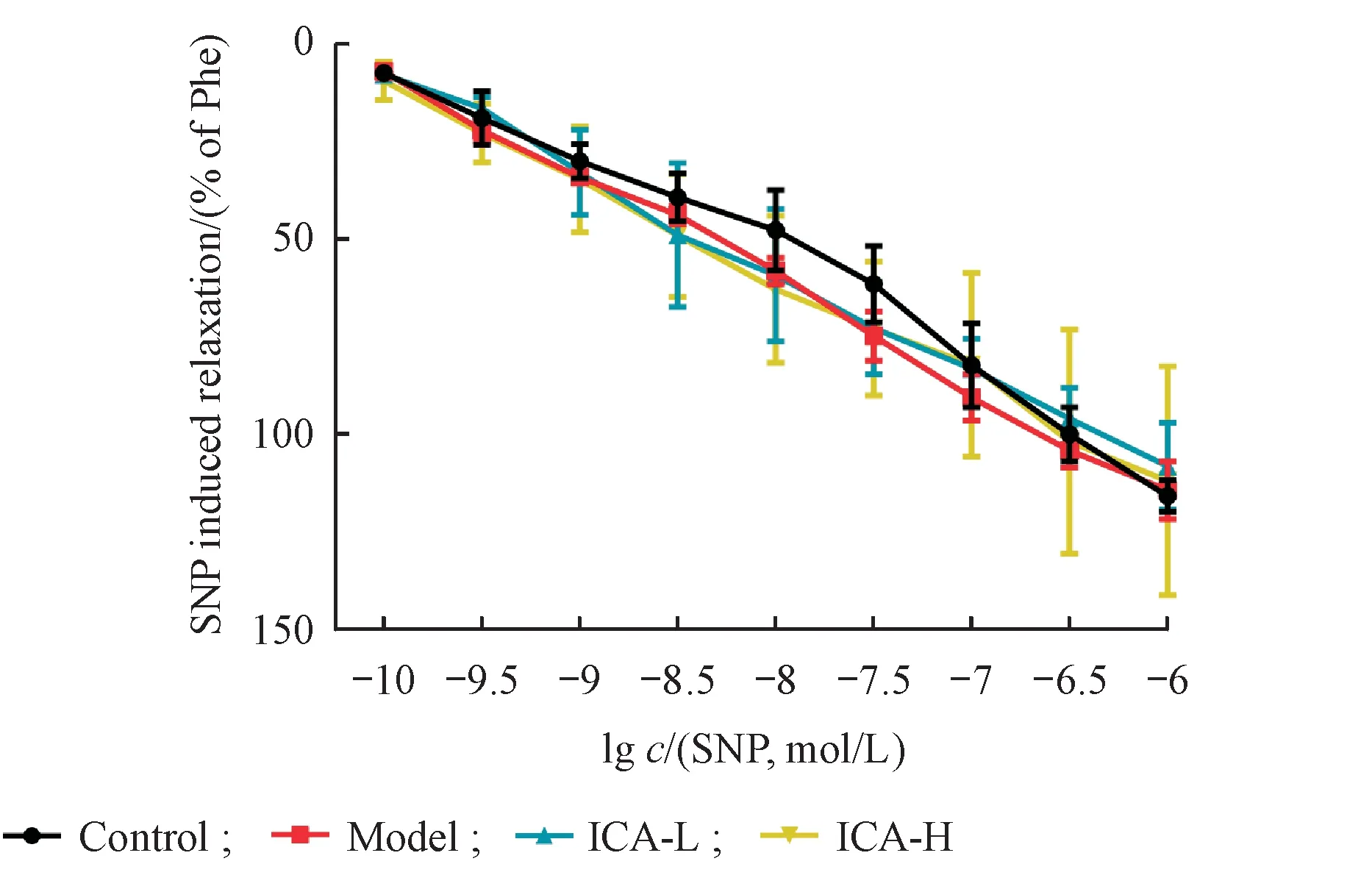
Figure 3 Effect of icariin on sodium nitroprusside (SNP) induced vasodilation of aortas in alloxan-induced diabetic mice(± s,n = 6)
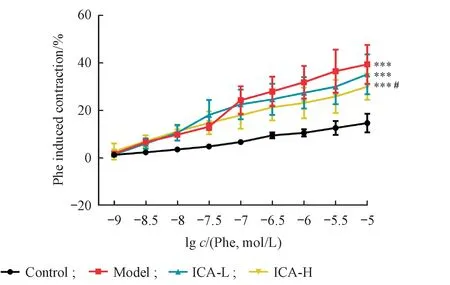
Figure 4 Effect of icariin on phenylephrine (Phe) induced vascular contraction response of aortas in alloxan-induced diabetic mice(xˉ±s,n = 6)
3.2.4 ICA 对KCl 诱导的糖尿病小鼠胸主动脉血管环收缩效应的影响 ICA 对KCl 诱导的雄性小鼠胸主动脉收缩效应的影响试验结果显示,与正常组相比,模型组小鼠胸主动脉随KCl诱导剂量的增加收缩率逐渐升高,呈极显著性差异(P<0.001)。ICA-L和ICA-H组小鼠胸主动脉对KCl诱导的收缩功能有一定改善作用,但无统计学差异(P>0.05),结果见图5。
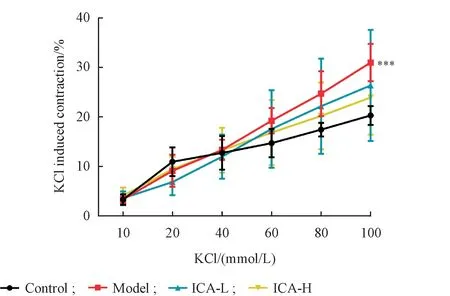
Figure 5 Effect of icariin on KCl induced vascular contraction response of aortas in alloxan-induced diabetic mice(± s,n = 6)
3.3 ICA 对高糖诱导的HUVECs 细胞中p38 MAPK/eNOS信号通路蛋白表达的影响
Western blot结果显示,各组之间p38 MAPK和eNOS 的总蛋白含量无明显差异。与正常组比较,高糖组p-p38 MAPK 蛋白表达显著升高(P<0.05),p-eNOS 蛋白表达显著降低(P<0.05);与高糖组相比,ICA(10 μmol/L)给药组的p38 MAPK磷酸化水平有所降低,但无统计学差异(P>0.05),eNOS 磷酸化水平上调(P<0.05);ICA(30 μmol/L)给药组可以显著抑制高糖诱导的p38 MAPK 磷酸化(P<0.01),并且显著提高eNOS 的磷酸化水平(P<0.001),结果见图6。
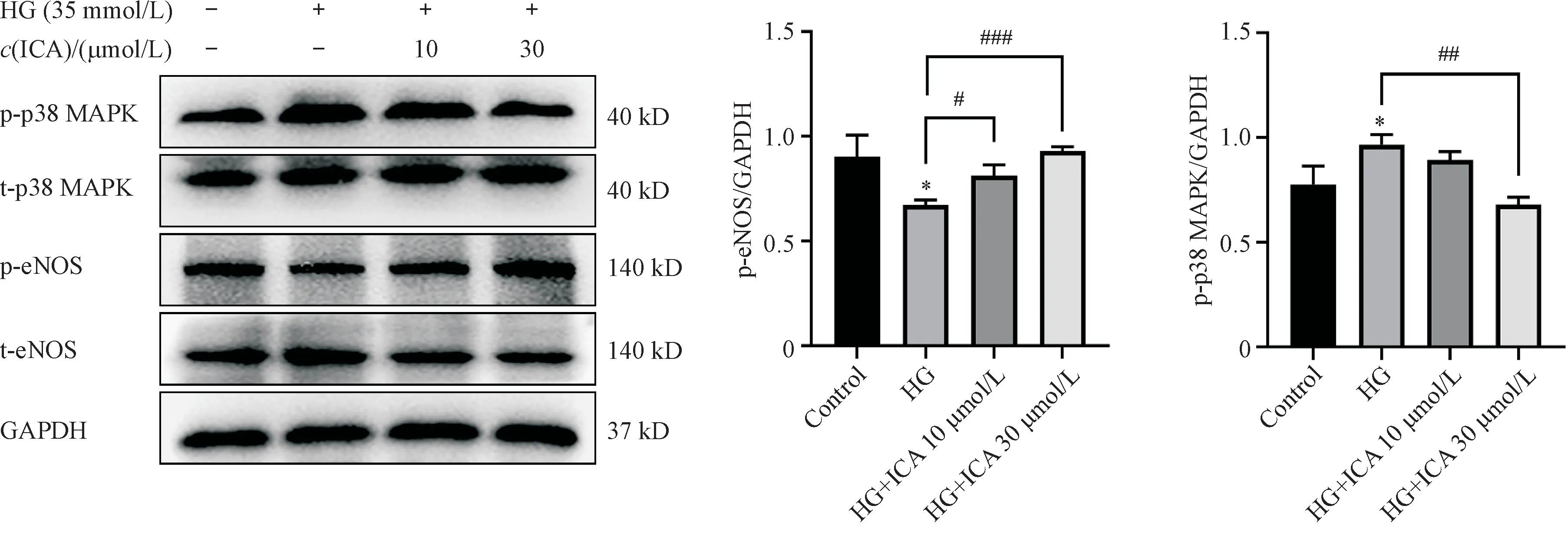
Figure 6 Effect of icariin on p38 MAPK/eNOS signaling pathway in high glucose-induced HUVECs(± s,n = 3)
4 讨 论
糖尿病导致的微血管和大血管并发症是导致糖尿病患者发病率和病死率升高的主要原因[12]。糖尿病导致的内皮功能障碍是糖尿病血管并发症发生的关键和起始因素[13],是血管损伤的最早期反应[14]。ICA 可以通过调节PRMT/ADMA/DDAH(蛋白质精氨酸甲基转移酶/不对称二甲基精氨酸/二甲基精氨酸二甲基氨基水解酶)通路改善ApoE(-/-)小鼠的内皮功能[15],也可以改善高糖诱导的内皮祖细胞功能障碍,与其抑制p38/CREB 通路、激活Akt/eNOS/NO 通路有关[10]。此外,研究表明ICA 可以通过抗内皮细胞氧化应激改善糖尿病肾病状态下Ach 诱导的胸主动脉舒张和Phe 诱导的收缩功能[9]。本研究通过一次性腹腔注射四氧嘧啶破坏小鼠胰岛构建糖尿病模型,ICA 灌胃给药2 周后小鼠多饮、多食、体重下降等症状较模型组有所改善。给药结束后取各组小鼠的胸主动脉,通过离体血管灌流的方法检测ICA对糖尿病小鼠血管环舒缩功能的影响。实验结果发现,糖尿病小鼠胸主动脉由Phe、KCl 诱导的收缩反应和由Ach 诱导的内皮依赖性舒张均受到明显损伤,而ICA 给药显著改善糖尿病小鼠Phe 诱导的收缩反应和由Ach 诱导的血管环舒张反应,对KCl诱导的血管环收缩反应有一定改善作用,但无统计学差异。与正常组相比,模型组对SNP 诱导的非内皮依赖性舒张基本无变化,表明糖尿病早期,主要表现为内皮功能障碍,平滑肌细胞受损程度较弱。
eNOS 主要表达于内皮细胞,负责产生NO,扩散至下层血管平滑肌细胞引起松弛效应[16]。eNOS失调导致的NO 生物利用度降低是导致内皮依赖性血管舒张功能障碍的主要特征[17]。p38 MAPK是MAPK 家族的关键成员,是炎症和氧化应激的重要参与者,在心血管疾病中起着重要作用[18],也参与内皮功能障碍的发展[19]。p38 MAPK 的激活会加速炎症和氧化应激的发生,进而导致内皮功能障碍[20]。本研究通过体外高糖诱导HUVECs构建细胞模型,发现高糖导致HUVECs 细胞中eNOS 的活化降低、p38 MAPK 磷酸化水平升高,ICA(30 μmol/L)可以逆转高糖诱导的变化,从而保护内皮细胞。说明ICA 可能通过调节p38 MAPK/eNOS信号通路改善内皮功能障碍。
综上所述,ICA 可能通过抑制p-p38 MAPK 表达,提高内皮细胞中eNOS 的磷酸化水平,进而改善糖尿病状态下小鼠胸主动脉的血管舒缩功能,ICA有望成为治疗糖尿病血管病变的潜在药物。

