Cd 污染土壤生物毒性的发光菌法测定及评价
万水霞 李帆 王静 蒋光月 吴萍萍 武际

摘要 [目的]测定及评定Cd污染土壤的生物毒性。[方法]选取青海弧菌Q67(Vibrio qinghaiensis sp.-Q67)为指示微生物,采用急性毒性微孔板法,发光抑制率为测试指标,利用发光菌方法评价施用不同调理剂的Cd污染土壤的生物毒性。[结果]Cd污染土壤提取液对发光菌的发光有抑制作用,并随着Cd浓度的增加,发光菌的发光强度逐渐减小,其发光抑制率与Cd浓度呈正相关,Cd的EC50为10.97 mg/kg。与CK对比,施用白云石的处理显著降低了Cd的有效性及Cd的生物毒性。Cd 有效性和青海弧菌的发光抑制率降低幅度分别为29.95%、15.35%;用发光菌方法测得Cd的生物毒性与化学方法测得Cd的有效性具有显著的正相关。[结论]结合化学分析与生物毒性检测可为污染土壤评价与风险评估提供依据。
关键词 Cd 污染土壤;生物毒性;发光菌法;青海弧菌 Q67
中图分类号 X 825 文献标识码 A
文章编号 0517-6611(2022)08-0057-04
doi:10.3969/j.issn.0517-6611.2022.08.016
开放科学(资源服务)标识码(OSID):
Detection and Evaluation of Biotoxicity of Cd Contaminated Soil by Luminescent Bacteria
WAN Shui-xia,LI Fan,WANG Jing et al (Institute of Soil and Fertilizer,Anhui Academy of Agricultural Sciences/Key Laboratory of Nutrient Cycling and Resource Environment of Anhui Province,Hefei,Anhui 230031)
Abstract [Objective] To determine and evaluate the biotoxicity of Cd contaminated soil.[Method]Vibrio qinghaiensis sp.-Q67 was selected as indicator organisms,luminescence inhibition rate was the test index,the toxic micro-pore-plate method was used to evaluate the biotoxicity of Cd contaminated soil with different conditioners.[Result]The extracts of Cd contaminated soil had an inhibitory effect on the luminescence of luminescent bacteria.With the increase of Cd concentration,the luminescence intensity of luminescent bacteria gradually decreased.The luminescence inhibition rate was positively correlated with the Cd concentration.The EC50 of Cd was 10.97 mg/kg.Compared with CK,the application of dolomite significantly reduced the availability of Cd and the biotoxicities of Cd,the availability of Cd and the luminescence inhibition rate of Vibrio qinghaiensis sp.-Q67 decreased by 29.95% and 15.35% respectively.There was a significant positive correlation between the biotoxicity of Cd measured by luminescent bacteria method and the effectiveness of Cd measured by chemical method.[Conclusion]The combination of chemical analysis and biological toxicity test can provide a basis for comprehensive evaluation and risk assessment of contaminated soil.
Key words Cd contaminated soil;Biotoxicity; Luminescent bacteria;Vibrio qinghaiensis sp.-Q67
隨着经济的迅速发展,大量开采重金属矿藏、不合理施用农药化肥以及使用受到工业污染的水源进行灌溉等,导致某些地区农田土壤中重金属含量超标。其中,我国土壤重金属污染,镉(Cd)以7.0%的点位超标率位居首位 [1-3]。当环境受到镉污染,就很难消除,土壤中的镉会通过土壤—农作物—人体迁移富集。由于重金属镉的非生物降解性和蓄积性使其长期残留在人体内而产生毒性效应,影响人体的消化系统,并严重损害肝脏和肝脏酶系统,同时镉也会造成骨骼软化和骨质疏松等问题,引起器官癌变及慢性疾病 [4-5]。因此,开展重金属镉的生物毒性研究,探讨其防治措施显得十分重要。
发光菌法毒性测试是通过检测发光菌与待测物作用前后发光强度变化来判断待测物毒性大小的综合毒性检测方法 [6-7]。该方法因具有灵敏、简便、价廉等优点,已被广泛应用于水体及食品污染物的毒性评价 [8-9]。我国于1995 年将这一方法列为环境毒性检测的标准方法GB/T 15441—1995 [10]。近年来,应用发光菌法检测重金属污染土壤的生物毒性的研究已取得了一定的进展 [11-12],但还未确立标准的试验方法。因此,利用发光菌法检测土壤提取液中重金属的浓度,确定污染土壤中重金属与发光细菌的剂量-效应关系,实现土壤重金属毒性的快速诊断,仍是人们亟待解决的科学问题。该研究选取重金属背景含量较低的土壤作为供试土壤,人为投加污染物Cd制备重金属污染土壤,在中低污染浓度条件下应用发光菌对Cd污染土壤的生物毒性进行测定,以期为重金属污染土壤的生物毒性研究提供依据。
1 材料与方法
1.1 材料
1.1.1 供试土壤。试验用原土采集自安徽省农业科学院土壤肥料研究所怀远河溜镇罗新庄村无污染试验小区( 0~20 cm),采集的原土风干后过20目筛,用于土培试验。供试土壤基本理化性质为有机质11.7 g/kg、全氮0.84 g/kg、全磷0.42 g/kg、速效钾77.1 mg/kg、碱解氮55.3 mg/kg、有效磷12.4 mg/kg、pH 6.46、阳离子交换量(CEC)241.49 mmol/kg、Cd含量0.079 mg/kg。
1.1.2 供试污染物。Cd (NO3)2·4H2O为分析纯试剂,以水溶液的形式投加,投加量以风干土计算。
1.1.3 供试生物。试验采用的发光细菌为青海弧菌 Q67(Vibrio qinghaiensis sp.-Q67)冻干粉购自滨松光子医疗科技(廊坊)有限公司,编号为 CS235。
1.2 方法
1.2.1 污染土壤的培养。
根据国家规定的农用地土壤污染风险筛选值 [13],在高于筛选值的中低污染浓度范围内,设置单一重金属Cd污染土壤。污染土壤的Cd含量梯度为1.0、2.0、3.0、4.0、5.0 mg/kg,将毒物Cd (NO3)2·4H2O先溶解于超纯水后再喷洒到土壤中,充分混匀,调节土壤含水量为田间持水量的60%,用牛皮纸封口,室温培养30 d。在培养期间,每隔2 d定时通过称重法加入去离子水补充水分,控制土壤含水量为田间持水量的60%左右。使人工模拟的重金属污染土壤与实际污染土壤的状况接近。此处所提含量不包括原有土壤中重金属的含量,下同。
1.2.2 添加不同调理剂的土培试验。
以Cd (NO3)2·4H2O作为Cd源,加入供试土壤中,培养30 d,制成Cd含量为2.5 mg/kg的Cd污染土壤。然后向Cd污染土壤中添加不同的調理剂再进行培养。不同调理剂的添加量都设置为土壤的3%,试验共设置4个处理:①CK(不加调理剂,即为Cd污染土壤);②生物炭;③白云石;④生物有机肥,每个处理设置3次重复。土壤培养的方法同“1.2.1”。培养 120 d 后将各处理盆钵内的土样翻匀进行采样,测定土壤有效态Cd含量,并用发光菌法测定土壤的生物毒性。
供试调理剂:生物炭采用水稻秸秆制备,在密闭环境下500 ℃高温炭化, 并过0.149 mm筛,密封备用。生物炭 pH 为 7.54,Cd含量为 0.021 mg/kg;白云石,购自安徽省肥东县双山白云石矿厂,过300 目筛,主要成分为 CaMg(CO3)2,含少量其他杂质,pH 7.93,Cd未检出;生物有机肥购于安徽霍邱县荣益喜洋洋生物有机肥,主要采用畜禽粪便和作物秸秆经微生物菌种发酵制成,总养分含量(P2O5+N+K2O)7.6%,有机质含量为 53%,pH 7.9,Cd含量为0.27 mg/kg。
1.2.3 土壤重金属的浸提。
分别使用水(超纯水)、酸(0.1 mol/L HCl溶液)、0.1 mol/L CaCl2作为浸提剂,称取“1.2.1”中Cd含量为2.0 mg/kg培养好的土样置于离心管中,分别按固液质量比1∶2.5加入上述3种液体。离心管放入摇床中,在150 r/min条件下分别振荡0.5、1.0、2.0、4.0、8.0 h 后以3 000 r/min离心10 min,取上层清液待测。防止pH的改变对发光菌的发光强度造成影响,0.1 mol/L HCl溶液浸提得到的浸提液需要调节pH为7.0左右。
在选定最佳浸提条件后,以最佳浸提条件对各土样进行浸提试验,测定并计算各浸提液对发光菌的发光抑制率,可得到污染物浓度与微生物毒性之间的关系曲线。
1.2.4 菌种的培养。
1.2.4.1 培养基的配制。酵母膏 5 g、胰蛋白胨5 g、NaCl 8.5 g、甘油 3 mL、MgCl2 3.2 g、CaSO4 0.1 g,加蒸馏水至1 L,调节 pH至9.0,121 ℃灭菌 20 min [14]。
1.2.4.2 斜面及液体菌种培养。青海弧菌冻干粉用复苏液复苏后,将菌液接种到配制好的新鲜培养基中进行斜面传代培养。将青海弧菌第三代斜面菌种转接到含有 100 mL 培养液的 250 mL锥形瓶中,以180 r/min、25 ℃恒温培养24~30 h至对数生长期备用。用于毒性测定的菌液初始发光度控制在 300~900 lx为宜。
1.2.5 发光菌的发光强度测定。以白色 96 微孔板为载体,发光菌为试验生物,以相对发光单位为检测信号,采用多功能酶标仪进行发光强度的测定。将 96 孔微板的第 1 列的 6 个孔加蒸馏水作为空白对照,其他孔加入 150 μL 土壤浸提液样品。依次加入 50 μL发光菌菌液混合均匀,反应15 min后测定发光菌的发光度(RLU),按照公式计算出不同质量浓度Cd对青海弧菌的发光抑制率 [14-15]:发光抑制率=(1-样品的RLU对照的RLU)×100%。
2 结果与分析
2.1 不同浸提条件对青海弧菌发光的影响
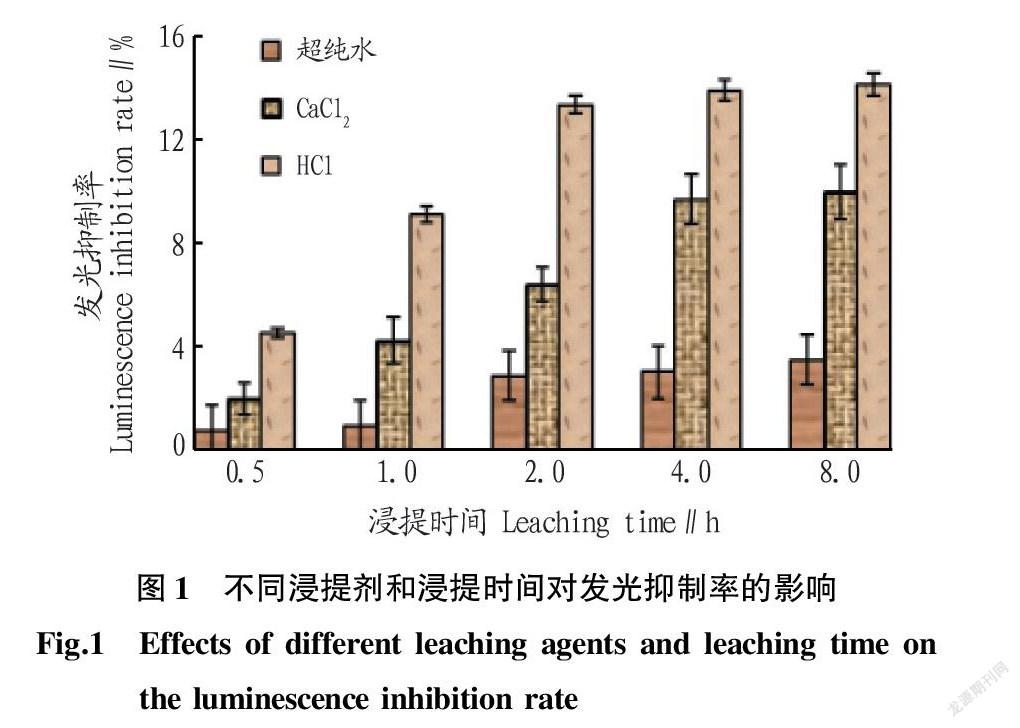
应用发光菌法检测污染土壤的生物毒性需要提取土壤浸出液,不同提取剂浸提出重金属的浓度不同,浸提出的重金属浓度越高则对发光菌的抑制率越强。该研究分别选取了超纯水、CaCl2和HCl浸提土壤,试验结果如图1所示。从图1可以看出,不同提取剂的提取效率存在差异,随着浸提时间的延长,3种提取剂浸提率均表现为上升的趋势。用HCl浸提的土壤溶液对青海弧菌发光抑制率为4.57%~14.23%;CaCl2浸提的土壤溶液的发光抑制率为2.00%~10.03%;超纯水浸提的土壤溶液的发光抑制率为0.77%~3.52%。显然,以HCl对污染土壤有效态Cd的提取率最高,对青海弧菌的发光抑制作用最强。
在不同浸提时间上,不同浸提剂表现出了相似的变化规律,即随着浸提时间的延长青海弧菌的发光抑制率先逐渐增大,然后趋于平缓。当浸提时间为0.5 h时,超纯水和HCl浸提的土壤溶液的发光抑制率分别为0.77%和4.57%;当浸提时间为2.0 h时,二者发光抑制率分别增大至2.88%和13.42%;当浸提时间增至8.0 h时,发光抑制率分别为 3.52%和14.23%。CaCl2为浸提剂时,浸提0.5 h时发光抑制率最低,为2.0%;4.0 h时,发光抑制率增至9.75%;4.0 h以后,发光抑制率增加幅度变缓。由此可见,0.5 h时,3种浸提剂均不能将土壤中的Cd浸提完全;以超纯水或HCl浸提2.0 h,Cd浸提相对比较完全;以CaCl2浸提4.0 h,Cd浸提比较完全。综合考虑浸提效率,该研究选择最优的浸提条件为0.1 mol/L HCl溶液浸提2.0 h。后面毒性试验都按此最优浸提条件进行处理。
2.2 Cd污染土壤的生物毒性
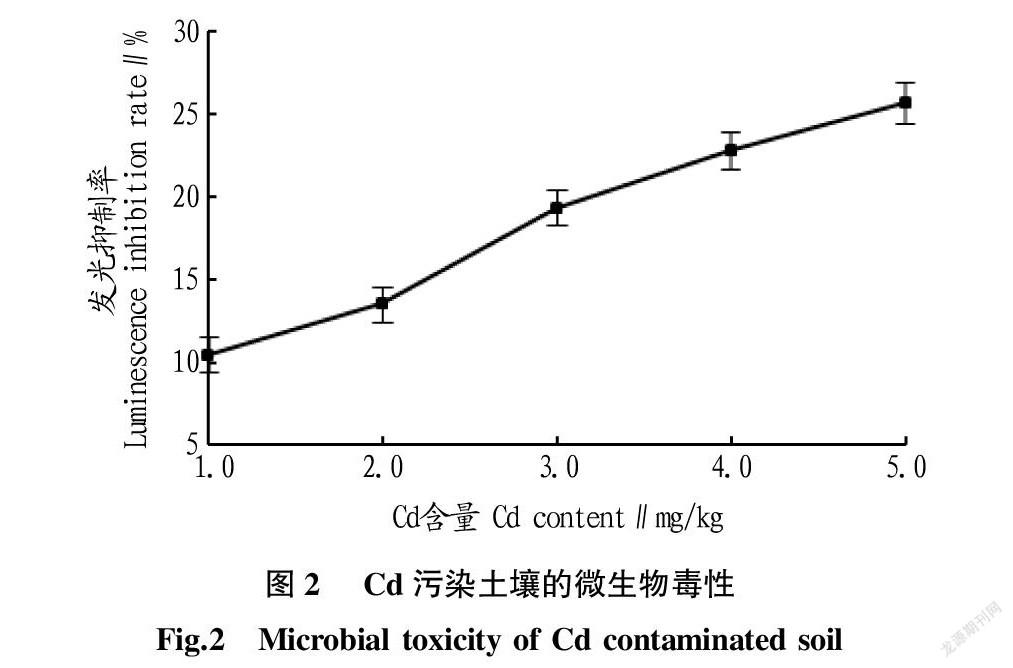
从Cd对青海弧菌Q67的生物毒性试验结果(图 2)可以看出,当Cd含量为1.0 mg/kg时,即表现出毒性,发光菌的发光抑制率为10.53%;当Cd含量达到3.0 mg/kg时,发光抑制率为19.35%;当土壤中Cd的含量为5.0 mg/kg时发光抑制率增至25.74%。可见,在试验范围内,Cd污染土壤的生物毒性与Cd含量呈正相关,随着Cd含量的增加,青海弧菌的发光抑制率增加,Cd毒性增强。
根据试验数据进行回归分析和 EC50的计算,得出重金属Cd含量与青海弧菌 Q67发光抑制率的剂量-效应回归方程为y=3.966 4x+6.506 5(R 2=0.960 9),EC50为10.97 mg/kg 。
2.3 施用不同调理剂对Cd污染土壤Cd的有效性及生物毒性的影响 目前,钝化修复已成为农田重金属污染土壤修复的重要方式。该研究利用不同调理剂生物炭(T1)、白云石(T2)、生物有機肥(T3)对Cd污染土壤进行钝化处理,并结合发光菌方法检测钝化后土壤对青海弧菌发光度的影响。结果表明(图3), 经过土壤培养,选用的3种调理剂均能降低土壤有效态Cd含量,土壤有效态Cd含量表现为白云石<生物炭<生物有机肥,对有效态Cd的降低效果表现为白云石>生物炭>生物有机肥。对有效态Cd的降低效果越强,则对发光菌的的抑制率就越低。所以,不同调理剂对放光菌的抑制率表现为白云石<生物炭<生物有机肥。其中,白云石处理(T2)与其他处理之间差异显著。与不加调理剂(CK)相比较,施用白云石的处理(T2)显著降低了Cd的有效性和Cd的微生物毒性。Cd 有效性降低幅度为29.95%,对青海弧菌的发光抑制率降低了15.35%。同时,青海弧菌的发光抑制率的变化趋势与Cd有效性的变化趋势相一致。
3 讨论
3.1 不同浸提条件对青海弧菌发光的影响
该研究中,不同浸提剂提取的土壤溶液的发光菌抑制率结果为HCl >CaCl2>超纯水,这与不同浸提剂浸提出重金属Cd含量有直接的关系。Cd 元素是一种强富集性元素,在土壤中多以可交换态形式存在,铁锰氧化态及有机结合态很少 [16-17]。有研究显示,提取剂提取土壤重金属Cd是提取剂从土壤胶体上交换出的H +(或Al 3+)对Cd +的置换作用,以及提取剂本身对Cd +的直接置换作用 [18]。不同提取剂的提取机制及土壤性质如pH、有机质、黏粒含量等都会不同程度地影响提取效率。HCl为稀酸,属溶解能力较强的代换剂,其代换机制是H +的置换作用,同时,HCl还可以将非代换吸附态的重金属提取出来;CaCl2为中性盐溶液,其提取出的重金属主要为水溶态和可交换态,Ca 2+的离子强度影响了其对Cd +的置换能力,进而影响浸提率,CaCl2的浸提效率低于HCl;水对Cd的提取率最低,因为水对土壤的结构破坏小,不适宜对土壤重金属Cd的提取。
3.2 Cd污染土壤的生物毒性
Cd元素为生物体非必需元素,在较低浓度时就会对生物体产生毒害作用,Cd可与含羟基(—OH)、氨基(—NH)、巯基(—SH)的蛋白质分子结合,取代蛋白反应中心的必需金属,抑制大分子合成和酶活性,进而抑制生物的生长及代谢 [19]。该研究中以青海弧菌 Q67 作为受试菌种,对人工添加不同浓度重金属Cd污染土壤进行生物毒性检测。
Cd表现出毒性与浓度呈正相关,含量越高,对发光菌的毒害作用越强。相比于理化方法,发光菌方法具有快速简便的优点,可对重金属污染土壤的生物毒性进行快速检测。但发光菌的生命周期短,该研究中测定的是暴露15 min的发光抑制率,所以,发光菌方法测定的是重金属Cd的急性毒性,不能反映慢性毒性的大小。另外,单个重金属污染虽有发生,但在自然界和现实生活中,重金属的污染多为伴生性或综合性 [20],如果仅根据单一重金属污染情况制定标准往往与现实不能完全相符,因此,今后有必要对复合污染土壤条件的毒性进行研究 ,从而确定清洁土壤的标准。
3.3 不同调理剂对Cd污染土壤Cd的有效性及生物毒性的影响
不同调理剂对放光菌的抑制率表现为白云石<生物炭<生物有机肥,不同调理剂不同程度地提高了土壤pH,降低了土壤中有效性Cd含量以及对发光菌的毒害作用。
为了验证试验结果,该研究测定了不同处理土壤的pH。与不加调理剂CK(5.49)相比,白云石处理的土壤 pH(7.51)提高最明显,这是由于白云石的主要物质是碳酸钙镁盐,添加白云石使土壤的 pH上升既有利于Cd形成氢氧化物或碳酸盐结合态沉淀及共沉淀,也可增加土壤颗粒表面负电荷,从而促进了对Cd的吸附作用,降低了土壤中有效态Cd含量以及生物毒性,这与姜超强等 [21-22]的研究结论相一致。生物炭处理后土壤pH(6.22)低于白云石但高于生物有机肥(5.77)。生物炭是富含碳的有机物质,孔隙结构发达、比表面积大、吸附性强 [23],生物炭通过增加土壤的阳离子交换量,提高土壤pH, 同时生成难溶性的有机络合物来降低重金属Cd的生物有效性 [24-26],从而减小对发光菌的毒害作用;该研究中采用的生物有机肥也偏碱性,因此在施入土壤后土壤 pH略有提高,这与张丽等 [27-28]的研究结论一致。
此次研究中不同调理剂施入土壤,不同程度地提高了土壤pH,降低了土壤中有效Cd含量以及对发光菌的抑制率,即降低了Cd对发光菌的毒性。土壤有效态Cd含量表现为白云石<生物炭<生物有机肥;Cd污染土壤对发光菌的抑制率表现为白云石<生物炭<生物有机肥。青海弧菌的发光菌抑制率(y)与土壤有效Cd含量(x)具有极显著的正相关,其回归方程为y=4.471 2x+8.333 7(R 2=0.982)。说明发光菌方法测定重金属生物毒性与化学方法测定重金属含量和有效性的结果有高度一致性。因此,以发光菌为指示生物来测定土壤中重金属的生物毒性可行性较高。
4 结论
(1)相较于超纯水和CaCl2溶液,使用0.1 mol/L HCl溶液浸提土壤中重金属Cd的效率最高,浸提的最佳时间为2.0 h。
(2)不同浓度Cd污染土壤浸提液对青海弧菌Q67的生物毒性存在良好的剂量-效应关系,可以利用青海弧菌Q67发光菌法快速评价土壤Cd的生物毒性。
(3)土壤的生物毒性与其中所含的污染物浓度密切相关,毒性试验结果与土壤理化指标具有较好的相关性,可见,结合化学分析与生物毒性检测是进行污染土壤综合评价和危害识别的重要手段。
综上所述,使用发光菌法对重金属污染土壤的生物毒性进行测定和评价具有可行性。将发光菌法与化学方法相结合用于污染物急性毒性的快速筛查可获得更准确的结果。后续研究可扩大污染土壤的重金属浓度范围,同时要考虑土壤中多种污染物复合污染条件下的生物毒性,并尝试使用其他发光菌种进行检测。
参考文献
[1]
环境保护部,国土资源部.全国土壤污染状况调查公报(2014年4月17日)[J].环境教育,2014(6):8-10.
[2] MWESIGYE A R,YOUNG S D,BAILEY E H,et al.Population exposure to trace elements in the Kilembe copper mine area,Western Uganda:A pilot study[J].The science of the total environment,2016,573:366-375.
[3] 陈能场,郑煜基,何晓峰,等.《全国土壤污染状况调查公报》探析[J].农业环境科学学报,2017,36(9):1689-1692.
[4] MOYNIHAN M,PETERSON K E,CANTORAL A,et al.Dietary predictors of urinary cadmium among pregnant women and children[J].Science of the total environment,2017,575:1255-1262.
[5] 趙方杰,谢婉滢,汪鹏.土壤与人体健康[J].土壤学报,2020,57(1):1-11.
[6] 周明霞.发光细菌的分离鉴定以及用于环境毒性检测的系统研究[D].长沙:湖南师范大学,2012.
[7] QU R J,WANG X H,LIU Z T,et al.Development of a model to predict the effect of water chemistry on the acute toxicity of cadmium to Photobacterium phosphoreum[J].Journal of hazardous materials,2013,262(15):288-296.
[8] 吴晓壬,罗剑飞,朱兴江,等.DMSO 胁迫提高发光细菌毒性实验敏感度的研究[J].现代食品科技,2017,33(5):298-304.
[9] 徐恒蒲,孟一鸣,李澳,等.重金属污染土壤生物毒性的发光菌法测定及评价[J].化工环保,2019,39(5):538-544.
[10] 国家环境保护局,国家技术监督局.水质 急性毒性的测定 发光细菌法:GB/T 15441—1995[S].北京:中国标准出版社,1996.
[11] WANG X H,QU R J,WEI Z B,et al.Effect of water quality on mercury toxicity to Photobacterium phosphoreum:Model development and its application in natural waters[J].Ecotoxicology and environmental safety,2014,104:231-238.
[12] 许霞,薛银刚,刘菲,等.废弃农药厂污染场地土壤浸出液的急性毒性和遗传毒性筛查[J].生态毒理学报,2017,12(6):223-232.
[13] 生态环境部,国家市场监督管理总局.土壤环境质量 农用地土壤污染风险管控标准(试行):GB 15618—2018[S].北京:中国环境科学出版社,2018.
[14] 韦东普.应用发光细菌法测定我国土壤中铜、镍毒性的研究[D].北京:中国农业科学院,2010:16-18.
[15] 周上洋,赵建亮,黄国勇,等.重金属 Zn、Cu 和Hg 对基因重组发光菌的综合毒性及其联合效应[J].华南师范大学学报(自然科学版),2018,50(1):33-37.
[16] 张传琦.土壤中重金属砷、镉、铅、铬、汞有效态浸提剂的研究[D].合肥:安徽农业大学,2011:31-37.
[17] 陈齐,邓潇,陈珊,等.典型土壤不同提取态Cd与水稻吸收累积的关系[J].环境科学,2017,38(6):2538-2545.
[18] MCBRIDE M B.Cadmium uptake by crops estimated from soil total cd and pH[J].Soil science,2002,167(1):62-67.
[19] 陈静,刘荣辉,陈岩贽,等.重金属污染对土壤微生物生态的影响[J].生命科学,2018,30(6):667-672.
[20] 韦东普,马义兵,陈世宝,等.发光细菌法测定环境中金属毒性的研究进展[J].生态学杂志,2008,27(8):1413-1421.
[21] 姜超强,董建江,徐经年,等.改良剂对土壤酸碱度和烤烟生长及烟叶中重金属含量的影响[J].土壤,2015,47(1):171-176.
[22] HALE B,EVANS L,LAMBERT R.Effects of cement or lime on Cd,Co,Cu,Ni,Pb,Sb and Zn mobility in field-contaminated and aged soils[J].Journal of hazardous materials,2012,199/200:119-127.
[23] 姜志翔,郑浩,李锋民,等.生物炭技术缓解我国温室效应潜力初步评估[J].环境科学,2013,34(6):2486-2492.
[24] 冯敬云,聂新星,刘波,等.镉污染农田原位钝化修复效果及其机理研究进展[J].农业资源与环境学报,2021,38(5):764-777.
[25] 刘阿梅,向言词,田代科,等.生物炭对植物生长发育及重金属镉污染吸收的影响[J].水土保持学报,2013,27(5):193-198,204.
[26] PARK J H,LAMB D,PANEERSELVAM P,et al.Role of organic amendments on enhanced bioremediation of heavy metal(loid) contaminated soils[J].Journal of hazardous materials,2011,185(2/3):549-574.
[27] 張丽,侯萌瑶,安毅,等.生物炭对水稻根际微域土壤Cd生物有效性及水稻Cd含量的影响[J].农业环境科学学报,2017,36(4):665-671.
[28] 迟荪琳,徐卫红,熊仕娟,等.不同镉水平下纳米沸石对土壤 pH、CEC及Cd形态的影响[J].环境科学,2017,38(4):1654-1666.

