农产品中黄曲霉毒素绿色脱毒技术研究进展
王雪 王盾 张奇 黄大明 李培武 张姝娟 朱梦洁 董菁 冯鹏


摘要 黄曲霉毒素是毒性最强的一类真菌毒素,归属为1A类致癌物,黄曲霉及黄曲霉毒素污染是影响花生、玉米、谷物等农产品安全的重要原因之一。国内外对农产品中黄曲霉毒素的脱毒方法开展了大量的研究,取得了丰富的进展。对黄曲霉毒素的绿色脱毒法进行了综述,主要包括:物理去除法、生物脱毒方法、光降解法等,并对绿色脱毒技术的发展趋势进行展望,以期为黄曲霉毒素绿色脱毒技术进一步应用于食用油中脱毒研究提供参考。
关键词 黄曲霉;黄曲霉毒素;绿色脱毒
中图分类号 TS 201.6 文献标识码 A
文章编号 0517-6611(2022)08-0007-05
doi:10.3969/j.issn.0517-6611.2022.08.002
開放科学(资源服务)标识码(OSID):
Research Progress on Green Detoxification Technology of Agricultural Aflatoxins
WANG Xue 1,2,WANG Dun 1,2,ZHANG Qi 2,3,4 et al
(1.Xiangyang Academy of Agricultural Sciences,Xiangyang,Hubei 441057;2.Key Labortory of Oil Crops Biology of Ministry of Agriculture and Rural Affairs,Wuhan,Hubei 430062;3.Oil Crops Research Institute of Chinese Academy of Agriculture Science,Wuhan,Huibei 430062;4.Laboratory of Quality & Safety Risk Assessment for Oilseed Products (Wuhan),Ministry of Agriculture,Wuhan,Huibei 430062)
Abstract Aflatoxins is one of the most Carcinogenic Class 1A carcinogens.ASPERGILLUS flavus and aflatoxins contamination are the main factors that affect the safety of peanut,corn,grain and other agricultural products.In this paper,the green methods of aflatoxins removal,including physical removal,photodegradation,biological detoxification,etc.are reviewed.These different green detoxification methods are also compared and prospected,which provides a theoretical basis and research ideas for the aflatoxins detoxification techniques.
Key words Aspergillus flavus;Aflatoxins;Detoxification methods
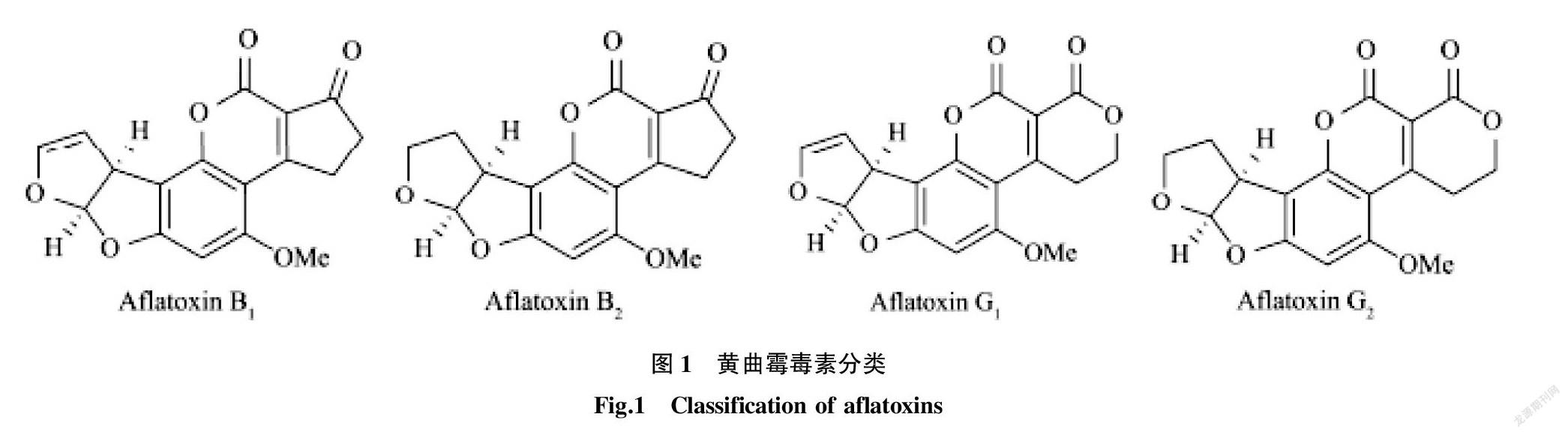
黄曲霉毒素(AFT)是一类由黄曲霉菌、寄生曲霉菌、集蜂曲霉菌、溜曲霉菌等多种真菌产生的一类具有生物活性的次生代谢产物。分子量范围为312~346,带有香豆素和双呋喃环官能团,无色无味,毒性极强,目前发现的黄曲霉毒素有20多种,但理化性质相似,根据在紫外线下发光颜色的不同,可将其分为B族和G族两大类,激发蓝色荧光为B族,而激发黄绿色荧光的为G族。50%的黄曲霉只能产生B族黄曲霉毒素,而寄生曲霉几乎都可以产生B族和G族黄曲霉毒素 [1]。
由图1可知,黄曲霉毒素的毒性极强,主要有AFB1、AFB2、AFG1和AFG2等类型,AFB1分布最多、毒性最强,有较强的致癌、致畸、致突变作用。人和动物长期小剂量摄入可导致胚胎畸形变异等诱发原发性癌症,一次性大量摄入会引起急性中毒或死亡。国际上采用欧标限量标准为:AFB1≤2 μg/kg,AFT≤4 μg/kg [2],根据我国GB 2761—2011《食品安全国家标准食品中真菌毒素限量》规定,花生、玉米及制品AFB1≤20 μg/kg;大米及食用油AFB1≤10 μg/kg,粮食豆类、发酵食品及调味品AFB1≤5 μg/kg。
根据联合国粮农组织报道,全球每年约有25%农产品受到真菌毒素污染,其中约2%因受到严重污染而失去营养和经济价值。研究表明,25%黄曲霉毒素急性中毒致死事件是由黄曲霉毒素的高暴露引起的 [3-4]。近年来,黄曲霉毒素超标导致的农产品安全事件给国家经济造成的直接利益损失高达200亿元,也给我国人民生命健康和消费安全带来了很大威胁。因此,当前迫切需要发展黄曲霉毒素防控和脱毒技术研究。
随着人们对生活水平和对健康追求意识的不断提高,对农产品加工过程中黄曲霉毒素脱毒技术的安全性也提出了更高的要求。传统的高温法、化学法等黄曲霉脱毒技术虽然有较好的效果,但会破坏风味和营养,或者会添加不明危害因子,无法满足当代农产品发展的要求。因此,探索安全、无污染、高效、易推广的绿色黄曲霉脱毒技术,成为当前解决粮油等农产品安全问题迫在眉睫的关键课题,也是发展乡村振兴战略,促进农业高质量发展的重要抓手。近年来,国内外学者对农产品中黄曲霉毒素的脱毒方法开展了大量的研究,取得了丰富的进展。该研究综述了国内外黄曲霉毒素的绿色脱毒法,包括物理去除法、气体熏蒸法、生物去除法、光降解法等,并对绿色脱毒技术的发展趋势进行展望,以期为黄曲霉毒素绿色脱毒技术应用推广研究提供参考。
1 物理去除法
1.1 机械分选去除
农产品表面出现黄绿色霉变、破损、变质,都可能是污染了黄曲霉毒素,这些农产品会出现营养价值低,且有一定的毒害,必须剔除,可以通过人工或机器设备将有黄曲霉污染的农产品挑选出来,操作方法简单。有报道提及可以用黄曲霉毒素在紫外光下发光原理,直接将有霉变的农作物识别并剔除,也可通过电子眼去除,方法安全,方便可行。但是该方法对农作物的损失量较大,造成浪费,较适合家用剔除霉变物质或小型油料作坊去毒处理。
1.2 材料吸附法
采用吸附剂可以吸附植物油和饲料中的黄曲霉毒素。常用的吸附剂有膨润土、活性炭、水合硅铝酸盐、酵母细胞壁、葡甘露聚糖等,在工业生产中,一般用硅酸盐以及纳米材料来去除霉菌毒素,吸附的主要原理是利用硅酸盐多孔性与静电作用,与带有离子极性的毒素结合,从而脱除黄曲霉毒素。齐德生等 [5]利用蒙脱石吸附黄曲霉毒素B1,最大吸附量可达到600 μg/g,效果良好,但是需要结合一些化学方法来进一步对吸附后材料进行处理。
葡甘露聚糖是一种可溶性半纤维素,对黄曲霉毒素有很强的吸附作用,可以抑制毒素在生物体内的吸收,缓解黄曲霉毒素对肝脏的损伤 [6]。Susanto等 [7]从魔芋中提取了葡甘露聚糖和葡甘露聚糖等发酵物质,同时在体外模拟肠道内环境,研究了这两种发酵物对黄曲霉毒素的吸附性能,结果表明这些物质的吸附性能与其添加体积呈现出非常好的线性关系。该研究表明这一类聚糖类化合物可以应用于后期临床解毒实验,有望开发一些药物解毒。
1.3 微生物吸附法
某些微生物吸附黄曲霉毒素,可以形成菌体-毒素复合体,排出体外从而降低黄曲霉毒素的损害 [8]。比如常见微生物:乳酸菌、酵母菌和双歧杆菌等。Shah [9]发现乳酸菌可以吸附黄曲霉毒素B1形成AFB1-乳酸菌复合物。Elsanhoty等 [10]研究了5种益生菌和乳酸菌对酸奶中AFM1的吸附作用,在酸奶生产和储存时期,利用益生菌和乳酸菌不同组合对AFM1的吸附,最后试验表明 L.plantrium 和(S.thermophilus、L.bulgaricus、L.plantrium)组合展示出较好降解AFM1性能。Zhou等 [11]在报道中发现从发酵酱油中筛选出并鉴定了一种粗糙酵母解毒黄曲霉毒素B1,最有效的解毒率约为97%。这一类吸附方法可以用一些益生菌在肠道内解毒,形成益生菌复合体,从而排出体外,有较为广泛的脱毒应用效果。
2 光降解法
2.1 紫外光照射降解
通过紫外照射或γ射线照射受污染农作物可以达到杀菌脱毒的目的。研究发现,在800 μW/cm 2紫外照射花生油30 min,含量约2 mg/kg AFB1,可以完全消除,对照射过后的花生油营养价值进行评价,其中除了过氧化值显著增加(在国标范围内)外,其他性能如碘价、酸价及反式脂肪酸等无明显变化 [12]。在不改变食用油的营养价值的情况下,使用紫外降解法简单快速。王守经等 [13]研究不同剂量的高能电子束和γ射线辐照处理小麦粉中AFB1,结果表明,辐照剂量越大,降解率越高;再用相同处理剂量分别辐照处理液体溶液和小麦中的AFB1,结果溶液中降解率大于污染小麦的降解率,而且在一定条件下降解率大于90%。Mao等 [14]用紫外(365 nm)照射处理AFB1 25 min,降解率可达90%,并且酸价、过氧化值、不饱和脂肪酸的含量等营养品质数值均无任何改变。紫外光降解率高,而且无污染,有望在粮食作物大批量脱毒中应用。
2.2 纳米材料吸附光降解法
纳米材料是指在三维空间中有一维处于纳米尺度(1~100 nm)范围作为材料的基本单元,大约相当于10~100个原子紧密排列在一起。由于纳米技术的不断发展,不断有研究者报道了多种纳米材料应用于黄曲霉毒素的脱毒,在纳米材料表面进行修饰,开发研究出特异性吸附黄曲霉毒素的纳米材料。梁兰兰等 [15]报道了磁性纳米微粒选择性吸附脱毒法,采用了磁性纳米微粒选择性吸附花生油中黄曲霉毒素,由于花生油黏度较大,普通材料过滤难度大,利用磁性纳米材料的磁性研制出高磁性装置,吸附纳米泥渣中的黄曲霉毒素的达到花生油快速脱毒的目的。而且分离后的纳米泥渣,在高温条件下分解,纳米材料可以继续循环使用。
这种复合型纳米材料也是目前脱毒技术研究的热点,环保快捷,并且脱毒彻底,但是如何研制出复合型纳米材料并应用于生产才是后期研究的重点,而且这种改性纳米材料是否会残留于食用油中还有待于进一步研究。
2.3 半导体纳米材料光降解法
半导体磁性复合材料是一种高選择性吸附黄曲霉毒素的纳米新型材料,这种半导体的特异性是可以将光能转化为化学能,并产生活性较强的自由基,这种材料的脱毒原理就是利用该自由基可以破坏黄曲霉毒素分子结构,达到脱毒的目的。而且这种材料可回收重复利用。Wu等 [16]研究表明,黄曲霉毒素关键的高毒位点是结构末端上呋喃环的C8C9双键,而黄曲霉毒素氧化酶的酶作用部位即是AFB1的C8C9不饱和碳碳键,所以关键是有适合的解毒物质来破坏这个双键位点。
降低或钝化黄曲霉毒素B1毒性的另外一种潜在方法是半导体光催化作用,但目前为止,降低毒性的反应机制中活性氧类与高毒位点是如何作用的尚未定义。Mao等 [17]研究出层状半导体材料分成二维片可以增加比表面积,通过对材料结构鉴定,光照射含有AFB1初始光降解中间体的半导体纳米材料g-C3N4,研究照射2 h后的产物,这项研究可为制备惰性纳米片提供一定的参考,也可以进一步了解黄曲霉毒素B1的光降解原理。2019年Mao等 [18]经过细胞毒性试验,在线状wo3表面富集Cds,制备出一种全固态z型复合材料,可以明显降低黄曲霉毒素B1,再检测可见光照射下的水溶液毒性。根据高分辨质谱、自由基诱导试验和180同位素标记研究,深入研究了AFB1中剧毒位点的失活机理,并设计了有效的光催化剂,以减少有毒污染物及二次污染。所以设计这种有效的光降解材料是关键技术难点。
3 气体熏蒸法
3.1 等离子体法
气体等离子体在根除病毒、细菌和真菌等各种病原生物方面的有效性上已经得以证实 [15-17],气体等离子体技术是一种同时实现消毒和灭菌的方法,气体离子体可以通过电弧、电晕、直流、微、脉冲等放电产生,研究表明细菌孢子、营养菌和病毒都可以被氮气等离子体有效地灭活 [19-22]。Sakudo等 [23]利用静电感应产生的氮气等离子体作为脉冲电源来处理玻璃基板上的黄曲霉毒素15 min后,AFB1减少了90%。这种气体处理法可以应用于大规模的车间生产,但是如何控制对食品风味的影响有待进一步研究。
3.2 臭氧处理法
臭氧是一种强氧化剂,对黄曲霉毒素的脱毒效果机制是通过破坏AFB1终端呋喃环的双键来降低毒性,有很好的降解效果。罗建伟等 [24]研究了臭氧处理AFB1污染的农作物,脱毒效率大于90%。陈冉 [25]研究了臭氧对黄曲霉毒素G族的降解实验,脱毒效率比B族好,对AFG1、AFB2脱毒率分别为70%和40%。臭氧能有效破坏黄曲霉毒素致病官能团,从而提高花生安全性,不足的是,处理后花生油的酸值、过氧化值会有轻微提高,但是远低于国家标准规定,所以应用前景较好 [26]。Chen等 [27]优化了花生臭氧脱毒的条件,花生中水分含量5%(W/W)时,黄曲霉毒素对臭氧敏感,含量为6.0 mg/L臭氧在室温下与黄曲霉毒素反应30 min后降解,且降解率为65%以上。抽样处理法降解率高,应用广泛,但是能耗较高,对臭氧的消耗较大,而且会影响食品的风味,可以应用饲料生产中。
3.3 氨处理法
氨处理法也就是氨气熏蒸法,可以有效地脱除农作物中存在的黄曲霉毒素,降解机制是通过破坏黄曲霉毒素结构中的有毒活性官能团内酯环,达到脱毒的目的。梁俊平 [28]报道了氨气熏蒸法降解花生及其制品中的黄曲霉毒素在40 ℃下处理48 h后,AFB1的脱毒率可以达到84%以上。陈志娟等 [29]研究表明,用7.05%的氨气在37 ℃条件熏蒸玉米,96 h后,玉米中黄曲霉毒素的脱毒率达到92% 以上。赵国斌 [30]用10%的氨气熏蒸花生,在40 ℃处理96 h,AFB1降解率为95.1%。氨气熏蒸法降解周期较长,但是对食品风味上可能会有些影响,较适合用于饲料生产中,在食品中应用受限。
3.4 精油熏蒸法 研究发现,多种精油对危害糧食存储的黄曲霉、镰刀菌等真菌有很好的抑制生长或抑制产毒的效果,有些精油对毒素具有一定的降解性。当前精油处理方法包括喷洒谷物、液态浸泡法、气态熏蒸法等,均可以抑制真菌及毒素产生。例如,山苍子油在60 ℃下对黄曲霉毒素污染的饲料进行熏蒸可以很好地脱毒 [31]。肉桂醛、柠檬醛、丁香酚在低浓度下可以抑制黄曲霉毒素合成,从而达到脱毒的目的;在高浓度下,可以通过抑制真菌菌体生长,从而不产毒,研究表明,其中抑制效果最好的是肉桂醛 [32]。该方法成本较高,无法实现循环利用,处理效果相对较低,但是可以处理大批量饲料等农产品。
4 生物降解法
生物降解法是指利用真菌、细菌等微生物来降解黄曲霉毒素的方法。该方法条件温和,安全有效,作用结果不可逆,而且后期还有可能增加一些营养物质。近年来,利用生物降解法降解黄曲霉毒素的相关研究逐渐发展起来,并引发重视,推广应用也不断在发展。Verheecke等 [33]对目前预防AFB1污染的研究进行了评估,总结了参与黄曲霉毒素生物降解的几种类型的微生物,并详细汇总了微生物降解AFB1的效率及条件。常见生物脱毒法有2种:一是通过微生物竞争性抑制真菌的生长从而降低毒素的产生;二是利用微生物或其产生的生物酶来降低黄曲霉毒素污染,分为生物酶解法和微生物抑制法 [34]。
4.1 生物酶降解法
4.1.1 生物酶解法。该方法是指利用生物酶制剂降解黄曲霉毒素的方法,生物酶可以破坏黄曲霉毒素致毒性官能团,转化为低毒或无毒物质排出。具体可以根据微生物种类分为真菌脱毒和细菌脱毒法。Hackbart等 [35]利用里氏木霉和稻根霉在PDA培养基中产生的酶降解黄曲霉毒素B1,降解率可达到100%。Dellafiora等 [36]研究了云芝漆酶对黄曲霉毒素B1和M1的降解作用。建立了酶-底物相互作用的三维分子模型。Zhou等 [37]发现Lac2黄曲霉毒素氧化酶可以降解食品和饲料中存在的AFB1,认为Lac2作为一种新的黄曲霉毒素氧化酶,在降解食品中的AFB1中有很好的应用前景。张初署等 [38]研究了益生菌漆酶降解膳食和饲料中的黄曲霉毒素,比较不同温度、pH、金属离子及反应时间与AFB1脱毒效率的关系。研究表明,利用酵母菌及木霉菌等微生物细胞内提取物可以降解黄曲霉毒素,从酵母菌的细胞壁内提取出葡甘聚糖与黄曲霉毒素作用,脱毒率可达到100%,脱毒效果很稳定 [39]。常见生物降解酶见表1。
4.1.2 微生物降解法。枯草芽孢杆菌和解淀粉芽孢杆菌与黄曲霉菌共生,可破坏黄曲霉菌细胞器来影响真菌生长和黄曲霉毒素产生。王宁等 [40]利用黏细菌降解黄曲霉毒素B1,通过优化反应条件,降解率可达到78%。Mwakinyali等 [41]发现了细菌菌株3J2MO,在LB培养基中孵育2 d后,37 ℃下对AFB1的脱毒率达到94%,在生物防治中对AFB1污染的生物修复和脱毒具有潜在应用前景。研究发现,微生物降解法抑制机制为抑制黄曲霉分生孢子的形成,破坏黄曲霉的细胞壁和细胞器,从而彻底抑制黄曲霉菌生长,此方法可以较为彻底地解决土壤中黄曲霉菌污染问题,但是对后续环境的影响有待确定。
5 展望
黄曲霉毒素污染涉及农作物的各个环节,就经济成本而言,脱毒比防毒更有经济价值。由表2可知,目前控制黄曲霉毒素的方法有很多种,其中绿色脱毒法不仅具有避免浪费的优势,而且脱毒不可逆,不污染环境,因此成为当前倍受广大研究学者关注的方法。
上述所有脱毒法中,物理去除法适合规模化应用,但目前技术易造成大量浪费,去除效率和精确度还需进一步提升;气体熏蒸法往往适合少量样品处理,处理方式易操作,但对脱毒对象的原有品质影响较大,在处理介质的选择方面还有较大提升空间;生物降解法目前存在成本高、安全性不详等问题,寻找廉价且安全的抑菌剂或降解酶是该技术今后的发展方向;光降解法目前具有最好脱毒效率,尤其近几年报道的新型纳米材料光降解脱毒技术效果十分引人注目,中国农业科学院油料作物研究所一直致力于复合型光降解材料降解食用油中黄曲霉素的研究,目前已经完成实验室中试,该类技术使用的新型纳米材料降解黄曲霉毒素降效率高、降解彻底、产物对环境无二次污染风险,同时实现脱毒材料的再生。随着新型纳米材料生产工艺问题的不断深入解决,可以研发一种综合环保型处理黄曲霉毒素的方法,大幅降低新型光降解纳米材料的生产成本,该技术将在液体类农产品的绿色脱毒技术中呈现出非常良好的发展前景。
参考文献
[1]
徐进,罗雪云.黄曲霉毒素生物合成的分子生物学[J].卫生研究,2003,32(6):628-631,636.
[2] 王松雪,鲁沙沙,张艳,等.国内外真菌毒素检测标准制修订现状与进展[J].食品工业科技,2011,32(3):408-412,416.
[3] 刘立芳.黄曲霉毒素的检测及其降解方法进展[J].中国酿造,2014,33(1):23-26.
[4] CULLEN J M,NEWBERNE P M.Acute hepatotoxicity of aflatoxins[M].London:Academic Press,1993.
[5] 齐德生,刘凡,于炎湖,等.蒙脱石及改性蒙脱石对黄曲霉毒素B1的吸附研究[J].畜牧兽医学报,2003,34(6):620-622.
[6] EISA A,METWALLY A.Effect of glucomannan on haematological,coagulation and biochemical parameters in male rabbits fed aflatoxin-contaminated ration[J].World Mycotoxin J,2011,4(2):183-188.
[7] SUSANTO A,LACONI E B,ASTUTI D A,et al.In vitro testing to aflatoxin binding by glucomannan yeast product and glucomannan extract from Amorphophallus oncophyllus[J].Med Pet,2014,37(2):101-107.
[8] LIU R J,JIN Q Z,HUANG J H,et al.Photodegradation of aflatoxin B1 in peanut oil[J].Eur Food Res Technol,2011,232(5):843-849.
[9] SHAH N,WU X R.Aflatoxin B1 binding abilities of probiotic bacteria[J].Bioscience Microflora,1999,18(1):43-48.
[10] ELSANHOTY R M,SALAM S A,RAMADAN M F,et al.Detoxification of aflatoxin M1 in yoghurt using probiotics and lactic acid bacteria [J].Food Control,2014,43:129-134.
[11] ZHOU G H,CHEN Y J,KONG Q,et al.Detoxification of aflatoxin B1 by Zygosaccharomyces rouxii with solid state fermentation in peanut meal[J].Toxins,2017,9(1):1-9.
[12] 劉睿杰,金青哲,陈波,等.紫外照射去除黄曲霉毒素工艺对花生油品质的影响[J].中国油脂,2011,36(6):17-20.
[13] 王守经,柳尧波,胡鹏,等.辐照处理对黄曲霉毒素B1的降解效果研究[J].山东农业科学,2015,47(11):116-119.
[14] MAO J,HE B,ZHANG L X,et al.A structure identification and toxicity assessment of the degradation products of aflatoxin B1 in peanut oil under UV irradiation[J].Toxins,2016,8:1-11.
[15] 梁兰兰,李冰,陈玲.黄曲霉毒素去毒转化研究进展[J].粮食与油脂,2004(3):39-40.
[16] WU Y Z,LU F P,JIANG H L,et al.The furofuran-ring selectivity,hydrogen peroxide-production and low Km value are the three elements for highly effective detoxification of aflatoxin oxidase[J].Food Chem Toxicol,2015,76:125-131.
[17] MAO J,ZHANG L X,WANG H T,et al.Facile fabrication of nanosized graphitic carbon nitride sheets with efficient charge separation for mitigation of toxic pollutant[J].Chem Eng J,2018,342:30-40.
[18] MAO J,LI P W,WANG J M,et al.Insights into photocatalytic inactivation mechanism of the hypertoxic site in aflatoxin B1 over clew-like WO3 decorated with CdS nanoparticles[J].Appl Catal B:Environ,2019,248:477-486.
[19] FRIDMAN A.Plasma chemistry[M].London:Cambridge University Press,2012.
[20] LAROUSSI M,KONG M G,MORFILL G,et al.Plasma medicine:Applications of low-temperature gas plasmas in medicine and biology[M].London:Cambridge University Press,2012.
[21] SHINTANI H,SAKUDO A.Gas plasma sterilization in Microbiology:Theory,applications,pitfalls and new perspectives[M].London:Caister Academic Press,2016.
[22] LAROUSSI M,LEIPOLD F.Evaluation of the roles of reactive species,heat,and UV radiation in the inactivation of bacterial cells by air plasmas at atmospheric pressure[J].Int J Mass Spectrom,2004,233(1/2/3):81-86.
[23] SAKUDO A,TOYOKAWA Y,MISAWA T,et al.Degradation and detoxification of aflatoxin B1 using nitrogen gas plasma generated by a static induction thyristor as a pulsed power supply[J].Food Control,2017,73:619-626.
[24] 罗建伟,李荣涛,陈兰,等.臭氧去除粮食中黄曲霉毒素B1的方法研究.粮食储藏,2003,32(4):29-33.
[25] 陈冉.花生中黄曲霉毒素降解技术研究[D].北京:中国农业科学院,2013:26-36.
[26] 莫紫梅,袁光蔚,陈宁周,等.黄曲霉毒素降解技术及其降解产物研究进展[J].食品研究与开发,2019 ,40(2):188-193.
[27] CHEN R,MA F,LI P W,et al.Effect of ozone on aflatoxins detoxification and nutritional quality of peanuts[J].Food Chem,2014,146:284-288.
[28] 梁俊平.氨氣熏蒸法降解花生及花生粕中黄曲霉毒素方法的研究[D].雅安:四川农业大学,2009.
[29] 陈志娟,刘阳,邢福国,等.氨气熏蒸降解玉米中黄曲霉毒素B1的条件优化[J].食品科学,2010,31(8):33-37.
[30] 赵国斌.氨气熏蒸法降解花生中的黄曲霉素B1[J].食品研究与开发,2014,35(3):111-113.
[31] 李秉鸿,李筠.去除饲料黄曲霉毒素的方法[J].中国饲料,1997(21):33-34.
[32] 梁丹丹.三种植物精油抑制玉米中黄曲霉生长及产毒研究[D].北京:中国农业科学院,2015.
[33] VERHEECKE C,LIBOZ T,MATHIEU F.Microbial degradation of aflatoxin B1:Current status and future advances[J].Int J Food Microbiol,2016,237:1-9.
[34] 李建辉.花生中黄曲霉毒素的影响因子及脱毒技术研究[D].北京:中国农业科学院,2009.
[35] HACKBART H C S,MACHADO A R,CHRIST-RIBEIRO A,et al.Reduction of aflatoxins by Rhizopus oryzae and Trichoderma reesei[J].Mycotoxin Res,2014,30(3):141-149.
[36] DELLAFIORA L,GALAVERNA G,REVERBERI M,et al.Degradation of aflatoxins by means of laccases from Trametes versicolor:An in silico insight[J].Toxins,2017,9(1):1-13.
[37] ZHOU Z M,LI R K,NG T B,et al.A new laccase of Lac 2 from the white rot fungus Cerrena unicolor 6884 and Lac 2-mediated degradation of aflatoxin B1.Toxins,2020,12(8):1-17.
[38] 张初署,孙杰,毕洁,等.食用菌SJ-1漆酶酶学性质及降解黄曲霉毒素B1的研究[J].核农学报,2017,31(7):1317-1322.
[39] 张学勤,李富强.霉菌毒素吸附剂的选择和应用[J].中国家禽,2007,29(24):47-48.
[40] 王宁,马秋刚,计成,等.黏细菌降解黄曲霉毒素B1的产酶条件优化[J].中国农业大学学报,2009,14(2):27-31.
[41] MWAKINYALI S E,MING Z,XIE H L,et al.Investigation and characterization of Myroides odoratimimus strain 3J2MO aflatoxin B1 degradation[J].J Agric Food Chem,2019,67(16):4595-4602.
[42] 张俊勇,徐素荣.黄曲霉毒素毒性及去毒措施[J].中国食物与营养,2001(5):47-48.
[43] 刘媛婷.霉菌毒素吸附剂对黄曲霉毒素B1吸附特性及效果研究[D].雅安:四川农业大学,2011.
[44] 张学勤,李富强.霉菌毒素吸附剂的选择和应用[J].中国家禽,2007,29(24):47-48.
[45] CHEN R,MA F,LI P W,et al.Effect of ozone on aflatoxins detoxification and nutritional quality of peanuts[J].Food Chem,2014,146:284-288.
[46] LUO X H,WANG R,WANG L,et al.Detoxification of aflatoxin in corn flour by ozone[J].J Sci Food Agric,2014,94(11):2253-2258.
[47] RUSHING B R,SELIM M I.Effect of dietary acids on the formation of aflatoxin B2a as a means to detoxify aflatoxin B1[J].Food Addit Contam:Part A,2016,33(9):1456-1467.
[48] RAO K R,VIPIN A V,HARIPRASAD P,et al.Biological detoxification of aflatoxin B1 by Bacillus licheniformis CFR1[J].Food Control,2017,71:234-241.
[49] 劉畅.益生菌对黄曲霉毒素B1吸附作用的研究[D].北京:中国农业科学院,2010.
[50] VIJAYANANDRAJ S,BRINDA R,KANNAN K,et al.Detoxification of aflatoxin B1 by an aqueous extract from leaves of Adhatoda vasica Nees[J].Microbiol Res,2014,169(4):294-300.

