基于风险管理的创新药支付准入案例分析及实施建议
刘 昭 张 帆 向贵圆 郭武栋 赵 琨, 刘跃华
(1 清华大学万科公共卫生与健康学院 北京 100084;2 国家卫生健康委卫生发展研究中心 北京 100191;3 国家卫生健康委国家药物和卫生技术综合评估中心 北京 100191;4 中国药科大学 江苏 南京 211198;5 首都医科大学国家医疗保障研究院 北京 100037)
近年来,我国新药审评审批速度不断加快,2017年国家药监局发布《关于鼓励药品创新实行优先审评审批的意见》,为创新药物的研发与上市创造了良好的政策环境。目前可实现进入专门审批通道的罕见病药品3 个月之内完成审评,其他临床急需药品6 个月之内完成审评,大大缩短了新药上市时间。与此同时,随着医保谈判常态化与医保目录动态调整,创新药进入医保目录的准入数量、准入速度都得到提升。创新药的快速上市和医保准入,在提高临床治疗能力、药品可及性、患者可负担性的同时,其高昂的价格也对医保支付标准的制定带来挑战。尤其当部分创新药品上市时间短、治疗附加效益尚不明确,或者患者亚组健康收益不确定时,支付方还将面临一系列财务或健康风险。本文将基于风险的定义及创新药特性,从不同角度分析创新药准入存在的风险,并分类梳理基于风险分担协议(Risk-Sharing Agreement, RSA)的风险管理案例,立足我国创新药上市和准入实情,提出RSA 应用层面的相关建议,以期为我国创新药准入决策提供参考。
1 创新药准入的风险分析
风险被认为是“对个人或公共利益产生不利影响事件的不确定性和损害程度的综合反映”,包含两个基本要素:不利后果与不确定性[1]。为减轻损失程度和降低不良事件概率,需要通过风险识别、风险评估、风险处置、风险沟通、风险监测与更新等环节来实现风险管理。创新药准入的风险包含3 个价值角度:一是临床价值角度,包括药品的疗效优势、安全性与副作用;二是经济价值角度,包括健康收益、成本效益、医保基金预算影响;三是社会价值角度,即患者用药的可及性与可支付性、对人群健康效益的影响等[2]。以下将从药品定价机制、信息不对称、药品供付双方三个角度,对创新药准入的风险展开分析。
从药品定价机制角度看,定价的基础应是患者用药后的实际疗效,但创新药往往只能提供临床试验效果,长期治疗效果存在不确定性,导致定价不合理的风险。通常这种不确定性带来的风险应该由保险人、患者(被保险人)、医疗提供者以及药物生产者共同承担。但在传统药物定价机制中,这种风险仅仅由保险人、被保险人以及医疗提供者分担,药厂则事先接受固定价格,不用承担事后药品医疗质量结果保证风险[3]。
从信息不对称角度看,由于创新药的特殊性,政府或保险机构对药品的安全性、有效性等质量信息,药品研发、生产、销售的真实成本及厂商可接受价格难以得知。此外,创新药的临床试验样本量通常有限,临床疗效与安全性证据仍有待上市后研究和真实世界数据加以补充完善。因此,支付方对于将创新药物纳入医保报销往往十分谨慎:如果临床实践证明新药效果不如预期,而保险机构却制定了较高的支付价格,则可能引发医保基金财务风险;如果临床实践证明新药效果符合甚至高于预期,而保险机构为控制预算拒绝补偿,或制定的支付价格过低致使厂商退出药品市场,则可能影响药品可及性,导致患者健康受损[4]。
从药品供付双方看,药品供方的风险主要表现为支付方提供的总费用无法负担总投入,支付方的风险则主要表现为支付的总费用高于药品带来的总健康收益。国外药企开发单个新药的平均成本在8 亿美元以上[5],而支付方通常不参与预先分担创新成本,因此在创新药上市早期,药企承担着巨大的资金压力和风险。此外,药品在不同国家上市后,相关知识产权和专利能否得到法律的充分保护,是否有竞品、仿制药搭便车,是否有与订单相适应的生产能力等,也都是药企需要考虑和应对的问题。而对于支付方,创新药入市以后,为尽快提高可及性,支付方可能会将真实世界证据不足、长期效果未知的药品纳入支付范围,因此存在为创新药支付的增量价格高于最终获得的增量效果的风险。同时,由于预算有限,如果实际用药人数远多于预估人数,创新药高昂的价格可能造成预算超支、医保基金穿底。这两种风险的存在都可能削弱健康公平,影响群体健康收益最大化。
2 基于风险分担协议的风险管理案例
风险分担在卫生政策研究领域尚属较新的概念[1,3,5],不同文献使用了不同术语、定义和分类法对这些协议进行区分归类[1-3,5,7,8]。本文参考国际卫生技术评估协会(Health Technology Assessment international, HTAi)[3,8]对RSA的定义,即生产者/制造商和付款人/提供者之间的协议,允许在特定条件下获得(覆盖/补偿)卫生技术。这类协议通过限定付款条件或增设附加服务等方式,应对技术性能的不确定性,最大限度地提高其有效利用率或控制预算影响。根据协议双方分担的风险内容的不同,可将RSA 分成3 类(见图1)。
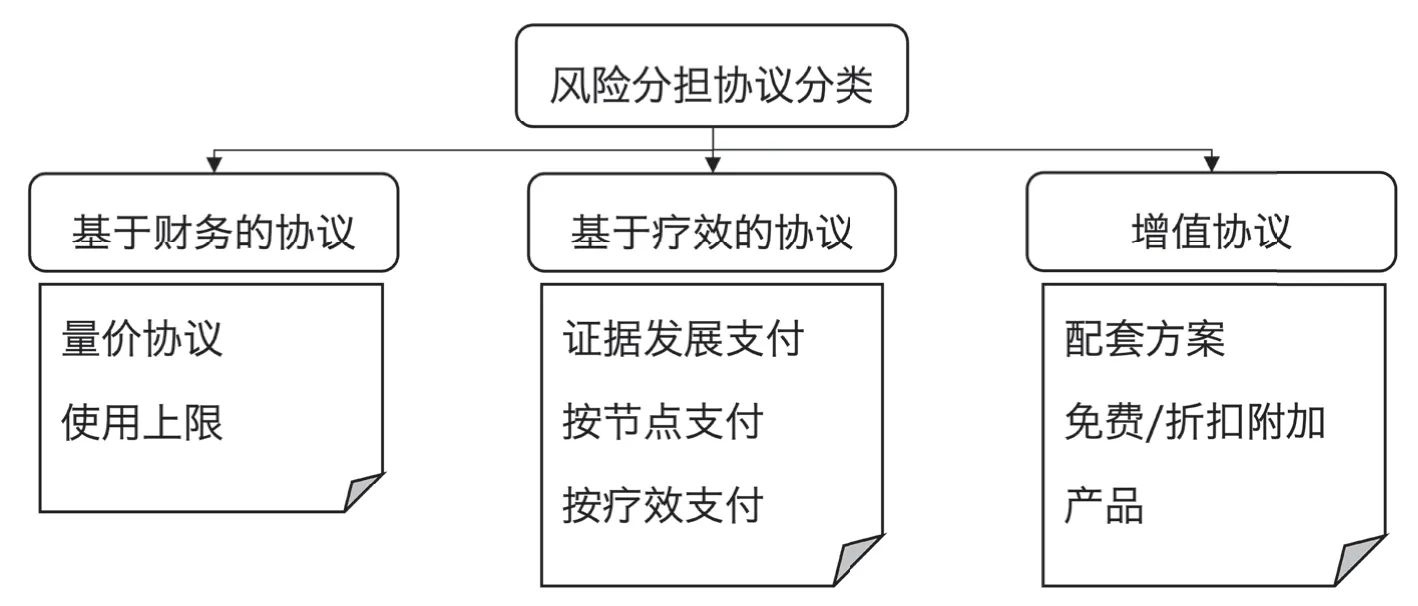
图1 风险分担协议分类
2.1 基于财务的协议 (Financial-Based Agreements)
协议双方分摊基金预算风险,包括量价协议(Price-Volume Agreements) 和使用上限协议(Utilization Caps)。量价协议中,药品供付双方事先预估患者人数,并基于其市场容量进行价格磋商,支付价格与预期销量挂钩,即以量换价;若超过约定的销量上限,药厂需降低销售价格或归还部分销售额。使用上限协议则需双方提前约定好支付总额、治疗剂量或疗程、患者数量的上限,实践过程中超过的部分通常由药厂承担。
丙肝的直接抗病毒药物(Direct-Acting Antiviral Agents, DAAs)能够通过直接抑制HCV 蛋白酶、RNA 聚合酶或病毒的其他位点来清除HCV,减轻或清除肝损害,相较于传统方案,疗程时间显著缩短且治愈率大幅提高。2014年,DAAs 在澳大利亚上市,2016年DAAs 被纳入药品福利计划(Pharmaceutical Benefits Scheme, PBS)时,澳大利亚政府与制药公司达成如下协议:5年内支付10 亿澳元,用以覆盖所有丙肝患者DAAs 的用药需求,期间药品按需供应(10 亿澳元既是保底预算,又是总预算),该模式也称“Netflix”[6]。这是基于财务的风险分担协议的一种特殊形式,其实质为供付双方对几年内患者需求和药品价格有一定的预测,进而达成协议,供方能够获得可控、定量的回报,支付方也能够避免预算超支。
2007年开始,匈牙利政府针对部分安全性、有效性明确的药物,与药品供方展开磋商,并签订了一系列基于财务的协议。协议主要内容有:支付方与供方首先约定报销价格和预算上限,将药品费用纳入报销范围;若该药年销售额未超过预算上限,则供方年底将其年报销额度的12%返给政府;若预算不足,供方还须按照商定的方案支付额外费用,其中超支9%以内的部分由政府和供方共同承担(供方支付比例较高),超支9%以上的部分全部由供方承担。该协议对药品费用进行分段管理,能够将预算支出控制在109%的风险范围内[7]。
2.2 基于疗效的协议 (Performance-Based Agreements)
协议双方分担健康结果风险,包括证据发展支付(Coverage with Evidence Development,CED)、按节点支付(Conditional Treatment Continuation, CTC)和按疗效支付(Performance Linked Reimbursement,PLR)。证据发展支付可用于现有临床证据不足而患者急需的创新药,支付方先按照药厂设定的价格支付一段时间,预定时间结束后,根据收集的证据决定支付是否继续/增加/取消。按节点支付可用于长期效果不明确的创新药,协议双方一般约定1 个或多个治疗目标(即节点),通常为替代终点、生物标志物等;药厂则在初始治疗阶段提供折扣/免费药品,一旦达到治疗目标,支付者将继续为患者提供补偿。按疗效支付可用于临床证据较充分,但真实世界应用结果尚不明确的药品,药厂承诺药品的长期治疗效果,支付方据此设定支付价格,并限定支付时间;若药品最终未能达到预期结果,药厂需还款、退款或降价,结果指标可以是替代终点或生物标志物、长期临床数据、治疗依从性指标等。
Kymrial 是一种新型细胞疗法,基于嵌合抗原受体T 细胞(Chimeric Antigen Receptor T cell,CAR-T)治疗原理,在急性白血病和非霍奇金淋巴瘤治疗上有着显著的疗效。2018年,Kymrial 关键性临床试验ELIANA 显示:79 名受试者24 个月内,83%的患者出现完全缓解或完全缓解伴血细胞计数恢复不全;大部分患者显示出明显和持久的疗效。然而作为一项单臂Ⅱ期临床试验,ELIANA 所覆盖的患者人群、追溯的治疗时间,以及提供的证据质量都十分有限。如果直接纳入支付范畴,支付方为价值不足的治疗付费的风险极高。因此美国医疗保险和医疗补助服务中心(Centers for Medicare and Medicaid Services,CMS)虽然同意将该疗法纳入支付范畴,同时也与供方达成“按节点支付”的协议,即只为在治疗第一个月内见效的患者支付治疗费用,其中患者自付20%,其余全部由CMS 承担[8]。这一协议,使支付方只为有健康收益的治疗付费,以确保医保资金的使用效率。
Gliptins 是一种二肽基肽酶-4(DPP4)抑制剂型口服降糖新药,有实验数据表明,Gliptins 较二甲双胍表现出更好的耐受性,降低HbA1c①HbA1c:糖化血红蛋白的核心组成部分,能够有效地反映糖尿病患者过去1~2 个月内血糖控制的情况,是糖尿病控制的重要监测指标。的效果持续时间也更长;由于二者机制互补,该药现阶段多与二甲双胍联用,能够进一步降低HbA1c 水平。该药在2016年进入法国市场时,法国卫生产品经济委员会(France's Health Care Products Economic Committee, CEPS) 只同意提供较低的溢价[9,10],其后供方说服了支付方进行一项大规模的真实世界研究,以证明Gliptins 在提高患者耐受性和延缓疾病进展方面的作用。CEPS 最终认可了更高的价格,同时约定了按疗效支付的协议:如果研究不支持供方提供的效果保证,供方需要偿还所有销售价格和初始价格之间的差额。这一协议符合按价值付费的内涵,显示出支付方对新药价值的认可和对创新的支持;同时也将药品真实世界应用的健康结果不确定风险控制在一定范围内。
Repatha 和Praluent 均 为PCSK9 抑制剂。临床证据显示,这两种药都能显著降低血液中低密度脂蛋白及胆固醇的浓度,该作用提示:Repatha 和Praluent 具有预防心血管疾病的重要潜力;然而尚缺乏临床或真实世界证据,直接说明这两种药物在降低心脏病发作、中风和其他心血管疾病方面的实际保护效果。美国信诺保险集团(Cigna)与药商达成按疗效支付的协议,以协议价格为旗下适应症患者支付Repatha 或Praluent 的费用,同时跟踪患者收集真实世界证据,研究患者是否正在获得收益:如果药品长期使用仍能显著降低血液中低密度脂蛋白及胆固醇的浓度,那么协议价格不变;如果不能,则按照约定调低价格,增加折扣。Cigna 认为如果药物发挥预期作用,那么保险公司理论上可以在未来的心血管并发症上节省资金,从而使Cigna 在药物投资上获得回报[11]。该协议体现了患者健康综合管理的思路,分析患者长期健康指标与疾病控制/系统、器官功能的关系,构建关键指标-健康效果-支付价格的联动机制,不仅能够回避药品长期健康收益低于预期的风险,还能促进患者疾病控制,提高整体干预水平,降低医疗总费用。
2.3 增值协议(Value-Added Agreements)
协议双方分摊药品应用相关费用风险,包括配套方案(Supporting Programs)和免费/折扣附加产品(Free/Discount Add-ons)。配套方案中,药厂需提供教育、培训、物流支持等服务,辅助医生或医疗机构进行患者管理,以确保患者获得最佳治疗。免费/折扣附加产品中,药厂需免费提供药品相关附加产品,或给予一定折扣,这些产品一般为辅助诊断技术或辅助药品等,具备提高药品治疗效果等支持作用。
对肿瘤靶向药的伴随诊断(Companion Diagnostics,CDx)技术进行支付也适用于增值协议的思路。肿瘤靶向药的合理使用需要明确对应的基因型靶点,CDx 是判断适宜人群的前提条件。澳大利亚政府针对CDx 的支付策略为:CDx 通过审批上市后两年内由供方免费提供,支付方根据两年的应用结果判断是否纳入支付范围,纳入以后由政府承担后续费用。我国台湾健保目录将部分靶向药连同CDx 技术一并纳入,相关费用由提供靶向药的制药公司承担[12]。
2.4 小结
从Ⅲ期临床试验、获准上市,到上市后使用及再评价,创新药在生命周期的不同阶段面临不同的风险点,针对复杂多变的真实世界应用场景,灵活的RSA 可组合使用,规避复合风险。现阶段不少Ⅱ期临床试验结果或仅有单臂试验结果的药品获批上市,安全有效性证据尚不充足情况下纳入支付报销,可采用证据发展类支付协议,一方面加快创新药(临床试验前期表现优异)的支付准入,提高药品可及性。另一方面收集真实世界临床使用数据,支持药品中长期定价。另外,对于单次治疗费用高昂、同时潜在健康收益极大的创新药,还可采用按节点支付,分散多时间节点评估疗效后支付,缓解支付压力,同时规避为无效治疗付费风险。对于已上市且完成Ⅲ期临床试验、但长期效果尚不明确的药品,若直接纳入支付并广泛应用于患者群体,存在真实世界应用效果及群体收益低于临床试验结果的风险,可通过按疗效支付,减轻财务风险,同时确保患者群体健康收益。对于已上市一段时间、疗效明确、同类产品较多的药品,可采用基于财务的协议,量价挂钩控制总费用。增值协议可适于药品上市后的多个阶段控制附加风险。RSA 应用特点与产品周期关系如图2所示。
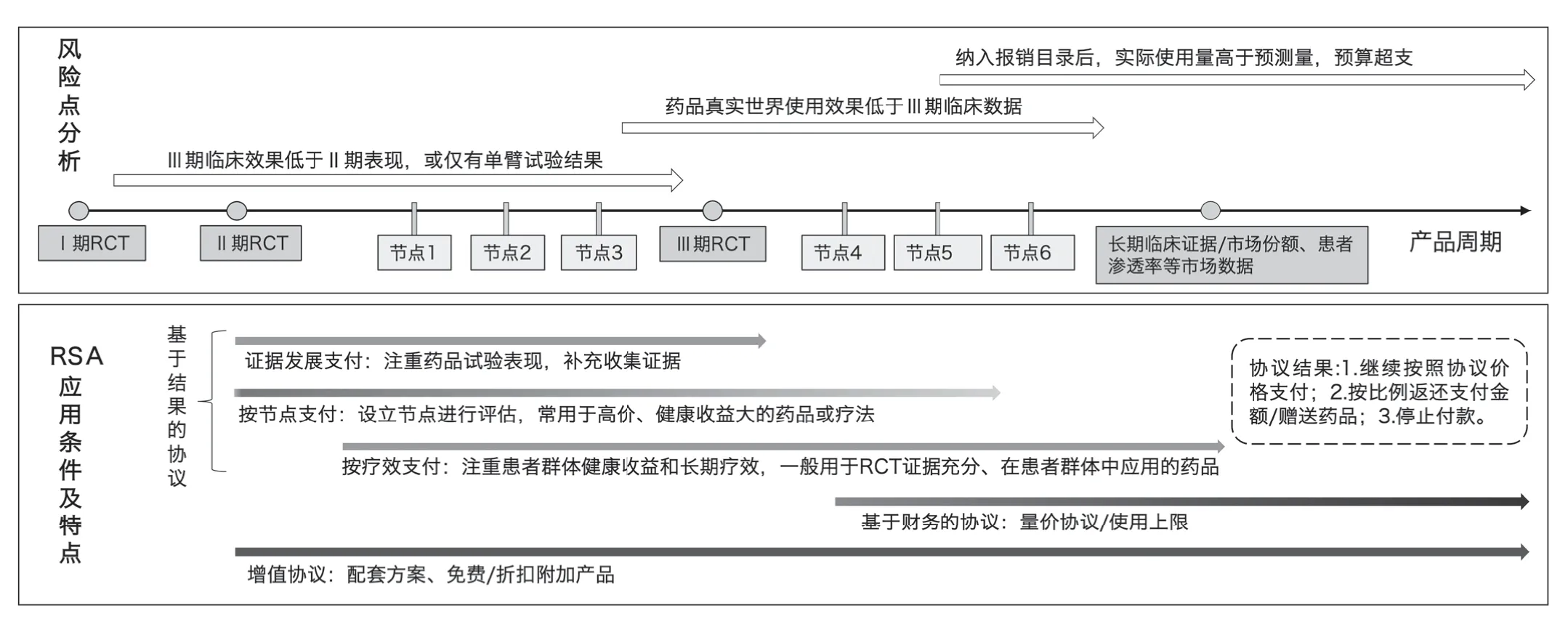
图2 RSA 应用特点与产品周期关系示意图
3 我国创新药准入风险管理的相关建议
3.1 探索RSA 在我国创新药准入方面的应用
在我国,RSA 的应用实践有限,目前仅在商业健康险范围内,针对部分高价药品(抗肿瘤药、罕见病用药等)进行了一些探索;而患者就医费用的主要分担方—基本医疗保险,受限于筹资支付机制及数据可获得性等问题,尚未展开应用探索。全球范围内,基于财务的协议应用范围较为广泛,在发达国家、地区有着十年以上的应用经验,能够加快药品准入、减轻患者负担,并较好地控制医保基金预算。同时,这类协议对真实世界数据收集整合水平及相关配套执行要求较低,可作为医保部门与药品生产商增强协作、提高基金利用效率的早期探索方案。
据此,建议探索RSA 在我国创新药准入方面的应用:设计适宜我国国情的风险分担与结算机制,以创新药为切入点,提高医保基金统筹层次和测算水平,使基金支付方能够实时监测创新药使用情况,精准控制基金消耗。同时基于不断提升的信息化水平,构建支付方与药品生产商的沟通协作平台、制度,也使药品生产商能够及时获得反馈,调整产能配给,提高市场运行效率。通过率先引入基于财务的协议,药品供付双方可以积累风险分担经验,建立完善配套机制,提高真实世界数据收集、分析、运用水平,进而基于不同创新药的风险类型,尝试灵活多样的RSA 组合,进一步提高风险分担水平,为实现风险的科学、长期、有效控制奠定基础。
3.2 依托试点医院开展创新药上市后再评价
准确完善的创新药长期临床效果数据是开展基于疗效的协议的基础,也是控制健康收益风险的前提。建议加强医疗、医药、医保协作,让药品供付双方都能参与药品使用过程,签订基于证据的按疗效支付协议,双方共担健康结果风险。实践中,需要构建能够全面、准确地收集、测量、评价、汇总数据的信息支撑体系,同时配备具有专业水平的医疗团队,优化实施环境,指导患者诊疗用药过程。建议在充分考虑数据来源的广泛性和代表性的基础上,遴选相关基础设施完备、医疗科研水平较高的医院纳入试点工作,针对临床急需但证据不足的创新药,可在判断是否纳入医保目录前,先在试点医院中应用并持续收集药品真实世界使用结果,明确其在临床应用中的安全性、有效性、适宜性、经济性等,并做出科学的评估与建议,实践创新药上市后再评价,并根据评价结果确定是否纳入国家目录及支付条件;同时积累RSA 应用经验,扩大应用水平。
3.3 构建基于HTA 的创新药价值评价体系
创新药涉及疾病种类众多,单纯依靠临床试验结果、真实世界证据等,难以进行不同病种之间药品的价值比较,在有限的医保基金预算下,不利于推动全民健康事业的发展。此外,部分创新药因适用于多种疾病,其价值也难以通过现有的临床试验规则充分体现。因此,构建能够全面体现创新药价值、定义清晰、且利益相关者均能认可的价值评价体系,联动形成正向激励的支付方式(进入医保报销目录、提高报销比例、扩大报销范围等),对于RSA 的签订也有着重要意义。
国际经验表明,卫生技术评估(Health Technology Assessment, HTA)工具能够科学整合信息,综合判断卫生技术价值,提供有助于政府决策的证据集合。近年来,我国不断拓展HTA在医保目录遴选、价格谈判准入等方面的应用,药物经济学证据成为高价值创新药支付的重要依据。建议利用HTA 工具,构建创新药价值评价体系,推动资源合理化配置,提高医保基金使用效率,在预算范围内将更多高价值创新药纳入报销目录。同时,建议完善HTA体系,鼓励第三方HTA 机构发展,明确评价主体、评价标准、评价技术要求、评价结果转移转化等关键问题,提高评价结果的客观性和规范性,形成科学的创新药价值判断结果,助力支付风险管理。

