36例小脑转移瘤外科治疗及预后因素分析
周长帅,杨越超,崔欢欢,陈 磊,陈 鑫,郝 斌,童 彤,曹依群
1.复旦大学附属肿瘤医院神经外科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
小脑转移瘤占脑转移瘤的15% ~ 20%[1-2],因后颅窝体积小,小脑转移瘤可导致梗阻性脑积水而危及患者生命,预后较幕上转移瘤更差。外科手术切除肿瘤可有效解除颅内高压,预防脑积水,并为后续的综合治疗创造条件,从而延长患者的生存期。为探索小脑转移瘤患者术后影响生存的相关因素,本研究回顾性分析了2016年1月—2020年10月于复旦大学附属肿瘤医院神经外科住院的36例小脑转移瘤患者的临床资料和病理学特点。
1 材料和方法
1.1 病例资料
收集2016年1月—2020年10月,在复旦大学附属肿瘤医院神经外科住院接受手术治疗,且手术后经病理学检查证实为脑转移瘤的患者共287例,其中行小脑转移瘤切除手术的患者共计41例。排除5例(小脑囊性病灶行欧玛亚囊植入2例,病理学诊断结果为坏死1例,失访2例),共36例小脑转移瘤的患者纳入本研究。收集分析患者的年龄、性别、临床症状、功能状态(Karnofsky Performance Status,KPS)评分、颅外转移情况、肿瘤大小、肿瘤个数、肿瘤周围水肿、病理学诊断结果及术前、术后的治疗情况。
1.2 影像学资料
收集患者术前1周内颅脑磁共振成像(magnetic resonance imaging,MRI)平扫+增强资料,由一名放射诊断科专科医师和1名神经外科副主任医师共同读片,评估肿瘤的个数、直径、瘤周水肿。使用水肿指数(edema index,EI)值评估瘤周的水肿情况,EI值是指T1增强相位上水肿与肿瘤冠状位、矢状位、轴位的最长径的乘积的比值。其中EI值1.0 ~ 1.5认定为轻度水肿,EI值1.5 ~ 2.0不伴有脑积水为中度水肿,EI值2.0以上伴有脑积水为重度水肿[3]。患者术前2周内完善肺部增强CT、全身骨扫描、腹部增强CT、腹部B超或全身正电子发射计算机体层成像(positron emission tomography and computed tomography,PET/CT)检查,评估患者全身转移情况。局限于原发脏器或周围淋巴结的认定为无颅外转移,合并器官远处淋巴结或脑以外的其他脏器转移认定为颅外转移。术后72 h内采用颅脑增强MRI评估肿瘤切除程度。
1.3 纳入及排除标准
手术指征:① 单发的小脑转移瘤,有无症状,预期手术可获益。② 多发病灶,但小脑病灶体积大或有明显脑水肿,导致临床症状。③ 巨大囊性病灶的小脑转移瘤,放射治疗效果差。④ 合并小脑转移瘤出血。排除指征:① 弥漫多发且无明显占位效应的小脑转移瘤。 ② 小脑转移瘤位置深在,累及脑干。③ 无明显占位效应,且术前病理学检查证实的小细胞肺癌或其他放化疗敏感肿瘤。④ 仅做了欧马亚囊植入,无病理学检查结果,或病理学检查结果提示为坏死。⑤ 失访患者。
1.4 随访
术后每1 ~ 2个月进行随访,随访方式为电话随访结合门诊随访。末次随访时间为2021年10月30日,中位随访时间为14个月。经病理学检查确诊为小脑转移瘤患者共38例,其中失访患者2例,失访率为5.26%。生存时间是从手术之日(若两次手术则按照第一次手术的日期)至最后一次随访评估的日期或死亡日期。
1.5 统计学处理
采用R语言软件进行统计分析作图,采用Kaplan-Meier法对每个临床因素的不同水平进行生存分析。对单因素生存分析有统计学意义的变量,采用Cox风险比例模型进行多因素生存分析。P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
本组患者中,男性20例(55.56%),女性16例(44.44%),年龄(58.75±8.99)岁。中位生存期为(14.25±9.64)个月,均在访;死亡患者22例。原发肿瘤与脑转移瘤同时发现14例(38.89%),原发肿瘤治疗后进展22例(61.11%)。临床症状上表现为头痛、头晕17例(47.22%),恶心13例(36.11%),伴呕吐11例(30.56%),术前伴有行路不稳等 11 例(30.56%),无症状查体发现5例(13.89%)。
结合术后病理学检查结果及临床资料,36例患者中肺癌脑转移19例:肺腺癌13例,小细胞肺癌6例,其中间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)阳性2例,表皮生长因子受体(epidermal growth factor receptor,EGFR)阳性6例;乳腺癌转移7例,其中人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性4例,三阴性2例,雌激素受体(estrogen receptor,ER)阳性1例;肠癌转移4例,恶性黑色素瘤转移2例,胰腺癌转移1例,肾癌转移1例,卵巢癌转移1例,输卵管癌转移1例(表 1)。
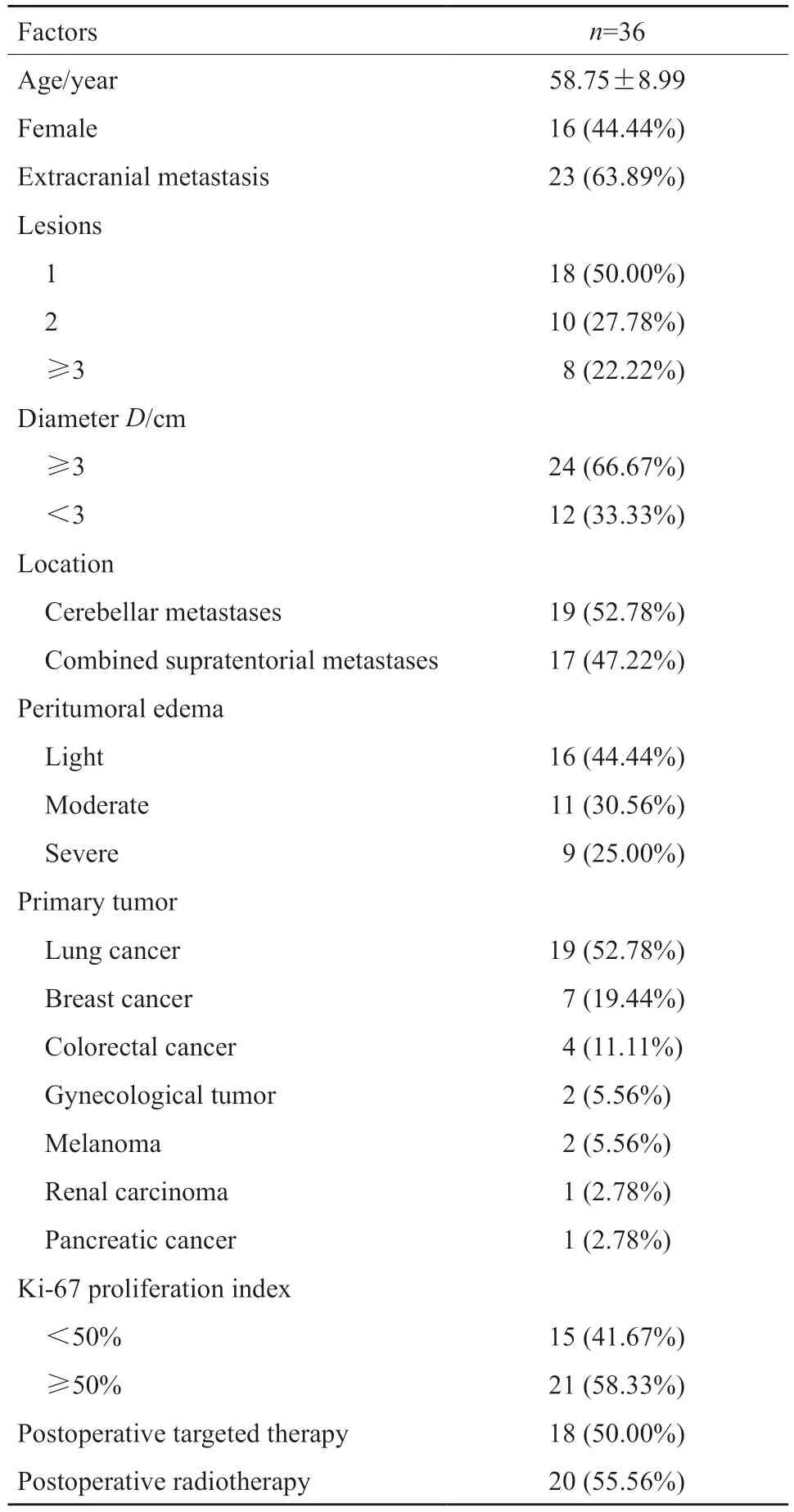
表1 36例小脑转移瘤患者临床病理学特征Tab.1 Clinicopathological features of 36 patients with cerebellar metastases
2.2 影像学特点
患者术前1周内颅脑增强MRI提示:36例患者中仅小脑有单发病灶18例,颅内2个病灶10例(1例为幕下两个病灶,9例为幕上和幕下各一个病灶),颅内3个及以上病灶的8例。局限于幕下19例,合并幕上17例。肿瘤出血4例。肿瘤大小:24例肿瘤直径≥3 cm,12例肿瘤直径<3 cm。根据EI值结合脑积水情况分析,瘤周轻度水肿16例,中度水肿11例,重度水肿9例。
2.3 治疗方式及术后并发症
36例脑转移瘤患者中,局限于小脑的单发病灶有18例患者,其中16例采取小脑肿瘤全切(图1),2例采取部分切除;含两个病灶的10例患者中,5例患者分次手术切除幕上、幕下病灶,1例患者一次切除小脑两个病灶,其余4例患者仅全切小脑责任病灶;3个病灶及以上的患者仅全切小脑的责任病灶。瘤周中度、重度水肿的20例患者切除小脑肿瘤后均给予去除骨瓣减压。术后脑部放疗20例,术后靶向治疗18例,其中抗EGFR治疗6例,抗ALK治疗2例,抗HER2治疗4例,抗血管内皮生长因子(vascular endothelial growth factor,VEGF)治疗5例,其他1例。术后皮下积液1例,术后颅内感染1例,余未见其他并发症。
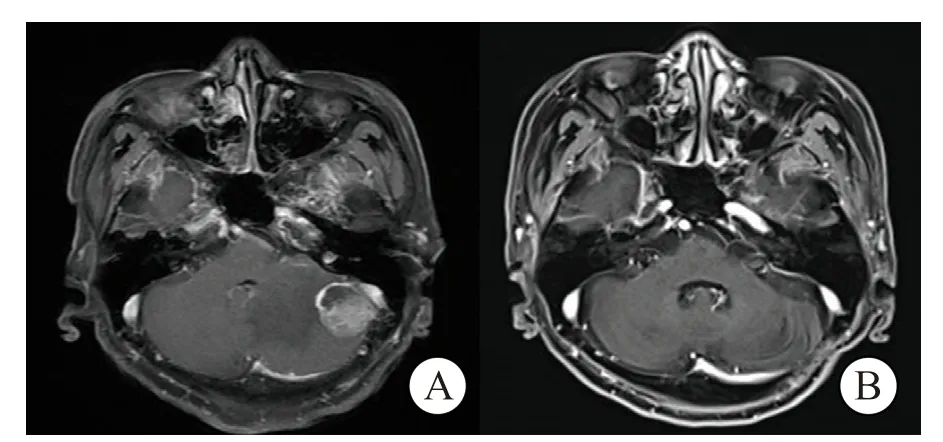
图1 左侧小脑转移瘤 Fig.1 Left cerebellar metastasis
2.4 术后生存期及影响因素
36例小脑转移瘤患者外科手术后的中位生存期为(14.25±9.64)个月。19例肺癌小脑转移患者术后的中位生存期为(14.3±11.4)个月,其中小细胞肺癌平均生存期为8.5个月,肺腺癌平均生存期为17.0个月;7例乳腺癌小脑转移患者平均生存期为15.4个月;肠癌小脑转移瘤平均生存期为15.3个月;黑色素瘤小脑转移患者2例,平均生存期为4.5个月;卵巢癌小脑转移患者1例,随访12.0个月,存活;输卵管癌小脑转移患者1例,随访23.0个月,存活。胰腺癌小脑转移患者1例,生存期13.0个月,死亡。肾癌小脑转移患者1例,随访15.0个月,存活(表1)。
单因素Cox回归分析提示,对于小脑转移瘤术后预后影响的因素有:病灶≥3个(P=0.008),术后辅助放疗(P=0.004),术后靶向治疗(P=0.022),Ki-67增殖指数≥50%(P=0.017)。其中病灶≥3个、Ki-67增殖指数≥50%提示小脑转移瘤患者术后预后较差,术后辅助放疗、术后靶向治疗有助于延长患者的术后生存期。多因素Cox分析提示Ki-67增殖指数≥50%是小脑转移瘤术后的独立危险因素(P=0.039);而术后靶向治疗(P=0.006)、术后辅助放疗(P<0.001)是小脑转移瘤切除手术后的独立的保护性因素(表2,图2)。小脑转移瘤的瘤周水肿程度的Kaplan-Meier生存分析见图 3。
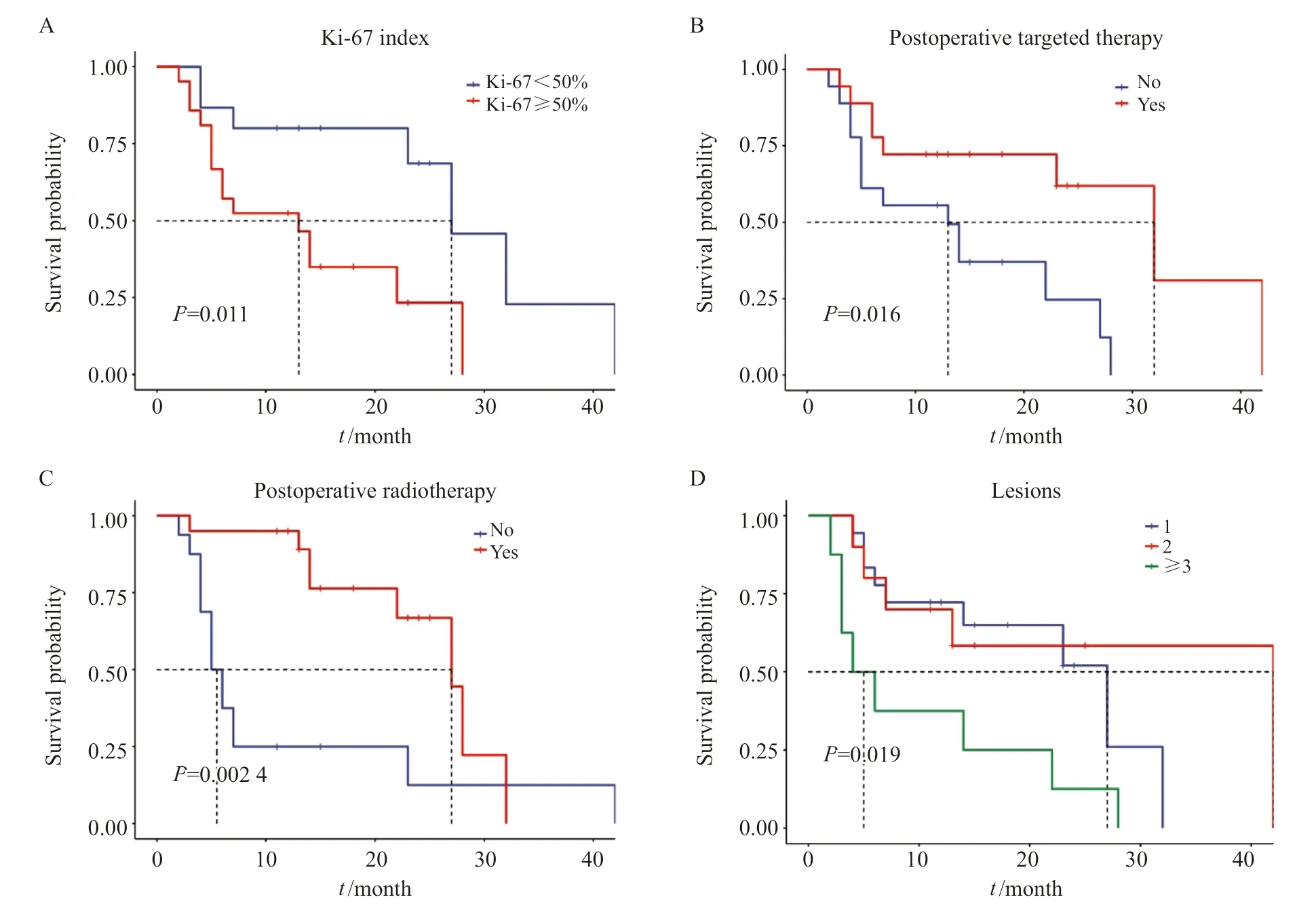
图2 小脑转移瘤术后预后因素的Kaplan-Meier生存分析 Fig.2 Kaplan-Meier survival analysis of prognostic factors after cerebellar metastases resection
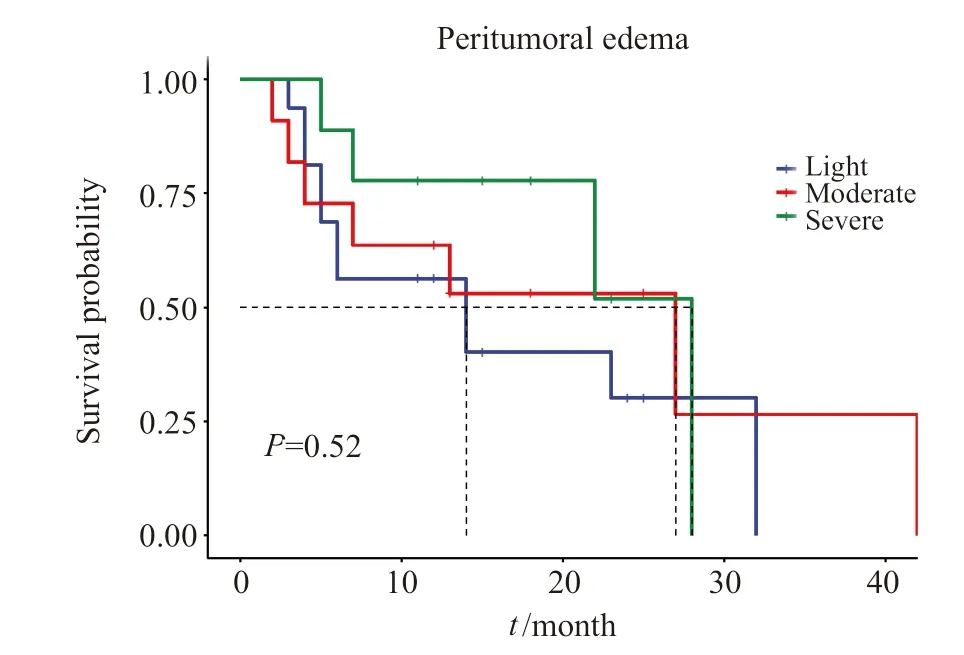
图3 小脑转移瘤的瘤周水肿程度的Kaplan-Meier生存分析Fig.3 Kaplan-Meier survival analysis of peritumoral edema of cerebellar metastases
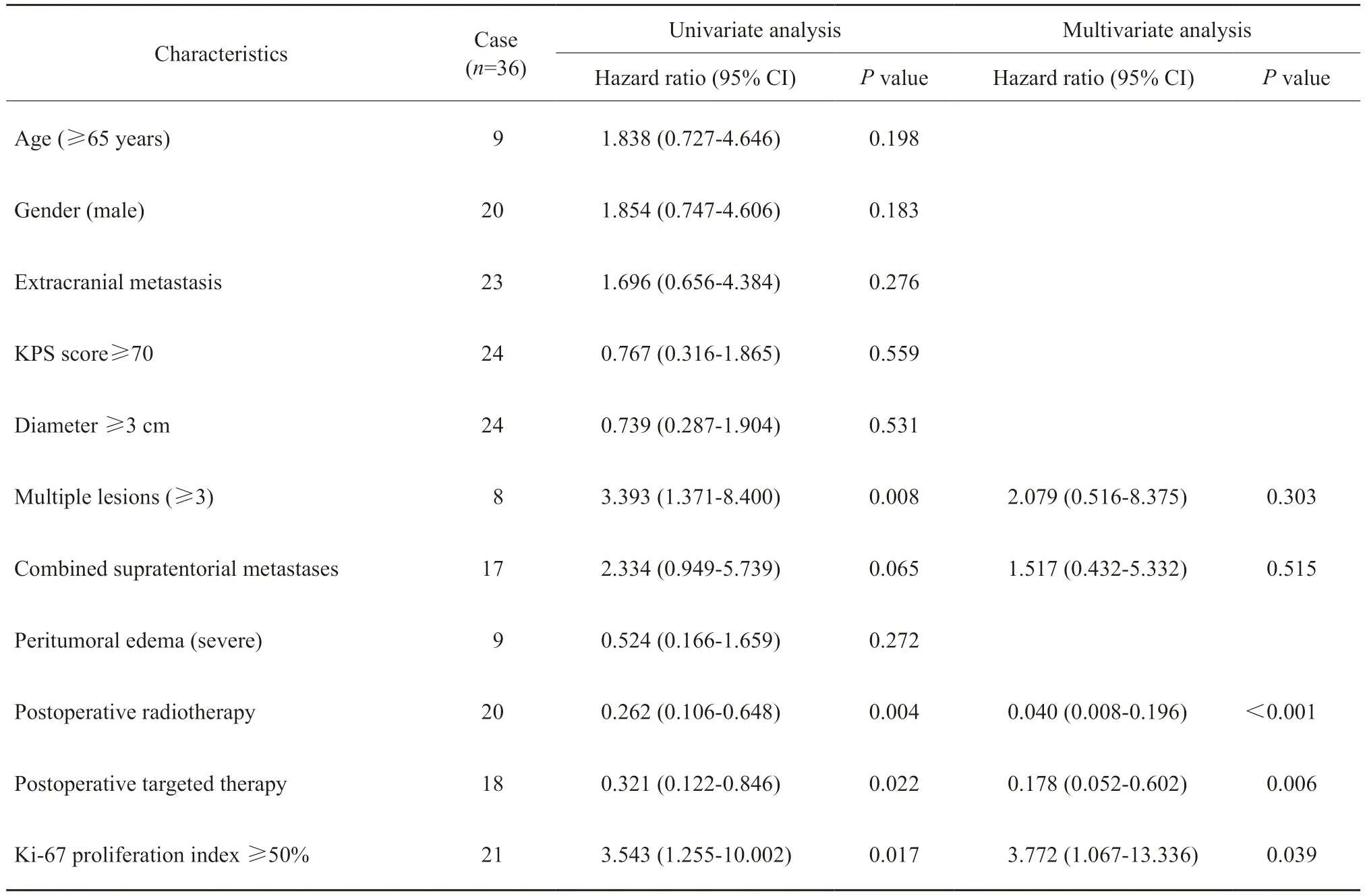
表2 36例小脑转移瘤预后因素的单因素及多因素Cox回归分析Tab.2 Univariate and multivariate Cox regression analysis of 36 cases of cerebellar metastases
3 讨 论
临床上,小脑转移瘤有发病急、进展快、预后差等特点,尤其是转移瘤周围水肿加重或卒中,可导致急性梗阻性脑积水,诱发脑疝危及患者生命。外科手术切除小脑转移瘤,可快速缓解颅内高压,挽救患者生命及提高患者的生活质量。本研究中,5例患者术后的KPS评分较术前明显提高,显著改善了患者生活质量。临床症状上,与幕上转移瘤相比,头痛等颅内高压症状和行走不稳等共济失调的症状发生率较幕上转移瘤高,而癫痫的发生率较幕上的转移瘤低[1,4]。本研究的36例小脑转移瘤患者中,头痛、头晕等非特异性症状以及行走不稳等共济失调症状发生率分别为47.22%和30.56%。
脑转移瘤患者术后的影响因素对手术适应证的选择非常重要。而脑转移瘤的预后评价体系,随着对脑转移瘤的认识和诊疗技术的提高,也在不断变化[5]。脑转移瘤患者中递归划分分级(recursive partitioning analysis,RPA)Ⅰ级(KPS评分≥70分,<65岁,原发肿瘤控制良好,无颅外转移)的患者中位生存期为7个月,分级预后评估(Graded Prognostic Assessment,GPA)评分3.5 ~ 4.0分(KPS评分90 ~ 100分、<50岁、脑转移瘤个数1个、无颅外转移)患者的中位生存期为14.8个月,而在肺腺癌脑转移的GPA 评分3.5 ~ 4.0分(KPS评分90 ~ 100分、无颅外转移、EGFR或ALK阳性)患者的中位生存期可达 46.8个月[6-8]。
而关于小脑转移瘤术后影响因素的临床研究相对较少。Chaichana等[4]在一项140例小脑转移瘤的临床研究中发现,小脑转移瘤术后患者的中位生存期为较幕上脑转移瘤患者术后生存期稍短,但差异无统计学意义(8.2个月vs9.9个月,P=0.11),颅内肿瘤病灶数目(≤3个)、肿瘤体积(直径≤3 cm)、术后放疗是小脑转移瘤切除术后的独立保护性因素。李建峰等[9]在一项37例小脑转移瘤切除术后的研究中发现,术前颅外转移是小脑转移瘤术后的独立危险因素,而术后辅助放化疗是独立的保护性因素。本研究结果显示,肿瘤个数≥3个是预后不良因素(P=0.019),术后放疗、靶向治疗治疗有助于延长患者的生存期(P=0.016,P=0.002),肿瘤直径≥3 cm无明显的预后提示意义,这可能与入组的患者中大部分给予肿瘤全切有关。本研究结果显示,3个或以上的肿瘤切除预后相较于单发肿瘤的手术预后明显较差,可能与颅内肿瘤无法全切有关。
多发脑转移瘤是否建议手术治疗存在一定的争议。Schacker等[10]在一项127例的多发脑转移瘤外科手术研究发现,脑转移瘤肿瘤数目<4个、肿瘤全切、术后全脑放疗是患者预后好的独立预测因素。而在本研究中,含两个转移灶的10例患者中,有6例患者进行了一期或者分期手术给予颅内转移瘤全切。而生存分析提示单发病灶与两个病灶的患者预后明显优于≥3个病灶患者的预后(P=0.019)。周先申等[11]在一项31例多发脑转移瘤切除手术的研究发现,年龄<60岁、肿瘤数目2 ~ 3个、术前 KPS 评分>70分的患者可积极考虑手术,术后行辅助治疗可提高多发脑转移瘤的预后。对于KPS评分高的脑内寡转移患者,可考虑给予单个或多个转移瘤病灶的全切除。
此外,本研究还发现高Ki-67增殖指数组(≥50%)的患者预后较低Ki-67增殖指数组的患者差(P=0.011),与既往研究[12]报道一致,高Ki-67增殖指数组的乳腺癌脑转移患者的预后较差。而肺癌中Ki-67增殖指数≥30%被认为是发生脑转移的高危风险因素之一[13],Ki-67增殖指数>40%是非小细胞肺癌脑转移瘤患者预后不良的独立预测因素[14]。因此,对于高Ki-67增殖指数的脑转移瘤患者需要更加密切的随访,尽早行术后辅助治疗。
严重的脑水肿被认为可能是脑转移瘤预后不良的因素之一[15],但本研究中,轻、中、重度瘤周水肿患者的预后差异无统计学意义(P=0.52)。原因可能一方面与手术方式有关,对于中、重度水肿的20例小脑转移瘤,我们在切除小脑肿瘤后,给予去除骨瓣减压并打开枕骨大孔,以预防严重的术后并发症。另一方面,在重度水肿的9例患者中,有5例患者术后给予安罗替尼、贝伐珠单抗缓解水肿治疗,有效地缓解术区的水肿。
术后放疗、靶向治疗可以改善小脑转移瘤患者手术后的生存期。术后放疗可以延长患者的生存期,并延长颅内病灶的复发时间,但全脑放疗会增加认知损伤[16]。故对于颅脑寡转移的患者,立体定向放射治疗可以提高颅内肿瘤控制率,也可降低认知损伤的发生率[17]。而对于弥漫多发的脑转移瘤,更加推荐全脑的放疗。
靶向治疗已逐渐成为驱动基因阳性的脑转移性肿瘤的主要治疗方式。其中肺腺癌EGFR、ALK阳性的患者,靶向药物对于颅内转移病灶有一定的治疗效果,而对于K-ras突变的肺癌脑转移尚无有效的靶向药物[1,18-19]。对于EGFR阳性的脑转移瘤患者,三代药物奥西替尼已经成为一线治疗的药物。而对于ALK阳性的患者,阿来替尼也有优于克唑替尼的颅内肿瘤控制率及更长的生存获益[20-21]。对于乳腺癌脑转移患者来说,曲妥珠单抗因相对分子量大、透过血脑屏障能力差等原因,对于乳腺癌脑转移瘤的治疗效果不佳。而鞘内注射曲妥珠单抗治疗HER2阳性乳腺癌脑转移瘤较静脉用药有更好的颅内肿瘤控制率,曲妥珠单抗-美坦新偶联物(T-DM1)治疗HER2阳性乳腺癌脑转移是一种可以尝试的治疗方法[22-23]。而对于三阴性乳腺癌脑转移目前仍无明显有效的治疗方法[24]。此外,对于水肿较重的脑转移瘤,抗VEGF的靶向治疗也可以明显改善患者的生活质量[25-26]。对于存在EGFR、ALK基因突变的肺腺癌脑转移瘤的术后靶向治疗和放疗的选择时机,仍存在一定的争议。而对于EGFR阳性的肺癌脑转移瘤,靶向治疗联合放疗的患者较单纯靶向治疗可获得更长的生存期。
本研究存在一定的局限性,本研究为单中心回顾性研究,具有一定的选择性偏倚。此外,此次研究样本量有限,未能按照原发肿瘤等进行更详细的亚组分析,可能存在混杂因素,进而影响统计分析结果,需要更大样本的研究进一步证实。
总之,小脑转移瘤行外科手术切除后,可以解除占位效应,获得术后病理学检查结果,指导下一步的综合治疗。术后病理学检查结果显示,Ki-67增殖指数≥50%的患者,需密切随访,尽早开展术后的辅助治疗,术后脑部放疗和靶向治疗有助于延长小脑转移瘤患者的生存期。

