经内镜黏膜下隧道肿瘤切除术和黏膜下肿瘤挖除术治疗固有肌层来源黏膜下肿瘤比较
王 璐,彭 涛,高慧茹,赵文月,王燕燕
消化道黏膜下肿瘤(SMTs)是起源于消化道黏膜层以下的隆起性病变,按照消化道管壁层次可细分为黏膜肌层肿瘤、黏膜下层肿瘤、固有肌层肿瘤[1]。 来源于固有肌层的间叶源性肿瘤具有恶变潜能,随肿瘤生长会出现侵润邻近组织器官或血性转移等恶性肿瘤特征[2]。 报道显示,SMTs 的常规消化道内镜下检出率是0.33% ~0.76%[3]。 近年来,内镜检查的普及和内镜超声检查技术的发展, 使SMTs的检出率大幅提高,SMTs 的治疗模式已由原来以外科手术为主转变为以内镜下切除为主[4-8]。 与早期消化道黏膜肿瘤相比,SMTs 的治疗技术难度及手术风险均较高,针对病灶选择合理的术式是取得内镜治疗成功的关键。 本研究对近年内镜黏膜下肿瘤挖除术(ESE)和黏膜下隧道肿瘤切除术(STER)治疗消化道固有肌层来源黏膜下肿瘤的效果进行总结,为术式选择提供参考。
1 对象与方法
1.1 对象 回顾性选取2018 年1 月~2020 年10月于河北北方学院附属第一医院内镜中心92 例接受内镜下手术的上消化道黏膜下肿瘤患者病历资料, 根据手术方式分为ESE 组43 例、STER 组49例。 纳入标准:单发的SMTs,经超声内镜证实肿瘤起源于固有肌层; 超声内镜及CT 检查无恶性肿瘤高风险特征,无周围淋巴结转移,未侵犯到消化道外;签署手术知情同意书。 排除标准:凝血功能异常;合并严重心脑血管疾病,长期服用抗血小板药物及抗凝剂;合并严重高血压。
1.2 主要器材 日本奥林巴斯CV-260SL 电子胃镜、CO2气泵、透明帽、注射针,日本奥林巴斯超声内镜,爱尔博高频电外科系统VIO3 高频电刀、氩等离子体凝固器, 奥林巴斯IT 刀、Hook 刀、Dual 刀、金属钛夹持放器、金属钛夹。
1.3 手术方法 ESE:患者左侧位,全麻。 胃镜头端安装透明帽,内镜下准确定位肿瘤,用氩气刀在病灶边缘做标记;黏膜下多点注射靛胭脂+肾上腺素+生理盐水+透明质酸混合溶液; 纵行切开肿物上方黏膜或沿瘤体一侧环形切开,分离瘤体周围黏膜下组织,沿瘤体边缘切断瘤体周围固有肌层,挖除瘤体,取出后用金属钛夹缝合创面。 术中用热活检钳电凝、氩离子凝固术处理小血管出血。 切除瘤体标本送病理。
STER:患者左侧位,全麻。 胃镜头端安装透明冒,内镜下准确定位肿瘤;于肿瘤上缘3 ~5 cm 处注射混合溶液(同ESE 组), 使局部黏膜层充分隆起,电刀切开此处黏膜至黏膜下层;胃镜进入,分离黏膜下层和固有肌层,形成黏膜下纵形隧道直至瘤体,将肿瘤从固有肌层分离,切除瘤体及包膜从隧道中取出,注意包膜完整性,注意避免浆膜层和黏膜面的损伤;隧道内出血用热活检钳电凝、氩气刀凝固止血,充分冲洗隧道,将隧道内气体、液体充分吸引后退镜;使用金属钛夹完整夹闭黏膜切口。 切除瘤体标本送病理。
术后半卧位,常规使用抗生素预防感染、抑酸、禁食、补液营养支持,创面较大或穿孔的患者需胃肠减压。 观察有无呕血、黑便、胸闷、气急、腹痛、腹胀,怀疑气胸或气腹时需行X 射线或CT 检查。
术后3、6 个月复查内镜,观察创面愈合、残留情况,之后每年复查1 次,随访复发情况。 比较两组手术时间、住院时间,并对两组完整切除率、残留复发及并发症进行比较。
1.4 统计学处理 采用SPSS 22.0 软件包对数据进行分析,计数资料以(%)表示,行卡方检验,术中出血量等计量资料以(±s)表示,两组间数据比较,行t 检验,以P <0.05)为差异有统计学意义。
2 结果
2.1 一般资料 两组患者性别、 年龄、SMTs 部位、类型等资料比较,差异均无统计学意义(P >0.05),STER 组瘤体最大径长于ESE 组,但两组间比较,差异无统计意义(χ2=1.932,P=0.05,表1)。
表1 两组上消化道黏膜下肿瘤患者一般资料比较[例,(±s)]
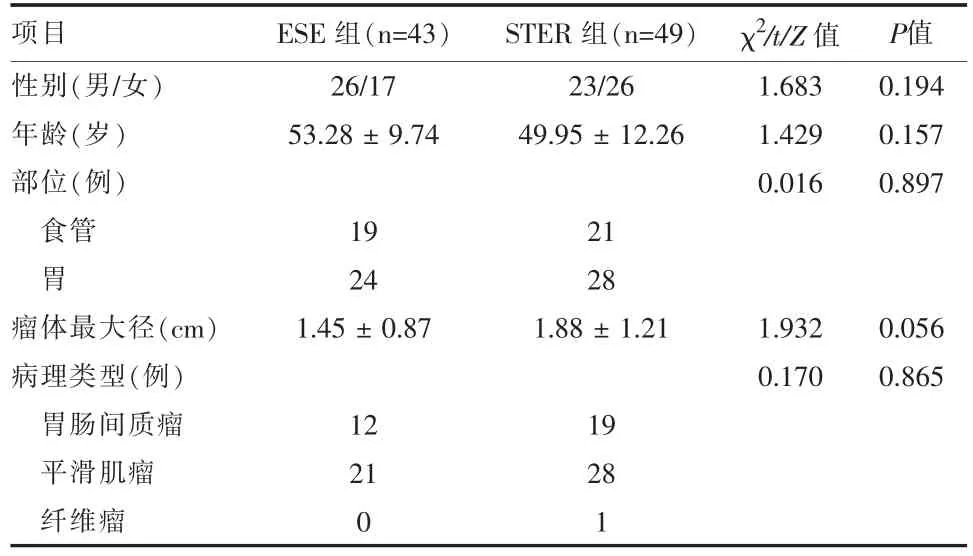
表1 两组上消化道黏膜下肿瘤患者一般资料比较[例,(±s)]
?项目 ESE 组(n=43) STER 组(n=49) χ2/t/Z 值 P值性别(男/女) 26/17 23/26 1.683 0.194年龄(岁) 53.28 ± 9.74 49.95 ± 12.26 1.429 0.157部位(例) 0.016 0.897食管 19 21胃24 28瘤体最大径(cm) 1.45 ± 0.87 1.88 ± 1.21 1.932 0.056病理类型(例) 0.170 0.865胃肠间质瘤 12 19平滑肌瘤 21 28纤维瘤 0 1
2.2 围术期指标比较 两组完整切除率差异无统计学意义 (P >0.05)。 ESE 组手术时间短于STER组,住院时间长于STER 组,两组间比较,差异有统计学意义(P <0.05)。 见表2。
表2 两组上消化道黏膜下肿瘤患者围术期指标比较(±s)
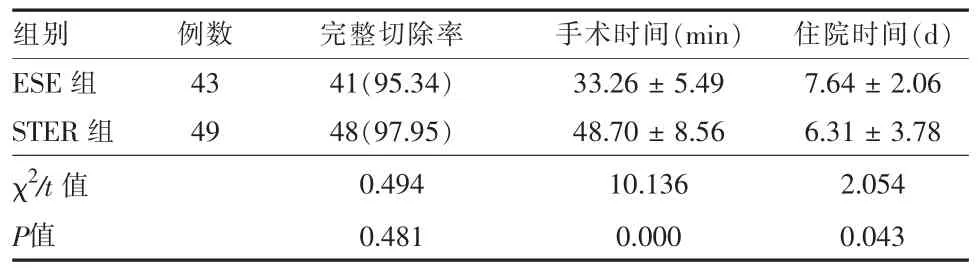
表2 两组上消化道黏膜下肿瘤患者围术期指标比较(±s)
组别 例数 完整切除率 手术时间(min) 住院时间(d)ESE 组 43 41(95.34) 33.26 ± 5.49 7.64 ± 2.06 STE R 组 49 48(97.95) 48.70 ± 8.56 6.31 ± 3.78 χ2/t 值 0.494 10.136 2.054 P值 0.481 0.000 0.043
2.3 并发症比较 两组总并发症发生率差异无统计学意义(P >0.05),但ESE 组术中穿孔率9.30%(4/43),STER 组0 例穿孔,穿孔率0%(0/49),两组穿孔率差异有统计学意义(P <0.05)。 见表3。
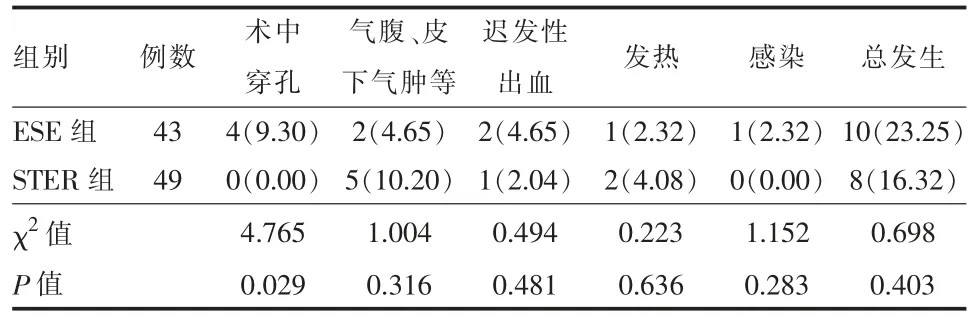
表3 两组上消化道黏膜下肿瘤患者并发症比较[例(%)]
2.4 切除率、残留率、复发率比较 随访时长14 ~37 个月。 ESE 组残留率2.32%(1 例)、复发率2.32%(1 例),STER 组残留率0、 复发率4.08%(2 例);两组残留率、复发率差异均无统计学意义(P >0.05)。
3 讨论
对于起源于固有肌层的SMTs, 传统外科手术创伤大、术后恢复慢,腹腔镜胸腔镜下手术相对创伤较小, 但对于突向腔内生长的肿瘤判断困难,需要内镜的辅助,且SMTs 很少淋巴转移,无需清扫淋巴结,很适合内镜下切除[9]。
本研究中,ESE 和STER 两组的完整切除率、残留率、复发率差异均无统计学意义。 STER 组的手术时间略长于对照组, 这可能是由于STER 技术难度高于ESE,创建隧道增加了操作时间,也可能与手术医师习惯性地以STER 处理直径较大肿瘤有关。宋顺喆[10]总结STER 的并发症包括皮下气肿、纵隔气肿、气胸、气腹,术中、术后出血,隧道部位穿孔,肺炎、肺不张、胸腔积液,感染等。 本研究两组术中无喷射性大出血,术后延迟出血STER 组1 例,ESE组2 例, 差异无统计学意义,STER 组穿孔率低于ESE 组,差异有统计学意义。这主要缘于STER 利用消化道黏膜和固有肌层之间的空间进行操作,保留了瘤体表面的黏膜完整性可减少穿孔,通过隧道可直视肿瘤周围血管, 在切除瘤体前先处理血管,明显降低了出血及继发胸腹腔感染的发生率。 ESE 是ESD 技术的延伸, 虽然对于直径较小的SMTs 可选择纵向切开黏膜,沿瘤体中央切开后向两侧逐步剥离肿瘤,不切除表面的黏膜,有利于金属钛夹的对吻闭合,但是对于较大的固有肌层肿瘤,创面大不易缝合,表面黏膜缺失,内镜操作的难度较大,穿孔及出血的风险也相应增加。
皮下气肿、 气胸、 气腹等气体相关并发症是STER 手术常见并发症[11]。本中心亦使用CO2气源,与空气相比,CO2在人体内弥散、吸收较快,一旦发生气肿、气腹等,控制送气压力,CO2可很快吸收,减少气体相关并发症发生。 对于气腹较重者,可以用腹腔穿刺针于右下腹麦氏点穿刺排气, 减轻腹压,对于术中出现气胸者, 穿刺排气予胸腔闭式引流后,根据患者情况多可继续手术[12]。
张明黎等[13]认为,食管腔狭窄操作空间小,且壁薄无浆膜层,ESE 只适合切除黏膜肌层来源的食管SMTs, 而不适合固有肌层的SMTs。 本研究采用ESE 切除食管固有肌层来源黏膜下肿瘤亦有较高的完全切除率。 如穿孔风险较大时换用双钳道内镜, 一个钳道放入异物钳夹住瘤体行内镜下牵引,防止全层切开后瘤体掉入腹腔。 此外,在食管中段操作时要格外谨慎,避免损伤主动脉血管。 由于隧道内空间有限, 对于较大的食管SMTs 采用STER同样存在隧道内剥离或瘤体取出困难,同样需注意防止隧道壁破损。
需要注意的是,无论ESE 还是STER 术前的准确评估SMTs 的生长方式十分重要,SMTs 有腔内、腔外、腔内外生长3 种方式,术前判断不准确则可能导致内镜下切除失败转腹腔镜手术。 EUS 探查深度有限,对于形态不规则及较大的肿瘤判断准确度欠佳, 可结合增强CT 扫描及三维重建提高评估准确度。
总之,ESE、STER 均可有效治疗固有肌层来源消化道黏膜下肿瘤, 完整切除率高, 与ESE 相比,STER 可降低穿孔率,缩短住院时间。

