连作对猕猴桃根际土细菌群落结构的影响
赵 颖,王素玲,陈 超,奚梅杰,王晓燕,2*,江景勇,陈安东
(1台州学院生命科学学院,台州318000;2浙江省植物进化生态学与保护重点实验室,台州318000;3台州市农业科学研究院,台州317000;4天台宜佳农业开发股份有限公司,台州317200)
土壤微生物在生态系统组成和物质循环过程中扮演着重要角色,不仅通过影响土壤生态过程调节土壤环境[1],还可促进植物对矿质养分的吸收和增强植物对生物与非生物胁迫的抵抗能力[2]。土壤微生物组成和多样性已成为指示土壤环境健康的重要指标[2-3]。随着商业化种植面积的激增,单一作物连作不仅造成土壤自毒性增加、养分失调和产量降低等连作障碍[4],还会影响对土壤环境极为敏感的植物根际微生物群落[5-6]。
猕猴桃为猕猴桃科(Actinidiaceae)猕猴桃属(Actinidia)落叶藤本植物,因其果实含有人体必需的17种氨基酸和矿质元素、纤维素和维生素C,且有通便和缓解肠道疾病的作用,享有“水果之王”的美誉[7-9]。作为当前果树栽培的优先选择,猕猴桃种植已在全世界范围内形成了栽培面积约1.4×105hm2,产量约1.76×106t的国际化产业[10]。中国的猕猴桃栽培面积位居世界第一,分别占全球种植面积和产量的41.6%和45%[10]。然而,随着猕猴桃连作年限的增加,常见土传性病害(如细菌性溃疡病、根腐病、褐斑病等)的发病率也明显增加[10-11]。目前,连作对猕猴桃生长密切相关的根际细菌群落的影响尚不清楚。
本研究以中华猕猴桃(Actinidia chinensisPlanch.)为材料,对两个种植基地6个连作年份梯度的猕猴桃根际土进行取样,通过高通量测序对细菌群落结构和多样性进行分析,以期揭示连作和土壤理化性质对猕猴桃根际土细菌群落结构的影响。
1 材料与方法
1.1 样品采集与处理
从浙江省台州市天台县街头镇(120°47′56″E,29°06′43″N)两个猕猴桃种植基地分别选择已种植3年、4年、5年和1年、8年、12年的‘红阳’猕猴桃种植区,形成6个种植年份梯度。每个年份梯度选择3株健康且大小相近的猕猴桃植株,去除土壤表面杂草和落叶,用已消毒的铲子在主根四周0—15 cm深度挖取细根,将细根上黏附的根际土抖入编号的自封袋中,放入冰盒带回实验室-80℃保存,用于土壤细菌群落结构分析。相同位置另取一部分土壤,室内风干后过2 mm筛,用于土壤理化性质测定,同时用土壤因子测定仪(ProCheck-GS3)在原位测定土壤电导率。
1.2 土壤微生物DNA提取
称取约0.35 g猕猴桃根际土,用Power Soil DNA Isolation kit试剂盒(MoBio laboratories,USA)提取土壤微生物DNA。提取的DNA于1.5%琼脂糖凝胶进行检测,并用NanoDrop 2000(Thermo)检测DNA浓度。6个年份梯度(每个年份梯度3个重复样品)共提取18个样品的DNA。
1.3 16S r RNA基因扩增及MiSeq测序
根际土细菌16SrRNA的V4—V5区采用通用引物515F/907R(F5’-GTGCCAGCMGCCGCGG-3’,R5’-CCGTCAATTCMTTTRAGTTT-3’)扩增。PCR扩增程序如下:94℃5 min;94℃30 s,60℃60 s,72℃90 s,34个循环;72℃10 min。PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega)定量后,委托杭州利贞生物医药科技有限公司用MiSeq平台(Illumina)PE250进行高通量测序。
1.4 土壤理化性质测定
土壤pH用玻璃电极法(水土比为2.5∶1)测定。土壤有机质(Soil organic matter,SOM)含量用重铬酸钾法测定[12]。土壤全氮(Total nitrogen,TN)、全磷(Total phosphorus,TP)含量用高氯酸-硫酸酸溶-钼锑抗比色法测定[12]。土壤氨态氮(Ammonia nitrogen,AN)和硝态氮(Nitrate nitrogen,NN)经氯化钾浸提后用流动分析仪(AA3,德国BranLuebbe公司)测定其含量。土壤速效磷(Available phosphorus,AP)和速效钾(Available potassium,AK)分别用碳酸氢钠和乙酸铵浸提后用流动分析仪(AA3,德国BranLuebbe公司)测定其含量。
1.5 数据处理与分析
首先对测序得到的PE reads去除低质量序列和拼接;然后通过Usearch软件平台(version 7.1,http://drive5.com/uparse/)对优化序列提取非重复序列和去除没有重复的单序列,再按照97%相似性对非重复序列(不含单序列)进行OTU(Operational Taxonomic Units)聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。将所有优化序列map至OTU代表序列,选出与OTU代表序列相似性在97%以上的序列,生成OTU表格。采用mothur软件[13]利用每个样本所含的OTU计算细菌的α多样性:丰富度指数(ACE、Chao1)、多样性指数(Shannon、Simpson)及测序深度指数(Coverage)。为了得到每个OTU对应的物种分类信息,通过Qiime平台(http://qiime.org/scripts/assign_taxonomy.html),采用RDP classifier[14](version 2.2,http://sourceforge.net/projects/rdp-classifier/,置信度阈值为0.7)贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并通过比对16S细菌和古菌核糖体数据库Silva[15]分别在phylum(门)、family(科)、genus(属)的水平上统计各样本的群落组成。不同种植年份间共有OTU的Venn图及非度量多维尺度(Nonmetric MultiDimensional Scaling,NMDS)分析分别用R语言的VennDiagram包[16]和vegan包[17]完成。此外,还利用Galaxy在线平台(http://huttenhower.sph.harvard.edu/galaxy/)中的LEfSe(Line Discriminant Analysis(LDA)Effect Size)筛选各种植年份具有特征意义的类群[18],LDA值设定为4.0。
采用SPSS19.0软件对数据进行统计学分析。不同年份间OTU数、丰富度指数、多样性指数及土壤理化性质用单因素方差分析进行比较,对不符合方差齐性的参数用非参检验(卡方检验)。多样性指数随连作年份变化趋势的拟合用二次回归。细菌多样性指数及优势属与土壤理化性质之间关系的分析用Pearson相关性进行检验。相同门和优势属的多度在不同连作年份间的差异显著性用单因素方差分析检验。
2 结果与分析
2.1 连作年份对土壤理化性质的影响
如表1所示,不同土壤理化性质指标随种植年份的增加表现出不同的变化趋势。种植1年和4年的土壤电导率SEC(Soil electrical conductivity)显著高于其他种植年份;不同种植年份的土壤pH无显著差异(种植4年除外),总体上呈降低趋势;土壤有机质含量在种植5年和12年较高,显著高于种植8年;土壤全氮(TN)含量在种植3年和4年显著高于种植1年;种植1年的土壤氨态氮(AN)含量显著高于种植3年和5年;土壤全磷(TP)、速效磷(AP)和速效钾(AK)含量整体上呈现随种植年份增加而增加的趋势,其中种植8年和12年的土壤TP含量显著高于其他种植年份。

表1 猕猴桃不同连作年份土壤理化性质Table 1 Soil physicochemical properties of A.chinensis in different continuous cropping years
2.2 连作年份对细菌多样性的影响
对分别种植1年、3年、4年、5年、8年和12年的猕猴桃根际土细菌测序后发现,测序取样覆盖率均在99%以上,取样深度已基本覆盖根际土中的大部分细菌。不同种植年份OTU类型数存在差异,种植3年(3 348±93)和5年(3 279±211)的OTU类型数显著高于种植8年(1 422±119)和12年(1 601±523)。连作时间对细菌多样性有显著影响,细菌丰富度指数(ACE和Chao1)及多样性指数(Shannon和Simpson)均随连作年份的增加呈先轻微上升后明显下降的趋势,其中,多样性指数平均值在种植3—5年时较高,而随着连作年份的继续增加,种植8—12年时细菌多样性指数显著降低,二次曲线拟合均显著(P<0.05),对观测数据的预测区间也呈现相同的变化趋势(图1)。方差分析也表明,种植3年、4年和5年的ACE、Chao1、Shannon和Simpon指数均显著高于种植8年和12年(P<0.05)。
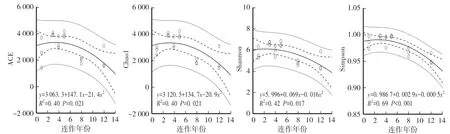
图1 细菌多样性指数与连作年份的二次回归Fig.1 Quadratic regression between bacterial diversity index and continuous cropping year
2.3 土壤理化性质对细菌多样性的影响
为了探究土壤理化性质是否对细菌多样性产生影响,对土壤理化因子与细菌多样性指数进行Pearson相关性分析,结果表明:细菌丰富度指数ACE和Chao1与土壤AN、TP和AK含量呈显著负相关,细菌多样性指数Shannon与TP和AK含量呈显著负相关,Simpson指数与TP、AP和AK含量均呈显著正相关。而SEC、pH、SOM、TN、NN含量与细菌丰富度指数(ACE和Chao1)和多样性指数(Shannon和Simpson)无显著相关性。可见,本研究中TP和AK含量会显著改变细菌群落组成,TP和AK含量的增加显著降低了细菌多样性。

表2 细菌丰富度指数和多样性指数与土壤理化性质的相关性分析Table 2 Correlation analysis between bacterial richness index and diversity index and soil physicochemical properties
2.4 连作年份对细菌群落组成的影响
猕猴桃根际土中共检测出细菌13个门,其中优势菌门为变形菌门(Proteobacteria,占35.5%—46.3%)、酸杆菌门(Acidobacteria,占6.5%—28.6%)、放线菌门(Actinobacteria,占7.5%—18.7%)、绿弯菌门(Chloroflexi,占6.4%—9.3%)、蓝藻门(Cyanobacteria,占1.72%—15.86%)和浮霉菌门(Planctomycetes,占3.79%—8.23%)(图2)。通过对门水平上根际土细菌组成百分比进行单因数方差分析发现,变形菌门(F=18.39,P=0.013)、酸杆菌门(F=40.07,P=0.003)和浮霉菌门(F=14.42,P=0.014)在6个种植年份间存在显著差异。其中,变形菌门(F=14.22,P=0.020)、酸杆菌门(F=39.59,P=0.003)、浮霉菌门(F=29.02,P=0.006)和厚壁菌门(Firmicutes)(F=8.06,P=0.047)在两个种植基地间存在显著差异。
对根际土中检测到的相对丰度>5%的细菌属绘制柱状图(图2)发现,不同种植年份的猕猴桃根际土细菌群落优势属存在差异:种植1年的猕猴桃根际土中罗河杆菌属(Rhodanobacter)和水恒杆菌属(Mizugakiibacter)为优势菌属;种植3—5年的根际土中Acidobacteriaceae_Subgroup_1_uncultured、Acidobacteria_norank和Cyanobacteria_norank为优势菌属;而种植8年和12年的根际土中Xanthomonadales_uncultured、Cyanobacteria_norank、酸杆菌属(Acidibacter)和水恒杆菌属为优势菌属。此外,随着连作年份增加,Cyanobacteria_norank(F=18.40,P=0.013)和Xanthomonadales_uncultured(F=17.65,P=0.014)的丰富度指数与年份呈显著线性相关。其中,种植12年(13.08%)的猕猴桃根际土中植物病原菌Xanthomonadales_uncultured所占比例分别是种植1年(1.17%)、3年(0.88%)、4年(1.35%)、5年(1.16%)和8年(12.06%)的11.2倍、14.9倍、9.7倍、11.3倍和1.1倍。对两个种植基地的优势属相对丰度比较发现,Acidobacteriaceae_Subgroup_1_uncultured(F=787.42,P<0.001)、Acidobacteria_norank(F=12.54,P=0.024)和水恒杆菌属(F=24.01,P=0.008)3个属在两个种植基地间存在显著差异。
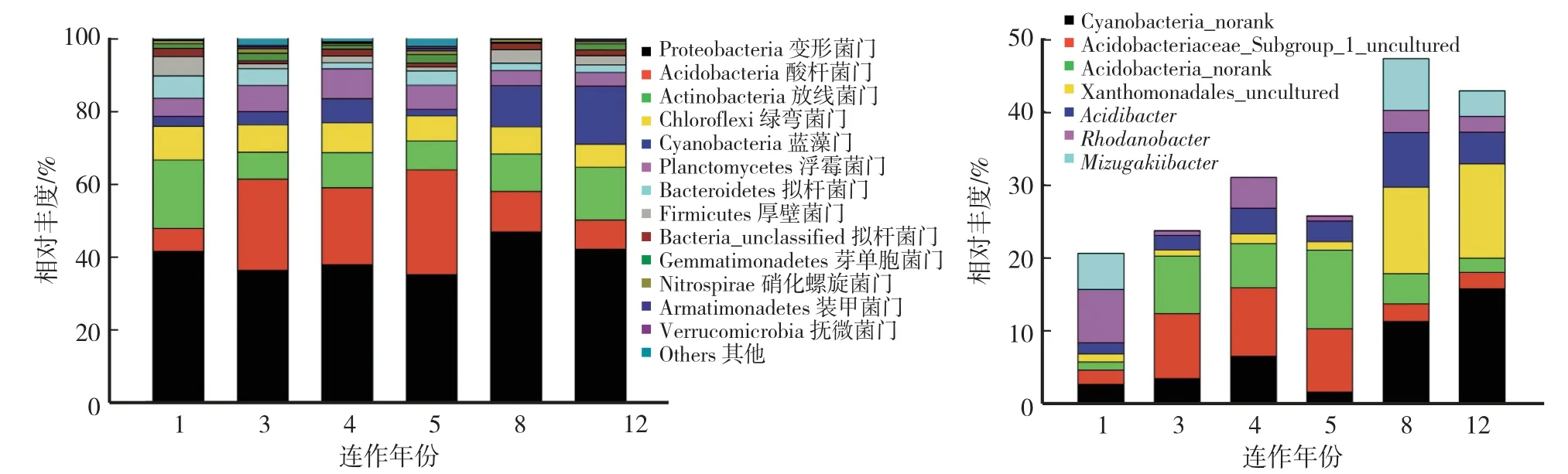
图2 细菌群落结构的门分布(左)和优势属(右)Fig.2 Phylum distribution(left)and dominant genus(right)of bacterial community structure
利用种植1年、3年、5年、8年和12年的细菌OTU分布绘制Venn图发现,15个样品共有OTU数1 183个(图3)。根际土细菌特有OTU数随种植年份的增加逐渐较少,依次为1年(291)>5年(196)>3年(158)>8年(100)>12年(96)。

图3 不同连作年份根际土细菌OTU分布Venn图Fig.3 Venn diagram of bacteria OTU distribution in rhizosphere soil in different continuous cropping years
2.5 连作年份和土壤理化性质对细菌优势门和优势属的影响
对优势门和相对丰度>5%的优势属与连作年份和土壤理化性质进行Pearson相关性分析发现,相对丰度最高的变形菌门与年份无相关性,而该门的Xanthomonadales_uncultured、酸杆菌属和水恒杆菌属与年份、AN、TP、AP及AK含量中至少一个指标呈显著正相关,该门的罗河杆菌属与SEC和AN含量呈显著正相关。酸杆菌门及该门的2个属Acidobacteriaceae_Subgroup_1_uncultured和Acidobacteria_norank趋势相同,与年份、AN、TP、AP及AK含量中的大部分指标呈负相关。蓝细菌门及该门的Cyanobacteria_norank均与年份、TP、AP及AK含量呈极显著正相关。各优势门和属与土壤pH、SOM及TN含量没有显著相关性。
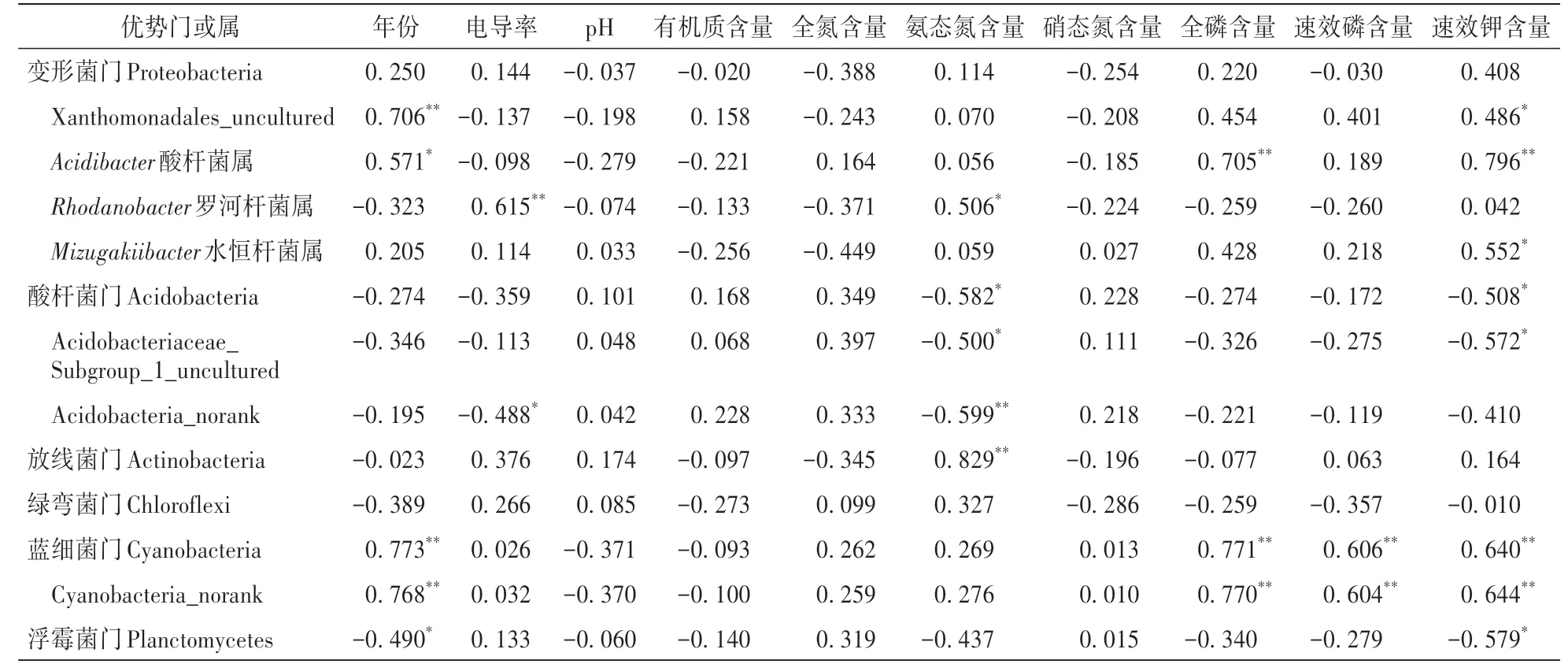
表3 细菌优势门和优势属与土壤理化性质的相关性分析Table 3 Correlation analysis between dominant phyla and genus of bacteria and soil physicochemical properties
2.6 连作年份和土壤理化性质对细菌群落结构的影响
对不同连作年份根际土细菌群落进行NMDS分析发现(图4),种植1年和8年的细菌群落置信区间只与种植12年有部分重叠,与其他种植年份均相距较远;种植3年、4年和5年的细菌群落置信区间相距较近,说明3年、4年和5年的细菌群落相似度较高。这与采样位置相符合,种植3年、4年和5年为同一个种植基地,种植1年、8年和12年为另一个种植基地。对种植年份和土壤理化性质对细菌群落结构的影响分析也表明,采样位置(r2=0.37,P=0.034)、年份(r2=0.34,P=0.044)、AN含量(r2=0.41,P=0.020)和AK含量(r2=0.46,P=0.007)对细菌群落结构有显著影响,TP含量对细菌群落结构的影响达到临界显著(r2=0.28,P=0.088),其他土壤理化性质对细菌群落结构没有显著影响。
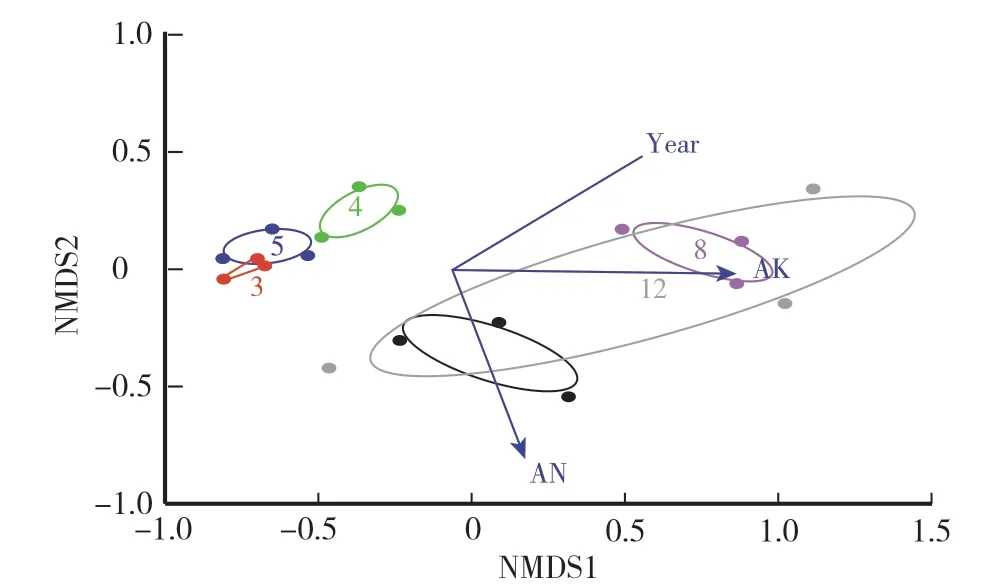
图4 不同连作年份根际土细菌群落的非度量多维尺度(NMDS)分析Fig.4 Non metric multidimensional scale(NMDS)analysis of bacterial community in rhizosphere soil in different continuous cropping years
2.7 不同连作年份间具有显著性差异的细菌群落标志物
鉴于某类群在不同连作年份间分布差异显著并不能代表该类群具有特征意义,进一步利用LEfSe筛选各连作年份具有特征意义的类群。结果发现:种植1年的根际土中,放线菌门的Frankiales目、厚壁菌门(Firmicutes)的梭菌纲(Clostridia)、变形菌门的产碱菌科(Alcaligenaceae)和黄单胞菌科(Xanthomonadaceae)的罗河杆菌属为生物标记类群;连作3年的土壤中,α-变形菌纲(Alphaproteobacteria)的根瘤菌目(Rhizobiales)为生物标记类群;连作4年的土壤中,酸杆菌门的Acidobacteriacea_Subgroup_g_uncultured属、浮霉菌门的浮霉菌科(Planctomycetaceae)、α-变形菌纲的醋杆菌科(Acetobacteraceae)为生物标记类群;连作5年的土壤中,酸杆菌门的3个属Acidobacteria_g_norank、Candidatus_Solibacter和Bryobacter属和变形菌门的δ-变形菌纲(Deltaproteobacteria)为生物标记类群;连作8年的土壤中,变形菌门γ-变形菌纲(Gammaproteobacteria)的水恒杆菌属和酸杆菌属为生物标记类群;连作12年的土壤中,蓝细菌门的Cyanobacteria_g_norank属和变形菌门 γ-变形菌纲Xanthomonadales_f_uncultured目的Xanthomonadales_g_uncultured科为生物标记类群(图5)。
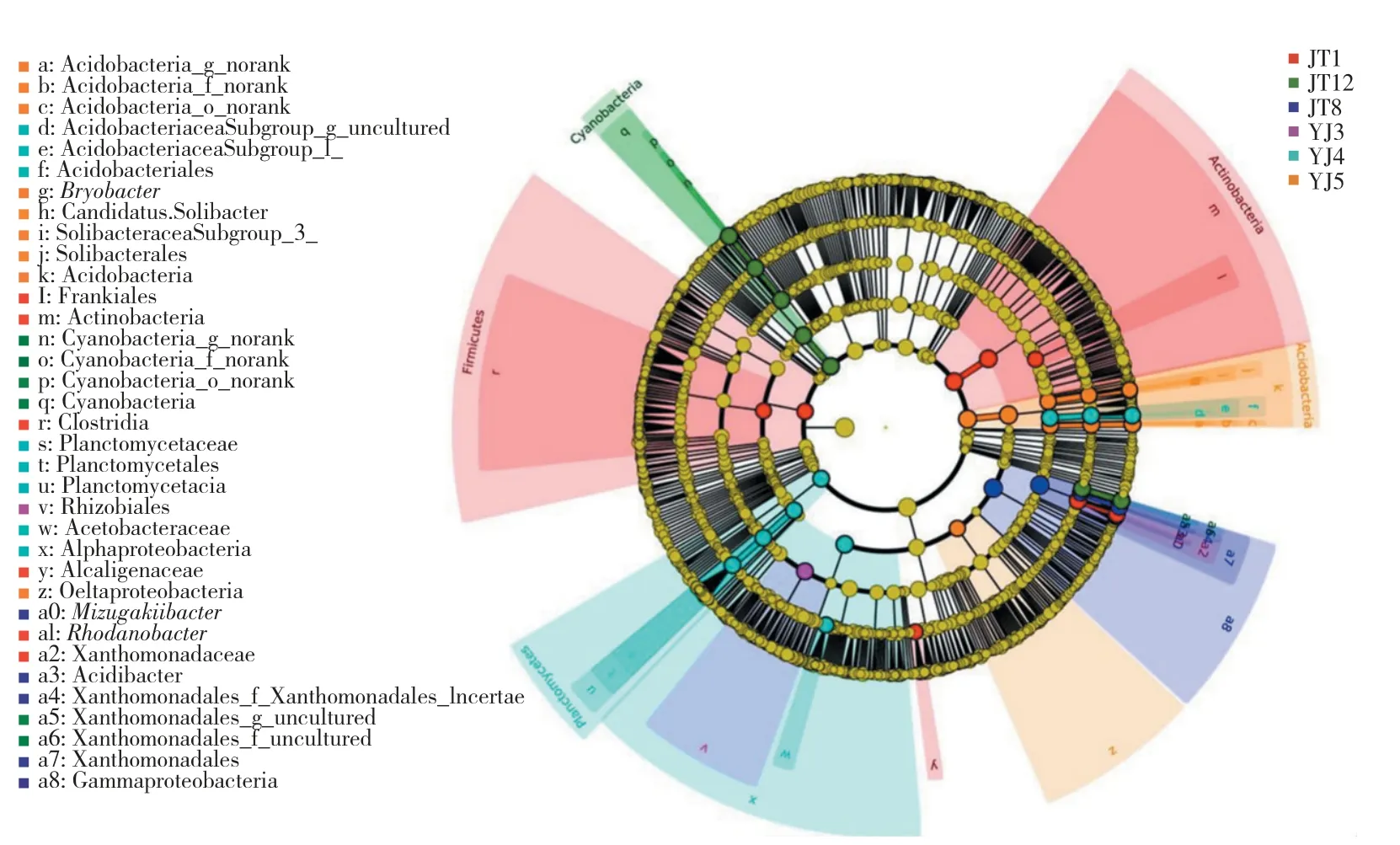
图5 不同连作年份差异细菌类群进化分类等级图Fig.5 Evolutionary classification of different bacterial groups in different continuous cropping years
3 讨论
近年来,随着猕猴桃栽培面积的扩大,由连作和种苗传播导致的土传病害已成为制约猕猴桃产业发展的主要因素[11]。目前研究主要集中于对猕猴桃病害的记录和描述以及病害的防治,从土壤微生物角度分析连作对根际细菌群落的影响未见报道。
本研究从猕猴桃根际土中共检测到13个细菌门,优势门为变形菌门、酸杆菌门、放线菌门、绿弯菌门和蓝细菌门。其中,变形菌门(35.50%—46.32%)相对丰度最高,这与连作对枸杞[19]、棉花[20]的根际土细菌群落多样性的影响类似。对全世界6个洲237份土样中细菌群落的分析也发现,变形菌门、酸杆菌门和放线菌门是相对丰度最高的3个门,但不同环境条件下各菌门相对丰度的顺序会变化[21]。本研究中,蓝细菌门也是优势菌门,且与连作年份、土壤全磷、速效磷和速效钾含量存在极显著正相关。对莲雾(Syzygium samarangense)根际细菌多样性的研究也发现,优势菌门顺序与世界总体情况不同,依次为酸杆菌门、绿弯菌门、变形菌门和放线菌门[22]。
果园连作障碍不仅表现为果树生长受抑和果实品质下降,还会引起根际土壤微生态系统失调和土壤微生物多样性降低[4,23-25]。本研究通过比较不同连作年份间猕猴桃根际细菌群落发现,细菌OTU数、特有OTU数、丰富度指数(ACE和Chao1指数)和多样性指数(Shannon和Simpon指数)均随连作年份的增加而降低,NMDS分析也表明连作年份对细菌群落组成有显著影响,这与西瓜[26]、马铃薯(Solanum tuberosum)[27]根际细菌群落的研究类似。
连作会通过多种途径影响土壤细菌群落,其中土壤理化性质的变化是连作带来的普遍问题[28]。土壤是根际细菌生存的主要环境,土壤理化性质的变化显著影响微生物群落结构[28-29]。研究发现,长期连作会破坏土壤结构和造成养分失衡[24]。有关刺槐(Robinia pseudoacacia)根系分泌物对根际细菌影响的研究表明,刺槐根际土壤理化性质的改变增加了根际土壤碱解氮、AP和有机质含量,从而增强了变形菌门和放线菌门部分细菌对土壤资源的竞争,最后导致酸杆菌门和硝化螺旋菌门细菌的减少及根际土壤细菌多样性的降低[30]。
同种作物连续种植导致的土壤特定养分的积累或不足也会改变土壤理化性质。对棉花不同连作年份土壤理化性质比较发现,土壤AP和AK含量均随连作年份的增加而减少[29]。而本研究发现,随着连作年份的增加,土壤AN、TP、AP和AK含量增加。这一方面可能与猕猴桃种植过程中持续施肥,而猕猴桃本身对养分的吸收能力有限导致的养分积累有关;另一方面可能与连作引起的土壤微生物群落的变化有关。本研究中,土壤AN、TP和AK含量与细菌丰富度指数ACE和Chao1及多样性指数Shannon呈显著负相关,说明土壤AN、TP和AK含量的增加会显著降低细菌多样性。此外,土壤理化性质还会显著影响优势门和优势属的相对丰度。在13个优势门和优势属中有11个相对丰度与至少一个土壤理化性质有显著相关性,说明大部分的优势细菌类群对土壤养分较为敏感。但是同一个门的不同细菌类群对土壤理化性质的响应也可能不同,如变形菌门的Xanthomonadales_uncultured、Acidobacteria和水恒杆菌属与土壤AN、TP、AP及AK含量中至少一个指标呈显著正相关,而该门的罗河杆菌属则与以上指标呈负相关,与土壤电导率SEC和AN呈显著正相关。罗河杆菌属与土壤氮的固定或转换有关,尤其偏好化学氮肥[31]。本研究表明,该属偏好很可能倾向于AN。而酸杆菌门及该门的2个属Acidobacteriaceae_Subgroup_1_uncultured和Acidobacteria_norank与罗河杆菌属对土壤养分的响应不同,与AN和AK含量呈显著负相关,说明酸杆菌可能更偏好养分贫瘠的土壤。蓝细菌门则会在养分丰富的土壤中积累,与AN、TP、AP及AK含量呈极显著正相关。
在分析过程中,还发现种植地点对细菌群落组成也有显著影响。第一个基地(种植1年、8年、12年)中变形菌门和厚壁菌门显著高于第二个基地(种植3年、4年和5年),而酸杆菌门和浮霉菌门显著低于第二个基地。对两个种植基地的优势属相对丰度比较发现,Acidobacteriaceae_Subgroup_1_uncultured和Acidobacteria_norank显著低于第二个基地,而水恒杆菌属显著高于第二个基地。这可能与不同基地的管理方式有关,即不同的基地对于土壤的施肥、杀菌、除草等的实施方式、种类和剂量不同。土地种植方式、水分、施肥等管理以及土壤环境状况对微生物数量、活性与种群结构有着较大影响。土地种植方式不同,土壤微生物数量和种群结构及其多样性必然会存在某种程度的差别[32]。如不同施肥处理导致稻田土壤微生物群落结构和多样性差异明显[33]。土壤养分也能很好地预测微生物生物标记或丰度[34]。Wallis等[1]研究发现,土壤条件(包括AP、Mg2+、总阳离子、K和SOM含量)与土壤细菌群落结构和组成显著相关。种植方式会显著改变微生物群落结构和功能[35]。
根际是植物根系与土壤微生物间互作的独特环境。研究发现,根际微生物对植物生长和养分吸收存在正的或负的影响,其中益生菌能提高植物抗性、固氮、解磷等功能,而致病菌会阻碍植物生长[36]。连作会导致土壤中有益微生物减少和土传性有害微生物增加[37-38]。对大蒜(Allium sativumL.)连作条件下根际土壤微生物的研究表明,长期连作会抑制有益微生物的生长[39]。对花生(Arachis hypogaeaL.)[40]和番茄(Solanum lycopersicum)[41]的研究也证实,连作时间的增加会导致根际土中假单胞菌(Pseudomonasspp.)及芽孢杆菌(Bacillusspp.)等有益微生物数量减少,从而减弱对有害微生物的拮抗作用及土传病害积累。本研究中,随着连作年份的增加,猕猴桃根际土中的放线菌和芽孢杆菌数量无明显变化。但是,在种植8年和12年的根际土中黄单胞菌Xanthomonadales_uncultured属显著增加,该属为植物致病菌,在侵入植物后会降解植物薄壁细胞,获取营养,使植物患病[42]。研究表明,黄单胞属(Xanthomonas)能够引起小麦(Triticum aestivumL.)和棉花等粮食作物和经济作物减产[43]。此外,野油菜黄单胞菌(X.campestrispv.campestris)能致所有十字花科植物患黑腐病[44]。采样过程中,只有种植8年和12年的猕猴桃出现了溃疡病。在实际生产中也发现,猕猴桃连作时间超过4—5年时,容易患病,且引起不同程度的死亡。猕猴桃感病是一个复杂和多因素决定的过程,虽然猕猴桃患病与黄单胞菌的关系目前还不清楚,但是土壤中致病菌的积累可能是重要原因之一。
4 结论
长期连作严重影响了猕猴桃根际土中的细菌群落结构,不仅改变了土壤理化性质,增加了土壤养分的积累,还通过影响土壤理化性质降低了细菌多样性和特有类群的数量。其中连作年份、种植地点、氨态氮和速效钾含量对细菌群落结构产生了显著影响。进一步分析发现,大部分细菌优势门和优势属均与一个或几个土壤理化性质呈显著相关,且不同门和属对土壤理化性质的偏好不同,甚至相反。其中部分对植物有害的类群随连作年份增加呈显著增加的趋势。因此,猕猴桃连作过程中应根据特定品种对不同养分的需求和土壤中养分的含量采取适当的施肥措施。

