脂毒性应激对Bcl-2蛋白诱导胰岛β细胞凋亡的调节作用
钟丽红, 丘创华, 彭紫元, 佘吉佳
(1.深圳市第二人民医院干部保健科,广东 深圳 518000;2. 深圳市第二人民医院检验科,广东 深圳 518000)
目前,2型糖尿病的患病率持续升高。食用富含饱和游离脂肪酸(free fatty acid,FFA)是导致肥胖和2型糖尿病的主要环境因素之一。为了维持正常的血糖水平,肥胖者对胰腺β细胞产生胰岛素的需求很高,导致β细胞功能和存活受到不利影响。β细胞的再生潜力相对较低,受到损伤后可能会对葡萄糖稳态产生不利影响[1]。长期暴露于饱和FFA会引起β细胞中凋亡蛋白与生存蛋白之间的失衡,从而导致细胞凋亡并可能导致2型糖尿病。泛素-蛋白酶体系统(ubiquitinproteasome system,UPS)是生理未折叠蛋白反应的一部分,可缓解内质网应激。有研究结果显示,2型糖尿病患者胰岛中的泛素化蛋白(ubiquitinated protein,Ub)水平显著升高,高水平的蛋白质泛素化与β细胞凋亡有关[2],而蛋白质泛素化增加和β细胞凋亡是否是UPS失活的继发因素仍未知。本研究通过分析FFA引起的UPS失活是否构成β细胞凋亡的上游信号通路,探讨脂毒性应激对B淋巴细胞瘤(B-cell lymphoma,Bcl)-2蛋白诱导胰岛β细胞凋亡的调节机制。
1 材料和方法
1.1 小鼠饲养
将12只C57BL/6(野生型)小鼠饲养于37 ℃ 12 h明暗循环的房间中,可以自由获取食物和水。以6只C57BL/6小鼠构建PUMA-/-小鼠。给小鼠喂食高脂肪饮食(澳大利亚Specialty Feeds公司)72 h,营养成分为17.6%(W/W)蛋白质、27%(W/W)脂肪,脂肪成分为14.59%的饱和脂肪、11.66%的单不饱和脂肪和0.53%的多不饱和脂肪。
1.2 小鼠胰岛细胞和小鼠胰岛瘤MIN6细胞培养
采用胶原酶P(瑞士R o c h e公司)和Histopaque-1077密度梯度分离液(美国Sigma公司)分离小鼠胰岛β细胞。PUMA-/-小鼠胰岛经过洗涤,手工挑选,使用CMRL培养基1066[美国Invitrogen公司,含100 U/mL青霉素、100 μg/mL链霉素、2 mmol/L谷氨酰胺和10%胎牛血清(fetal bovine serum,FBS;美国JRH Biosciences公司)]在37 ℃、5%CO2孵育箱中培养。MIN6细胞购自美国ThermoFisher Scientific公司,使用Dulbecco改良Eagle培养基(美国Invitrogen公司,含10%FBS)在37 ℃、5%CO2环境培养。
1.3 实验分组
1.3.1 处理组 分别用棕榈酸酯(美国Sigma公司)、蛋白酶体抑制剂MG132(美国Sigma公司)处理MIN6细胞0(即刻)、2、4、8、24 h,检测细胞蛋白酶体活性和细胞活性,采用实时定量聚合酶链反应(polymerase chain reaction,PCR)检测活化转录因子(activated transcription factor,ATF)4 mRNA、重链结合蛋白(heavy-chain binding protein,Bip)mRNA、C/EBP同源蛋白(C/EBP homologous protein,Chop)mRNA、p53上调凋亡调控因子(p53 up-regulated modulator of apoptosis,PUMA)mRNA表达量,采用免疫印迹法检测Bcl-2、Bcl-XL、髓细胞白血病-1(myeloid cell leukemia-1,Mcl-1)和蛋白激酶B(protein kinase B,PKB;又称Akt)蛋白表达量。用萝卜硫烷(sulforaphan,SFN)、棕榈酸酯、SFN+棕榈酸酯分别处理小鼠胰岛β细胞0(即刻)、2、4、8、24 h,检测ATF 4 mRNA、Bip mRNA、Chop mRNA、PUMA mRNA和Bcl-2、Bcl-XL、Mcl-1、Akt表达以及细胞活性。具体处理方法:采用含1%FBS和1%牛血清白蛋白(bovine serum albumin,BSA)的DMEM培养小鼠胰岛细胞和MIN6细胞。将棕榈酸酯溶于90%乙醇中,终浓度为0.5 mmol/L(含1%BSA),使未结合的FFA浓度在nmol/L级别[3]。将蛋白酶体抑制剂MG132和抗氧化剂SFN溶解在二甲基亚砜(美国Sigma公司)中,MG132和SFN的使用浓度均为10 μmol/L,均在培养基加入棕榈酸酯前2 h加入。
1.3.2 对照组 按相同步骤培养和处理小鼠胰岛细胞和MIN6细胞,但不加入MG132和SFN,仅加入等体积的二甲基亚砜溶剂。
1.4 蛋白酶体活性检测
用10 μmol/L FFA或10 μmol/L棕榈酸酯处理后,再使用含0.5% NonidetP-40的磷酸盐缓冲液制备MIN6细胞裂解物,4 ℃ 10 000×g离心10 min,以清除细胞核和未裂解的细胞碎片。采用蛋白酶体活性测定试剂盒(美国BioVision公司,货号K245-100)测定澄清的裂解物中的蛋白酶体活性。将7-氨基-4-甲基香豆素标准品、阳性对照和不同处理方式得到的MIN6细胞裂解样本一式两份装入96孔板中,采用EnSpire多模式读板器(美国Perkin Elmer公司)(激发波长350 nm、发射波长445 nm)在60 min内平行测定样本的蛋白酶体活性。严格按试剂盒和仪器说明书操作。
1.5 实时定量PCR
使用NucleoSpin RNA XS(德国 Macherey-Nagel公司)制备小鼠胰岛细胞和MIN6细胞的RNA。使用高容量cDNA逆转录试剂盒(美国Applied Biosystems公司)将600 ng RNA制备First strand cDNA。将制备的cDNA用去离子水1∶20稀释。采用实时荧光定量PCR检测ATF4 mRNA、Bip mRNA、PUMA mRNA和Chop mRNA表达量。TaqMan PCR Master Mix试剂盒购自美国ABI公司,检测仪器为RotorGene RG-3000荧光定量PCR仪(德国 Qiagen公司)。反应体系:总体积为20 μL,包括SYBR mix 10 μL、H2O 5 μL、引物4 μL、Template 1 μL。反应条件:95 ℃ 1 min;95 ℃ 15 s,59 ℃ 15 s,72 ℃ 20 s,42个循环;58 ~ 95 ℃收集荧光,通过熔解曲线评估PCR的特异性。收集目的基因Cq值,计算ΔCt值,分别与内参基因β-actin的ΔCt值比较,得到-ΔΔCt值。
1.6 免疫印迹法
MIN6细胞培养和处理后,用含有蛋白酶抑制剂的RIPA缓冲液裂解总蛋白。12 000×g离心5 min后,用蛋白质检测试剂盒(美国伯乐公司)检测蛋白质浓度。用等量的蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,并转移到聚偏二氟乙烯(polyvinylidene floride,PVDF)膜上,4 ℃与一抗孵育过夜。一抗(美国ThermoFisher Scientific公司)分别为抗Bcl-2抗体(1∶1 000)、抗Bcl-XL抗体(1∶1 000)、抗Mcl-1抗体(1∶1 000)、抗Chop抗体(1∶1 000)、抗Akt抗体(1∶1 000)、抗Ub抗体(1∶1 000)。将PVDF膜与二抗(辣根过氧化物酶标记的山羊抗兔抗体,美国ThermoFisher Scientific公司)孵育2 h。最后使用增强化学发光检测试剂盒(南京诺维赞公司)检测印迹,以β-actin为参照,分析Bcl-2、Mcl-1、Akt、Bcl-XL、Chop和Ub蛋白的表达量。
1.7 细胞活性评估
用胰蛋白酶将小鼠胰岛β细胞和MIN6细胞分散成单个细胞,采用碘化丙啶(propidium iodide,PI)染色分析DNA片段。采用DNA染料Hoechst-33342(含10 μg/mL Hoechst-33342)和PI(5 μg/mL)染色后,在BM-38XD型倒置荧光显微镜(上海彼爱姆公司)下观察至少600个细胞,计算小鼠胰岛β细胞和MIN6细胞凋亡的百分比。
1.8 统计学方法
采用Graphpad prism 6 软件进行统计分析。呈正态分布的计量资料采用±s表示,组间比较采用配对t检验或ANOVA分析,然后进行Bonferroni校正。以P<0.05为差异有统计学意义。
2 结果
2.1 不同处理组MIN6细胞Ub水平、蛋白酶体活性和细胞活性比较
棕榈酸酯组和FFA组的Ub水平分别为1.42±0.11、1.37±0.12,显著高于对照组(1.01±0.03)(P<0.05)。
与处理0 h比较,采用棕榈酸酯处理MIN6细胞不同时间的蛋白酶体活性下降,但差异均无统计学意义(P>0.05);采用MG132处理MIN6细胞8 h的蛋白酶体活性显著降低(P<0.05);MG132处理MIN6细胞24 h的Ub水平显著升高(P<0.05)。棕榈酸酯组和MG132组处理24 h后,MIN6细胞凋亡数显著高于对照组(P<0.05)。见图1。
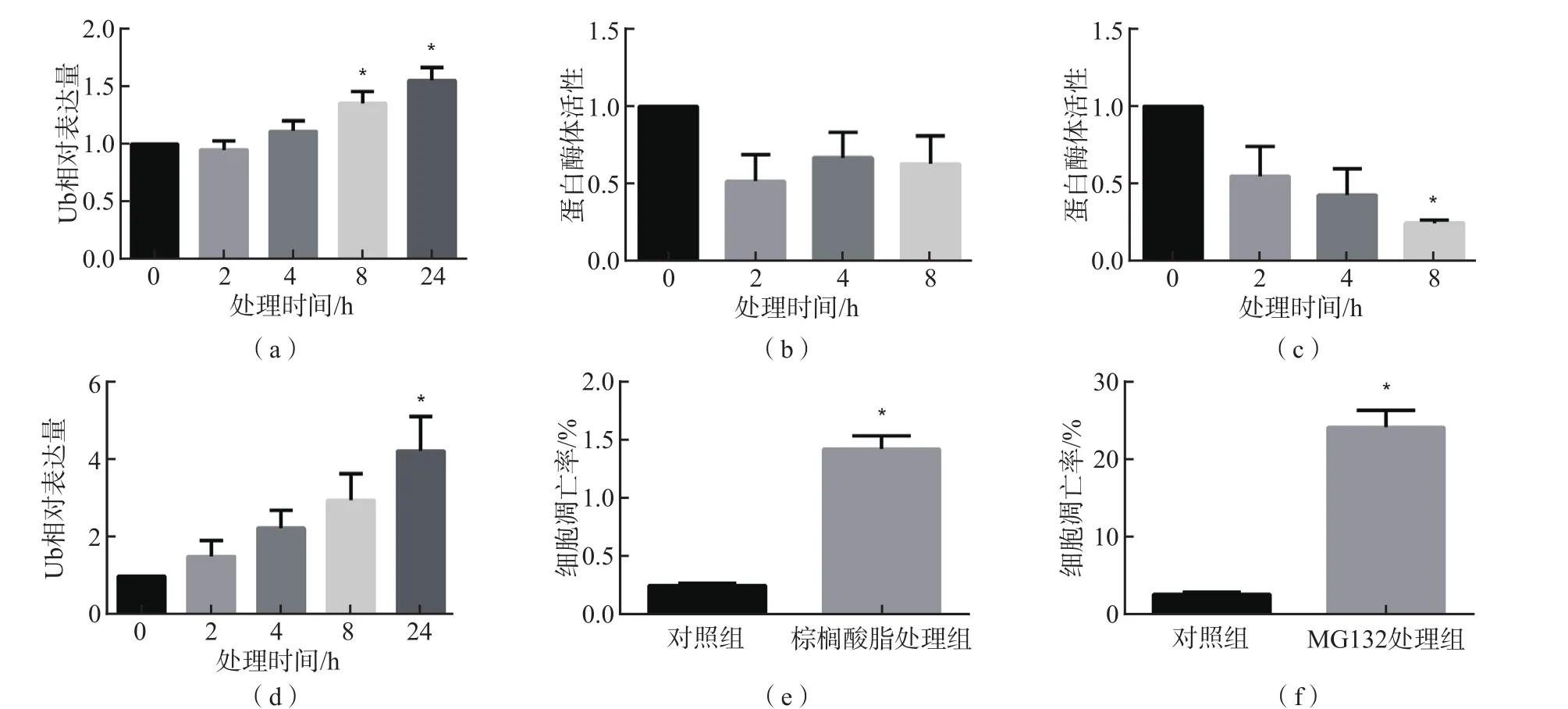
图1 不同处理组MIN6细胞Ub水平的比较及细胞凋亡情况
2.2 不同处理组MIN6细胞凋亡和凋亡相关基因、蛋白表达量的比较
与0 h比较,棕榈酸酯和MG132处理24 h后MIN6细胞内质网应激标志物ATF4 mRNA、Bip mRNA和Chop mRNA的表达量显著升高(P<0.05)。见图2。

图2 不同处理组MIN6细胞内质网应激相关基因和蛋白的表达量比较
与0 h比较,棕榈酸酯和MG132处理24 h后MIN6细胞Bcl-2、Bcl-XL蛋白表达量显著降低(P<0.05)。Mcl-1蛋白表达量呈先升后降趋势,棕榈酸酯处理2 h时Mcl-1蛋白表达量最高,显著高于0 h(P<0.05),处理24 h时显著低于0 h(P<0.05);MG132处理2 h时Mcl-1表达量显著高于0 h(P<0.05),处理8 h时Mcl-1蛋白表达量最高,但处理24 h时Mcl-1蛋白表达量仍显著高于0 h(P<0.05)。见图3。
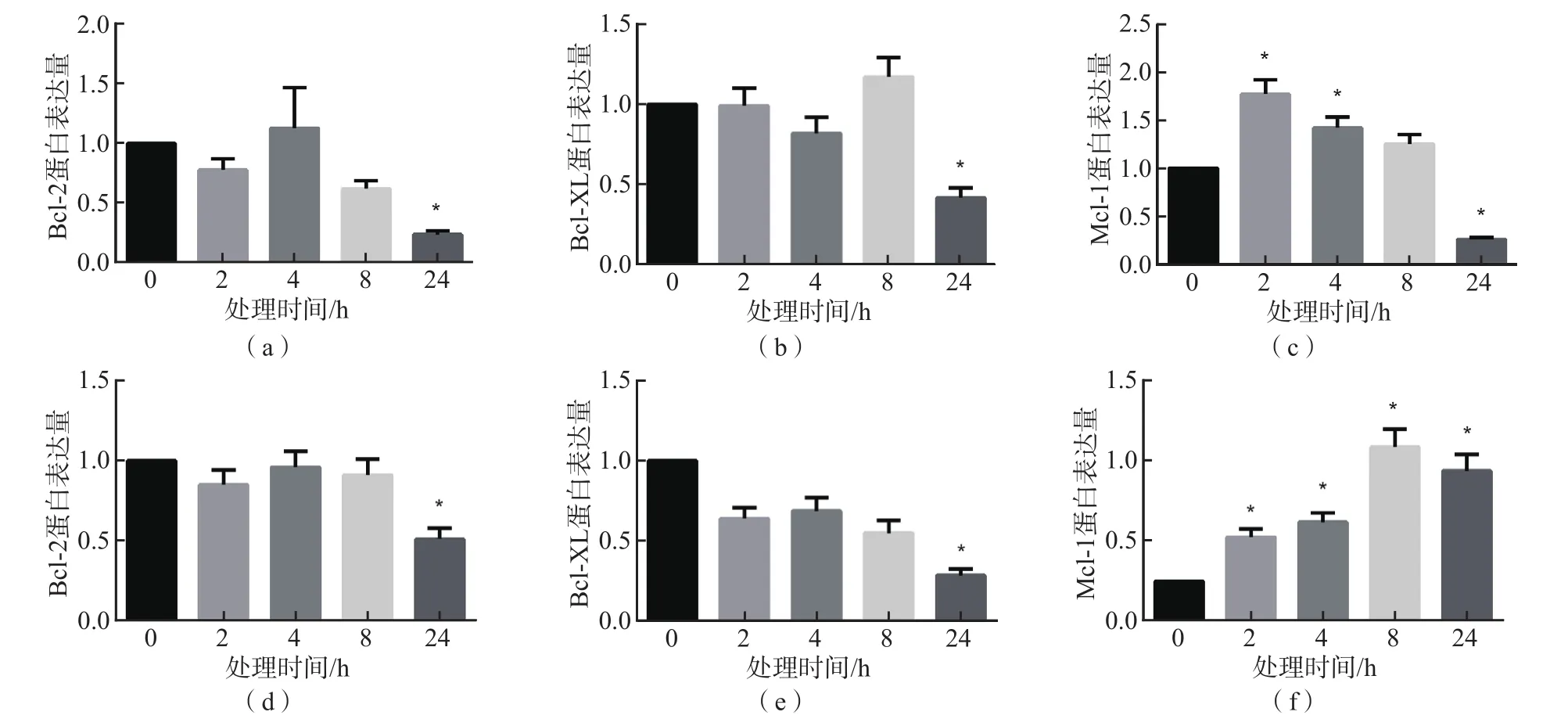
图3 不同处理组MIN6细胞凋亡相关蛋白表达量的比较
与0 h比较,棕榈酸酯和MG132处理24 h后MIN6细胞的Akt蛋白表达量均显著下降(P<0.05),PUMA mRNA表达量均显著升高(P<0.05)。采用MG132处理野生型小鼠胰岛细胞和PUMA-/-小鼠胰岛细胞24 h后,野生型小鼠胰岛细胞凋亡率显著高于PUMA-/-小鼠(P<0.05)。见图4。
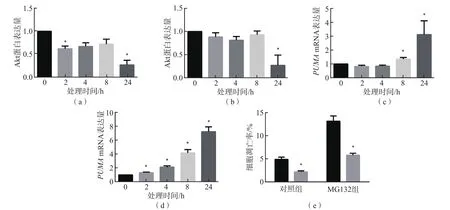
图4 不同处理组MIN6细胞凋亡相关基因、蛋白表达量的比较和不同小鼠胰岛细胞凋亡情况
2.3 不同处理组β细胞凋亡和凋亡相关基因、蛋白表达量的比较
棕榈酸酯组β细胞凋亡率均显著高于SFN组、SFN+棕榈酸酯组和对照组(P<0.05),SFN组、SFN+棕榈酸酯组及对照组之间β细胞凋亡率差异均无统计学意义(P>0.05)。棕榈酸酯组AFT4蛋白、Chop蛋白、Bip蛋白和PUMA mRNA均显著高于对照组(P<0.05),而SFN+棕榈酸酯组与对照组之间差异均无统计学意义(P>0.05)。见图5。

图5 棕榈酸酯组、SFN组、SFN+棕榈酸酯组及对照组之间β细胞凋亡和凋亡相关基因、蛋白表达量的比较
3 讨论
2型糖尿病的发病机制目前尚不完全清楚,内质网功能紊乱所致的内质网应激在胰岛β细胞功能损伤中的作用和机制近年来逐渐引起学者们的重视。营养物质缺乏、脂质过度负荷、脂蛋白合成增加以及病毒感染均可打破内质网稳定,触发内质网应激。内质网应激包括3个反应:未折叠蛋白反应、内质网超负荷反应和固醇调节级联反应。胰岛β细胞具有高度发达的内质网,是对内质网应激最为敏感的细胞之一。ATF6、双链RNA依赖的蛋白激酶样内质网激酶和Ⅰ型跨膜蛋白激酶/核糖核酸内切酶是存在于内质网膜上的3种跨膜蛋白。正常情况下,这些跨膜蛋白与内质网分子伴侣蛋白Bip稳定结合,处于未激活状态。内质网应激通过诱导Chop基因的表达,激活下游促凋亡基因表达,ATF4、ATF6和蛋白50(protein 50,p50)可增加Chop基因的表达。Chop促进细胞调亡的机制包括:(1)下调抗凋亡基因Bcl-2表达,Bcl-2主要存在于线粒体内膜,可以抑制线粒体细胞色素c的释放,从而减少胞质细胞色素c激活半胱氨酸天冬氨酸特异性蛋白酶9导致的细胞凋亡;(2)Chop基因表达增加可产生耗竭谷胱甘肽、促进活性氧簇产生等效应[3]。内质网应激还可通过Tribbles同源蛋白3、Akt和叉形头转录因子O亚型(forkhead box O3a,FoxO3a)的复杂途径引起BH3蛋白的PUMA活化,参与p53诱导的细胞凋亡。有研究结果显示,BH3蛋白PUMA在棕榈酸酯诱导的细胞凋亡中起重要作用[4]。
在脂毒性作用下,β细胞中UPS的失活机制可能包括转录和转录后机制。有研究结果显示,棕榈酸酯可诱导人胰岛中PSMC4和PSMA7基因上调及PSMD8和PSMB10基因下调[5],这些基因与蛋白酶体的功能和活性有关。本研究结果显示,FFA和棕榈酸酯可显著提升氧化应激相关基因、蛋白的表达量,同时Ub表达量显著升高、蛋白酶体活性降低,提示在脂毒性作用下,β细胞的蛋白酶体活性降低,与SHANG等[6]的研究结论(由于FFA和棕榈酸酯的氧化增加了活性氧的产生,导致UPS发生转录后失活,改变了蛋白酶体的圆柱结构)一致。有研究结果显示,在给小鼠喂食高脂饲料或人类食用高脂肪饮食后会产生过量的饱和脂肪,过量饱和脂肪可能会抑制与UPS相关的酶的活性[7]。另外,U3泛素连接酶活性改变等替代途径也可能有助于棕榈酸酯诱导的蛋白质泛素化[8]。本研究结果显示,棕榈酸酯处理24 h后MIN6细胞ATF4 mRNA、Bip mRNA和Chop mRNA表达量显著升高(P<0.05),与文献报道[9]一致,提示棕榈酸酯可增加内质网应激标志物ATF4、Chop和Bip的表达,介导β细胞凋亡。棕榈酸酯处理24 h后Akt表达量显著降低(P<0.05),PUMA mRNA表达量显著升高(P<0.05),棕榈酸酯组β细胞凋亡率均显著高于SFN组、SFN+棕榈酸酯组和对照组(P<0.05),SFN组、SFN+棕榈酸酯组及对照组之间β细胞凋亡率差异均无统计学意义(P>0.05),证实SFN可预防棕榈酸酯诱导的细胞死亡。本研究中,棕榈酸酯组AFT4蛋白、Chop蛋白、Bip蛋白和PUMA mRNA均显著高于对照组(P<0.05),而SFN+棕榈酸酯组与对照组之间差异均无统计学意义(P>0.05),说明SFN能够降低棕榈酸酯诱导的内质网应激标志物AFT4、Chop、Bip和PUMA的表达,提高蛋白折叠能力,减轻内质网负担,有利于恢复β细胞内环境稳态和维持β细胞存活。
值得注意的是,UPS失活引起的细胞死亡与SFN激活的蛋白酶体相反。蛋白酶体激活剂SFN在研究中被建议作为针对各种糖尿病并发症(肾病和主动脉损伤等)的可能治疗方法[10]。β细胞中SFN保护的机制包括Ub减少、内质网应激减轻、PUMA激活以及Bcl-2蛋白上调。SFN还可通过灭活氧化应激来诱导β细胞保护[11]。长时间的SFN暴露可以减弱胰岛β细胞中葡萄糖刺激的胰岛素分泌[12]。
综上所述,FFA和棕榈酸酯可产生氧化应激反应,导致UPS调节失活,Ub水平升高,引起蛋白酶体结构改变,活性降低,从而导致相关凋亡基因启动,促使胰岛β细胞凋亡。SFN能够降低氧化应激标志物的表达水平,改善氧化应激状态,激活蛋白酶体活性,从而减少胰岛β细胞的凋亡。本研究阐明了FFA诱导β细胞凋亡的机制,为2型糖尿病的治疗提供了潜在的靶点。

