血清sICAM-1和hs-CRP水平在儿童急性病毒性下呼吸道感染病情监测中的意义
李东秀, 黄 健
(1.右江民族医学院附属医院儿内科,广西 右江 533000;2.江西省胸科医院呼吸与危重症医学科,江西 南昌 330006)
急性下呼吸道感染是儿科常见疾病,发病率较高,是导致婴幼儿死亡的主要原因之一[1]。临床上常通过患者的生命体征和胸部影像学改变来判断病情的变化,但这些检查均存在一定的滞后性[2]。因此,临床亟需寻找能准确诊断及监测下呼吸道感染患儿病情的生物学标志物。可溶性细胞间黏附分子-1(soluble intercellular adhesion molecule-1,sICAM-1)是介导白细胞与内皮细胞相互作用的重要黏附分子,在机体免疫应答反应、骨髓造血和肿瘤免疫中发挥重要作用,与呼吸道感染时肺部和支气管损伤密切相关,已被确定为判断急性呼吸道感染的预后标志物[3]。高敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)属于急性时相反应蛋白,可作为判断感染发生和疾病是否处于活动期的标志物之一[4]。本研究拟对急性病毒性下呼吸道感染患儿血清slCAM-1和hs-CRP水平进行检测,并分析其与患儿急性生理与慢性健康评分Ⅱ(acute physiology and chronic health evaluationⅡ,APACHEⅡ)和氧合指数之间的相关性,以期为监测急性病毒性下呼吸道感染患儿病情的进展提供依据。
1 材料和方法
1.1 研究对象
选取2018年1月—2020年12月至右江民族医学院附属医院就诊并经相关抗体检测确诊的急性病毒性下呼吸道感染患儿136例,按照《诸福棠实用儿科学》[5]中的诊断标准将136例患儿分为轻中症组和重症组。轻中症组:82例,其中男40例、女42例,年龄(5.8±2.8)岁,病程为(3.6±1.6)d。重症组:54例,其中男28例、女26例,年龄(6.0±2.4)岁,病程为(3.7±1.6)d。另选取同期右江民族医学院附属医院健康体检儿童50名作为正常对照组,其中男24名、女26名,年龄(5.2±2.7)岁;体格检查均无异常,血常规、肝功能、肾功能等检测结果均正常。3组之间年龄、性别差异均无统计学意义(P>0.05)。轻中症组与重症组年龄、性别和病程差异均无统计学意义(P>0.05)。本研究获右江民族医学院附属医院伦理委员会批准。
1.2 纳入及排除标准
1.2.1 纳入标准 (1)诊断符合《诸福棠实用儿科学》[5]中关于急性病毒性下呼吸道感染的诊断标准,临床表现为发热、咳嗽、喉中痰声等;(2)就诊前病程<1周;(3)患儿法定监护人同意参与本研究并签署知情同意书。
1.2.2 排除标准 (1)合并肺结核;(2)支气管有异物;(3)肝、肾功能障碍;(4)有严重感染、发热及鼻窦炎;(5)因精神疾病等原因不能或不配合治疗者。
1.3 方法
采集正常对照者体检当日的静脉血2 mL;分别采集所有患儿入院当日及进行常规治疗1周后的静脉血2 mL。分离血清,置于-20 ℃保存待检。采用Jet-iStar3000免疫分析仪(杭州中翰盛泰生物技术股份有限公司)及配套试剂检测hs-CRP水平。采用酶联免疫吸附试验检测sICAM-1水平,试剂盒购自上海晶抗生物工程有限公司。严格按照试剂盒说明书操作。检测所有患儿入院时的动脉血氧分压及吸入氧体积分数,计算氧合指数。
根据患儿血清病毒特异性IgG抗体水平将患儿病程分为急性期和恢复期[6]。患儿入院时均处于急性期;当患儿血清病毒特异性IgG抗体水平为入院时的1/4时,判定患儿病情进入恢复期。
采用APACHEⅡ评估患儿病情,评分越高表示患儿病情越危重,死亡风险越高[7]。根据APACHEⅡ评分将患儿分为低危组(<10分,39例)、中危组(10~19分,57例)和高危组(≥20分,40例)。
1.4 统计学方法
采用SPSS 22.0软件进行统计分析。对所有数据行正态性检验和方差齐性检验。呈正态分布的计量资料以x±s表示,2个组之间比较采用t检验,多组间比较采用方差分析。计数资料以例或率表示,组间比较采用χ2检验。采用Pearson相关分析评估各项指标之间的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 急性病毒性下呼吸道感染患儿急性期和正常对照组血清sICAM-1和hs-CRP水平的比较
重症组和轻中症组急性期血清sICAM-1和h s-C R P水平均显著高于正常对照组(P<0.05),且重症组急性期血清sICAM-1和h s-C R P水平显著高于轻中症组急性期(P<0.05)。见表1。

表1 重症组和轻中症组急性期及正常对照组血清sICAM-1和hs-CRP水平比较
2.2 不同APACHEⅡ评分各组血清sICAM-1和hs-CRP水平比较
低危组、中危组、高危组血清sICAM-1和hs-CRP水平依次升高,各组间差异均有统计学意义(P<0.05)。见表2。

表2 不同APACHEⅡ评分各组血清sICAM-1和hs-CRP水平比较
Pearson相关分析结果显示,急性病毒性下呼吸道感染患儿急性期血清sICAM-1和hs-CRP水平与APACHEⅡ评分均呈正相关(r值分别为0.79、0.70,P<0.05)。
2.3 不同病情阶段急性病毒性下呼吸道感染患儿血清sICAM-1和hs-CRP水平比较
重症组急性期和恢复期血清sICAM-1和hs-CRP水平均明显高于轻中症组急性期和恢复期(P<0.05)。轻中症组和重症组恢复期血清sICAM-1和hs-CRP水平均低于急性期(P<0.05)。见表3。
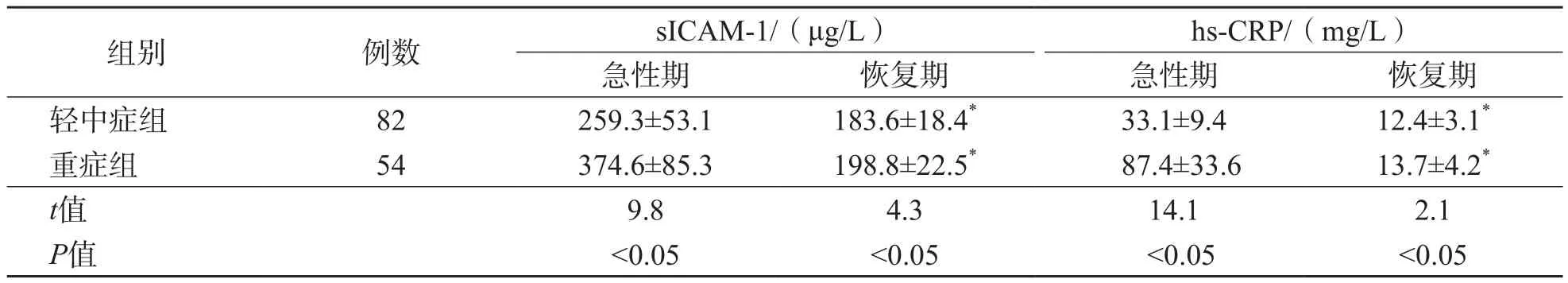
表3 不同病情阶段急性病毒性下呼吸道感染患儿血清sICAM-1和hs-CRP水平比较
Pearson相关分析结果显示,急性下呼吸道感染患儿治疗前氧合指数与血清sICAM-1和hs-CRP水平均呈负相关(r值分别为-0.54、-0.46,P<0.05)。
3 讨论
急性下呼吸道感染是儿童的常见病,发生急性下呼吸道感染后呼吸道分泌物易堵塞气道,会对患儿健康产生严重危害[8]。据统计,因急性下呼吸道感染就诊的患儿约占儿科门诊量的39.0%~65.5%,因其导致住院的患儿约占我国儿科住院患儿数的24.5%~65.2%[9]。发展中国家患儿急性下呼吸道感染的发病率和病死率远高于发达国家,是导致发展中国家患儿死亡的主要原因之一[10]。找到能及时诊断和反映患儿病情变化的指标对临床制定治疗策略至关重要,对降低急性下呼吸道感染患儿的病死率有积极意义。本研究结果显示,急性病毒性下呼吸道感染患儿血清sICAM-1和hs-CRP水平与病情严重程度密切相关。
sICAM-1通过介导细胞间或细胞与细胞外基质的相互接触和结合发挥作用,参与细胞的识别、活化和信号传导等过程,是免疫应答、炎症反应、凝血和肿瘤转移等一系列重要生理和病理过程的分子基础[11-12]。本研究结果显示,急性病毒性下呼吸道感染患儿血清sICAM-1水平明显高于正常对照者(P<0.05),且随着病情的加重,sICAM水平不断升高,当病情进入恢复期后,患儿血清sICAM-1水平降低。有研究结果显示,当人体出现炎症、哮喘、肿瘤或免疫排斥反应时,白细胞、淋巴细胞、血管内皮细胞和上皮细胞表面的sICAM-1表达增加,促进中性粒细胞的趋化和黏附,进而参与机体炎症反应[13]。这可能是急性病毒性下呼吸道感染患儿血清sICAM-1水平升高的主要原因。hs-CRP是一种全身性炎症反应急性期的非特异性标志物,在炎症反应发生后的8~12 h,其水平会明显升高[14]。有研究结果显示,hs-CRP水平的变化在小儿肺炎的诊断中具有极为重要的参考价值[15]。本研究结果显示,急性病毒性下呼吸道感染患儿血清hs-CRP水平显著高于正常对照者(P<0.05),且重症患儿明显高于轻中症患儿(P<0.05),恢复期患儿hs-CRP水平有所降低。另外,本研究急性病毒性下呼吸道感染患儿hs-CRP水平显著高于薛海鲸等[16]的报道,不能排除部分患儿可能合并细菌性肺炎或支原体肺炎等其他类型的感染性疾病。
APACHEⅡ评分是目前临床应用较为广泛的一种评估患者病情严重程度的方法。本研究结果显示,高危组和中危组急性期血清sICAM-1和hs-CRP水平明显高于低危组,且高危组血清sICAM-1和hs-CRP水平高于中危组。Pearson相关分析结果显示,急性病毒性下呼吸道感染患儿急性期血清sICAM-1和hs-CRP水平与APACHEⅡ评分均呈正相关(r值分别为0.79、0.70,P<0.05),与氧合指数均呈负相关(r值分别为-0.54、-0.46,P<0.05)。这提示通过监测急性病毒性下呼吸道感染患儿血清sICAM-1和hs-CRP水平可及时反映患儿病情的严重程度,为临床治疗策略的调整提供参考依据。
综上所述,血清sICAM-1和hs-CRP水平可反映急性下呼吸道感染患儿病情发展阶段和严重程度,可作为病情评估的重要参考指标。

