腹腔镜与开腹手术治疗低位直肠癌的临床比较
李铠江
阜宁县人民医院肛肠科,江苏阜宁 224400
直肠癌是临床比较常见的恶性肿瘤性疾病之一,好发于40 岁以上人群,对患者的健康、生命安全均会造成不良危害。 据2002年统计,我国直肠癌患病率仅为7%,而2020年统计,直肠癌患病率增长至15%以上,且逐渐朝向年轻化方向发展[1]。 低位直肠癌指的是病灶位于腹膜反折以下的病变, 目前临床多采取手术方式治疗。 但是传统开腹手术会对患者造成严重伤害,患者术后恢复慢,且容易出现多种并发症,预后质量不理想。微创技术的应用可提高直肠癌的治疗效果,其优势在于对患者伤害小,术后恢复快,并发症少,尽管价格相比开腹手术较高,但远期效果佳,更受患者的认可及好评[2]。该文针对2019年5月—2021年6月收治的低位直肠癌患者40 例为研究对象, 探讨开腹与腹腔镜治疗低位直肠癌的效果,现报道如下。
1 资料与方法
1.1 一般资料
选取于该院接受治疗的低位直肠癌患者40 例,以随机数表法划分观察组与对照组, 对照组20 例,男11 例,女9 例;年龄50~80 岁,平均(69.74±1.56)岁。 观察组20 例,男12 例,女8 例;年龄50~80 岁,平均(69.76±1.55)岁。 对比两组患者一般资料,差异无统计学意义(P>0.05),具有可比性。 纳入标准:①经MRI 等影像检查及临床诊断均确诊为低位直肠癌,符合《直肠癌规范化诊疗指南》[3]标准;②均同意参与且积极配合该治疗研究。排除标准:①合并其他恶性肿瘤疾病患者;②手术禁忌患者;③抵触配合研究者。 该研究通过医院医学伦理委员会批准。
1.2 方法
在手术治疗开始前,均需为两组患者提供B 超、结肠镜、盆腔CT 的检查,确认病灶的具体位置、体积、 浸润情况等数据, 并根据实际情况设计手术方案。 检查后叮嘱患者在手术前5 d 或前3 d 开始将饮食更改为半流质,以确保肠道处于较好的状态下,方便在手术当天清理胃肠道。
1.2.1 对照组治疗方法 为对照组患者采用传统开腹外科手术方案,术前取平卧仰卧位,选择全身麻醉诱导。 待麻醉生效后, 在下腹部作纵向切口, 根据TME 原则实施手术。 切割肠道前,需将直肠系膜下缘的动脉根给予结扎, 并快速清理周围的淋巴结组织。使用电凝刀沿盆腔筋膜的脏壁层进行游离,直至直肠尾骨端的下方位置。确认肿瘤具体位置,在其上缘超过10 cm 的位置作切口,切断乙状结肠,并在病灶下缘2~3 cm 位置离断直肠组织。病灶切除后使用规格为29 号的可吸收线, 借助肠道吻合器将结肠、直肠的断端进行吻合处理,并预置腹腔引流管。处理完毕后选择在病灶下缘,距离肛提肌2 cm 的位置实施Miles 手术,经左下侧腹部作结肠造瘘。
1.2.2 观察组治疗方法 为观察组患者采用腹腔镜下手术方案, 手术体位、 麻醉方式与对照组完全相同。待麻醉生效后于脐部上缘作观察孔,置入管鞘后建立人工CO2气腹, 且在手术过程中需将气腹压强保持在12~15 mmHg, 并于两侧麦氏点作至少两个操作孔。经由观察孔置入腹腔镜,对直肠病灶状态进行观察,评估是否发生周围组织转移的情况。待确认无转移情况后实施切除手术, 严格遵照直肠切除操作标准,使用超声刀切割乙状结肠的右侧系膜,对肠系膜下的主血管根给予充分游离和结扎, 离断乙状结肠后还需对周围的淋巴结、 脂肪层予以充分的清扫。将腹膜进行反折,使用超声刀分离直肠末端的提肛肌,于病灶边缘外2 cm 左右位置使用吻合器将直肠离断,并于左侧腹部作长度在3~5 cm 切口,将离断的乙状结肠取出。重新建立人工气腹,在腹腔镜观察下对直肠实施低位吻合操作,选择规格为28 号的引力管在吻合部的上方实施减压分流。 如患者肿瘤病灶的位置过低,距离提肛肌<2 cm,则需开展Miles手术,选择在左侧下腹部实施人工造瘘。
1.3 观察指标
对比两组患者临床指标,包括手术时长、切口长度、术中出血量、淋巴结清扫个数、术后下床时间、住院总时间、治疗总费用。 分别于术前及术后3 d 对两组患者炎症因子水平进行检测, 包括C 反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)。检测两组患者术前及术后肛肠动力变化,包括肛管最大收缩压(MSP)、直肠静息压(RRP)、直肠最大耐受容量(MTV)。 统计两组患者术后并发症总发生率。
1.4 统计方法
采用SPSS 24.0 统计学软件分析数据, 符合正态分布的计量资料用(±s)表示,组间差异比较采用t 检验;计数资料采用[n(%)]表示,组间差异比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者临床指标对比
观察组患者手术时长及患者术后恢复用时均明显短于对照组,切口长度、术中出血量小于对照组,清扫淋巴结个数多于对照组, 但观察组治疗总费用高于对照组,差异有统计学意义(P<0.05),见表1。
表1 两组患者临床指标对比(±s)
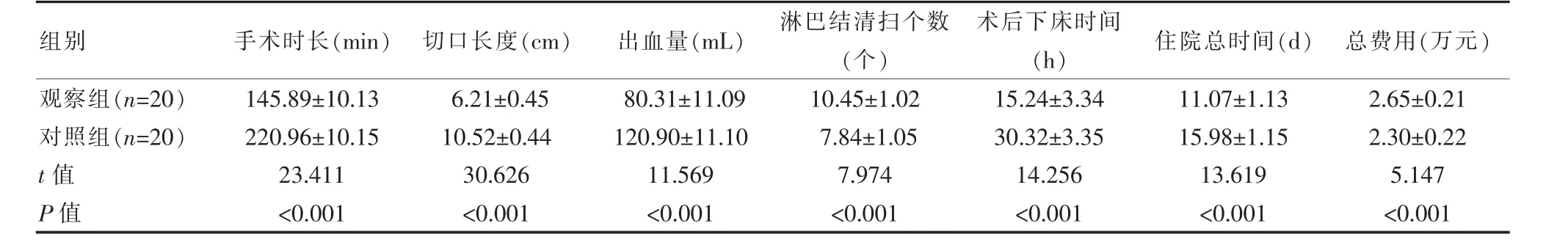
表1 两组患者临床指标对比(±s)
组别观察组(n=20)对照组(n=20)t 值P 值手术时长(min)145.89±10.13 220.96±10.15 23.411<0.001切口长度(cm)6.21±0.45 10.52±0.44 30.626<0.001出血量(mL)80.31±11.09 120.90±11.10 11.569<0.001淋巴结清扫个数(个)10.45±1.02 7.84±1.05 7.974<0.001术后下床时间(h)15.24±3.34 30.32±3.35 14.256<0.001住院总时间(d) 总费用(万元)11.07±1.13 15.98±1.15 13.619<0.001 2.65±0.21 2.30±0.22 5.147<0.001
2.2 治疗前后两组患者炎症水平变化对比
两组患者术前检测炎症水平对比, 差异无统计学意义(P>0.05),术后3 d,观察组患者炎症水平均低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者治疗前后炎症水平变化对比(±s)
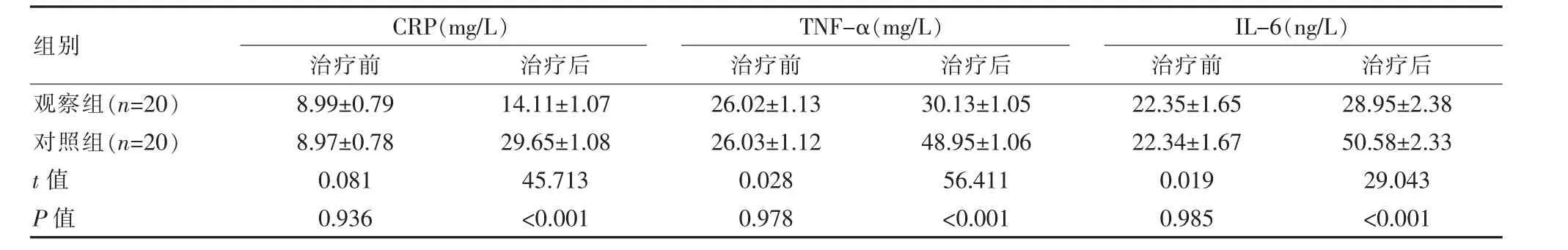
表2 两组患者治疗前后炎症水平变化对比(±s)
组别观察组(n=20)对照组(n=20)t 值P 值CRP(mg/L)治疗前 治疗后TNF-α(mg/L)治疗前 治疗后8.99±0.79 8.97±0.78 0.081 0.936 14.11±1.07 29.65±1.08 45.713<0.001 26.02±1.13 26.03±1.12 0.028 0.978 30.13±1.05 48.95±1.06 56.411<0.001 IL-6(ng/L)治疗前 治疗后22.35±1.65 22.34±1.67 0.019 0.985 28.95±2.38 50.58±2.33 29.043<0.001
2.3 治疗前后两组患者肛肠功能变化对比
两组患者术前测定肛肠功能相关指标对比,差异无统计学意义(P>0.05),术后观察组患者MSP、RRP、MTV 优于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者治疗前后肛肠功能变化对比(±s)
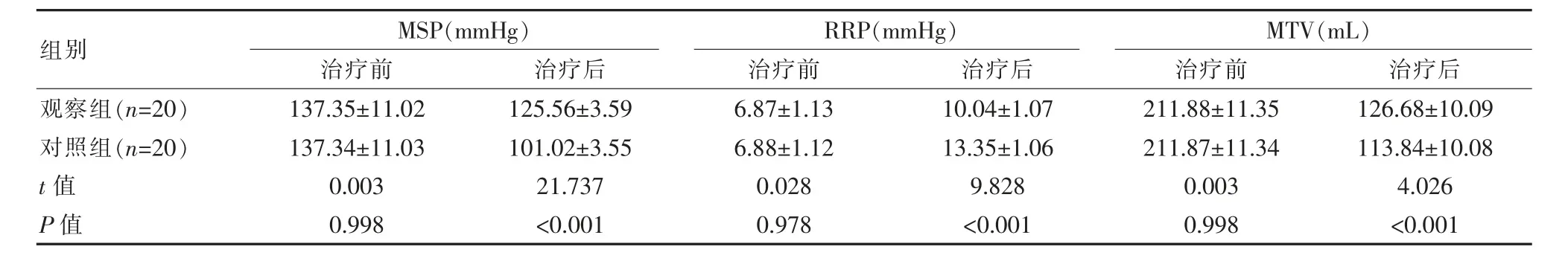
表3 两组患者治疗前后肛肠功能变化对比(±s)
组别观察组(n=20)对照组(n=20)t 值P 值MSP(mmHg)治疗前 治疗后RRP(mmHg)治疗前 治疗后137.35±11.02 137.34±11.03 0.003 0.998 125.56±3.59 101.02±3.55 21.737<0.001 6.87±1.13 6.88±1.12 0.028 0.978 10.04±1.07 13.35±1.06 9.828<0.001 MTV(mL)治疗前 治疗后211.88±11.35 211.87±11.34 0.003 0.998 126.68±10.09 113.84±10.08 4.026<0.001
2.4 两组患者并发症发生率对比
观察组患者术后并发症总发生率明显低于对照组,差异有统计学意义(P<0.05),见表4。

表4 两组患者并发症发生率对比[n(%)]
3 讨论
临床在面对低位直肠癌时推荐使用外科切除手术的治疗方式, 这样做的目的在于完整切除恶化肿瘤病灶,对周围淋巴结进行清扫,最大程度降低术后癌细胞的转移概率[4-5]。 开腹下切除手术的应用时间相对较早,虽然其操作简便,但治疗效果相对较差,且术后并发症概率相对较高。 而随着现代腹腔镜技术的逐渐完善和革新, 使直肠癌外科手术中该技术的应用范围进一步扩大。但需要注意的是,低位直肠癌的病灶所在部位较为特殊,其接近肛门括约肌、提肛肌等结构,如手术过程中未实施有效的保护,则很容易导致术后排便功能障碍, 甚至导致患者丧失自主排便功能[6-8]。 因此腹腔镜下低位直肠癌手术的操作难度相对较高, 很多临床医生对这种手术方式仍存在明显的顾虑。 但腹腔镜下手术的有效性、 安全性、根治率等方面均优于传统开腹手术,因此医疗机构需要不断克服相关困难, 以最大程度确保低位直肠癌患者的治疗效果[9-10]。
相比于其他恶性肿瘤类外科手术而言, 低位直肠癌的治疗更加注重于远期疗效, 而这也与低位直肠自身功能有着密切联系。 根据国内大数据临床研究显示, 采取传统开腹式手术治疗低位直肠癌的患者5年后生存率低于80%, 而运用腹腔镜手术后可将5年后生存率维持在85%左右。 采取腹腔镜下手术方式有利于患者术后免疫功能的重塑, 由于腹腔镜手术属于微创外科治疗手段, 对机体的影响相对较小, 因此在术后短时间内即可实现免疫功能的重塑,不仅缩短了恢复时间,也可降低术后短期内感染类并发症的发生概率,减小术后医疗成本[11-12]。
低位直肠癌病灶所处位置较为特殊, 因而对操作的安全性、准确性的要求均相应提升,运用腹腔镜手术后患者胃肠道功能的恢复时间大幅缩短, 且相比于开腹手术导致的术后肠梗阻、吻合口感染、尿潴留等并发症概率也会有所下降, 结肠和直肠吻合口合并瘘口的概率大幅减低[13-15]。加之现代腹腔镜已经实现对盆腔内狭窄位置的观察, 且手术视野也在不断扩大, 实际操作时并不会影响对病灶所在位置的捕捉。配套超声刀可实现更加细微的操作,对于盆筋膜、 脏壁层间组织间隙处理的准确性也得到了进一步的保障,在确保组织完整切除的前提下,对周围组织形成更有效的保护机制[16-19]。
该研究结果指出, 观察组患者术后并发症总发生率5.00%明显低于对照组(P<0.05)。 该研究结果与吴昌旭等[20]发表文章结果中,腹腔镜组患者术后并发症总发生率7.02%低于开腹患者22.81%(P<0.05)的结论相一致。
综上所述, 低位直肠癌患者采取腹腔镜手术治疗具有对患者伤害小、出血量少、术后患者恢复快等优点,同时可减轻手术引起的炎症反应,促进患者肛肠动力的恢复,安全性高。

