nestin启动子驱动微管蛋白-EGFP载体的构建及其在神经干细胞中的应用
卓润, 屠琪峰, 马超, 林阁, 刘梅, 董张及
(南通大学 教育部/江苏省神经再生重点实验室, 南通 226001)
神经干细胞/前体细胞是一类具有自我更新和分化潜力的细胞,可以通过不对等的分裂方式产生神经组织的各类细胞。神经受损后,神经干细胞的动员在一定程度上可以促进感觉、认知和运动功能的恢复[1-3]。Nestin[4]作为一种中间丝蛋白,在细胞内常与微管、微丝共同构成细胞骨架,从而维持细胞独特的形态和弹性。在生物体发育中Nestin蛋白主要表达于神经干细胞,且具有严格的时空顺序。一旦神经干细胞向终末方向分化时,Nestin表达显著减少,甚至不表达[5],故在中枢神经系统内Nestin被认为是神经发育中神经干细胞的标志之一[6-7]。
微管主要是由α/β微管蛋白异二聚体组装成的一种细长、中空的圆柱管状结构[8],是真核细胞骨架的重要组成成分。微管在许多重要的细胞进程中发挥功能,包括神经元特殊形态的维持、生长锥的导向、轴突的延伸等,同时微管还为细胞内物质运输提供轨道,参与一系列的细胞进程。
本研究旨在构建pzNestin-EGFP-α-Tubulin质粒,在nestin启动子驱动下表达GFP-α-Tubulin融合蛋白,用于动态观察神经干细胞中微管行为。
1 材料与方法
1.1 实验动物
野生型Tubingen斑马鱼品系、SD孕鼠均由南通大学实验动物中心提供。神经干细胞取自SD大鼠孕14 d胎鼠(E14)。动物实验均遵守南通大学实验动物伦理规范,本研究获得南通大学实验动物中心审批(编号S20210115-408)。
1.2 试剂与仪器
CO2细胞培养箱,限制性内切酶NotI 和BamHI(Thermo Fisher公司),超净工作台(江苏苏净集团有限公司),激光共聚焦显微镜(Leica TCS SP5),pEASY®-Blunt Cloning Kit和TransZol Up Plus RNA Kit(北京全式金生物技术有限公司),HiScript® Ⅲ 1st Strand cDNA Synthesis Kit和DNA Marker(南京诺唯赞公司),微量注射枪头(Eppendorf公司),显微注射仪(Narishige公司),高保真PCR酶KOD-FX试剂盒(TOYOBO公司),YSY buffer(南京尧舜禹生物科技有限公司),DNA序列分析(苏州金唯智公司)。
1.3 引物、质粒与聚合酶链式反应
本研究中所使用引物序列见表1,由南京金斯瑞生物公司合成。全长人α-Tubulin与EGFP融合基因的质粒pIRESneo-EGFP-α-Tubulin购自Addgene,登录号为12298。PCR反应按KOD FX DNA聚合酶(东洋纺)试剂说明书操作:反应体系2×Buffer,0.4 mmol/L dNTP,0.3 μmol/L正向引物,0.3 μmol/L反向引物,KOD-FX 0.4 U,2 μL模板;扩增去除CMV启动子的质粒骨架PCR反应程序:94 ℃,2 min;30×(98 ℃,10 s;60 ℃,30 s;68 ℃,4 min);68 ℃, 5 min。扩增Nestin启动子上游-925bp序列片段PCR反应程序:94 ℃,2 min;30×(98 ℃,10 s;60 ℃,30 s;68 ℃,4 min);68 ℃, 5 min。扩增EGFP-α-Tubulin片段PCR反应程序:94 ℃,2 min;30×(98 ℃,10 s;60 ℃,30 s;68 ℃,2.2 min);68 ℃, 5 min。

表1 PCR引物序列Table 1 Primer sequence of PCR
1.4 斑马鱼基因组DNA提取
吸取10个受精后24 h的斑马鱼胚胎,放入0.2 mL离心管,弃去多余E3 Buffer,加入10 μL的YSY buffer。放入PCR仪,设置程序:65 ℃、30 min,95 ℃、5 min,16 ℃、1 min。基因组DNA提取结束后放4 ℃备用。
1.5 斑马鱼RNA提取
收集含有绿色荧光的胚胎,弃掉多余的液体,然后用TransZol Up Plus RNA 试剂盒,加500 μL TRIzol,匀浆处理后室温静置5 min。加入100 μL氯仿,室温剧烈震荡30 s后静置。预冷离心机,4 ℃,11 200 r/min、15 min,吸取水相与无水乙醇(V水∶V乙醇=1∶1)过吸附柱。分别使用CB9和WB9(已加无水乙醇)过柱清洗2次,11 200 r/min,离心30 s。最后加入15 μL RNase Free Water洗脱。
1.6 斑马鱼cDNA合成
(1)基因组 DNA 去除。将2 μL 5× gDNA wiper Mix,10 μL水和2 μg总RNA混匀,在42 ℃孵育2 min。(2)配制第一链 cDNA 合成反应液。取上一步反应产物,加入2 μL 10× RT Mix,2 μL HiScript® Ⅱ Enzyme Mix,1 μL Oligo dT23VN (50 μmol/L),1 μL Random hexamers (50 ng/μL)及4 μL水,在37 ℃孵育15 min,85 ℃热灭活5 s。
1.7 显微注射
斑马鱼胚胎注射按文献[9]操作。简要步骤包括:收集胚胎,使用1× E3 buffer (5 mmol/L NaCl, 0.17 mmol/L KCl, 0.33 mmol/L CaCl2, 0.33 mmol/L MgSO4, pH 7.4) 冲洗,使胚胎紧密排版于模具槽中;通过Eppendorf微量枪头将注射液加至已制备好的玻璃电极中,装到成茂IM400显微注射仪持针器上;调节显微注射仪注射压力、时间,每个胚胎注射1 nL体积质粒溶液。胚胎发育至78 h进行共聚焦显微镜观察并成像。
1.8 神经干细胞培养
大鼠神经干细胞分离、纯化培养方法按文献[10]操作。简要步骤如下:
取材及P0代培养:取E14用适量乙醚麻醉,颈椎脱臼处死后75%乙醇消毒;在超净工作台中取出胎鼠置于预冷的无菌培养皿中,取出胎脑置Hanks解剖液中,清洗2~3遍备用;体视显微镜下剥离脑膜,剔除海马等组织,将皮层放于预先准备好的3 mL完全培养基中,剪成1 mm3大小,用吸管轻轻吹打使细胞分散,制成单细胞悬液;过200目筛网、计数、置于神经干细胞培养基于37 ℃培养箱中培养至成球。
干细胞传代:悬浮培养的神经干细胞球,当直径达到100~150 μm进行传代。收集细胞球于15 mL离心管静置约5 min,弃培养基,留约100 μL细胞沉淀;加1 mL 干细胞消化液,室温消化10 min,加入4 mL 含血清培养基终止消化,1 000 r/min离心5 min收集沉淀;弃上清,加入 2 mL培养基重悬稀释后计数;每个10 cm直径大皿中接种6×106个细胞,继续培养。
1.9 细胞电转
转染前将培养的神经元消化成单个细胞,计数,1 000 r/min离心5 min;去上清,加入适量电转液opti-MEM重悬,使100 μL opti-MEM中含300万细胞。每个体系中加入2.5 μg的pEGFP-N1或pzNestin-EGFP-α-Tubulin,设置电压125V、脉冲时长7.5 ms条件进行电转。电转完毕,种入6孔板,放入37 ℃培养箱中进行培养。培养至48 h进行荧光显微镜观察并拍摄。
2 结果
2.1 pzNestin-EGFP载体的构建
采用引物(PEGFP-N1-scattold,序列见表1)扩增pEGFP-N1质粒序列,获取去除CMV启动子的质粒骨架。引物(Nestin promoter,序列见表1)扩增斑马鱼基因组DNA得到nestin转录起始位点上游-925 bp启动子[11]序列片段。通过重叠PCR[12]将上述两个PCR产物连接,用SalI处理重叠PCR的产物,使其两端出现SalI黏性末端,纯化后用连接酶处理,形成环形质粒,转化DH5α大肠杆菌。以上改造实现了用nestin启动子替换pEGFP-N1质粒原有的CMV启动子序列。使用Seq1和pEGFP-N-3引物测序,鉴定获得的pzNestin-EGFP质粒。
2.2 pzNestin-EGFP-α-Tubulin表达载体的构建
采用引物(EGFP-α-Tubulin,序列见表1)。对质粒pIRESneo-EGFP-α-Tubulin进行PCR扩增,获得含BamHI和NotI酶切位点的EGFP-α-Tubulin片段,目的片段大小为2 128 bp,PCR产物进行纯化。
同时采用NotI和BamHI对pzNestin-EGFP质粒快速酶切。酶切产物进行琼脂糖凝胶电泳,片段大小与预期一致(图1A)。酶切产物(条带a)经切胶回收,与酶切后的EGFP-α-Tubulin片段进行连接、转化、单克隆PCR鉴定(使用引物Seq1和Seq2),大小与预期相符(1 066 bp,图1B)。经过测序鉴定,获得pzNestin-EGFP-α-Tubulin表达载体的质粒(图1C)。

A:pzNestin-EGFP质粒酶切电泳图(条带a为载体骨架,条带b为EGFP);B:pzNestin-EGFP-α-Tubulin质粒连接验证电泳图;C:pzNestin-EGFP-α-Tubulin质粒图谱。A: Electrophoresis of digested pzNestin-EGFP plasmid (band a is the vector backbone, and band b is EGFP); B: Verification of pzNestin-EGFP-α-Tubulin plasmid; C: pzNestin-EGFP-α-Tubulin plasmid map.图1 pzNestin-EGFP-α-Tubulin质粒的构建Figure 1 Construction of pzNestin-EGFP-α-Tubulin plasmid
2.3 pzNestin-EGFP-α-Tubulin在斑马鱼中的定位与表达
将pEGFP-N1或pzNestin-EGFP-α-Tubulin通过显微注射注入斑马鱼胚胎,并将斑马鱼胚胎置于含有0.003%PTU[13]的1× E3 buffer中,在28.5 ℃恒温培养箱中培养。在部分个体中捕捉到荧光信号;63倍水镜下能够明显观察到微管样丝状的网架结构,表明质粒在斑马鱼胚胎发育中表达(图2)。拍照后分别收集注射pEGFP-N1以及pzNestin-EGFP-α-Tubulin后检测到绿色荧光的斑马鱼胚胎提取RNA并逆转录提取cDNA,采用引物(GFP F1、GFP R1和α-Tubulin-R)对cDNA进行PCR扩增,扩增结果见图2D,表明pzNestin-EGFP-α-Tubulin在斑马鱼体内转录出EGFP-α-TubulinmRNA,提示绿色荧光信号是EGFP-α-Tubulin在斑马鱼胚胎中的特异性表达。
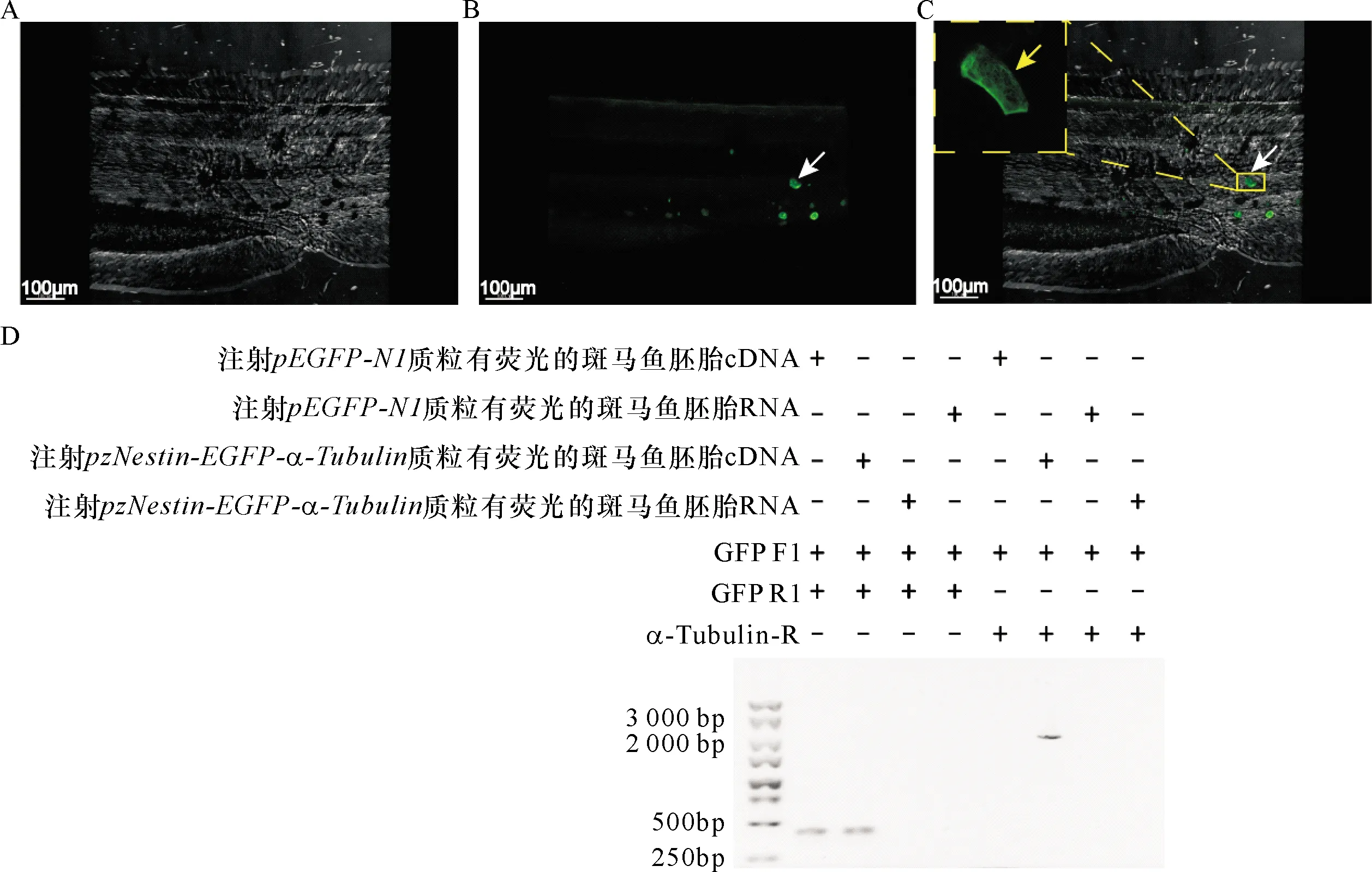
A:胚胎发育78 h斑马鱼泄殖孔附近明场成像;B:图A所摄区域的绿色荧光信号, 箭头所示为EGFP-α-Tubulin融合蛋白信号;C:图A和图B的重叠,左上小图中黄色箭头所指为白色箭头处的放大图;D:PCR检测EGFP-α-Tubulin在斑马鱼胚胎中的特异性表达A: Brightfield image of 78 hpf zebrafish cloacal pore; B: Fluorescence image of the area in panel A, the white arrow indicates the expression of EGFP-α-Tubulin protein; C: Merge image of panel A and B, the yellow arrow indicates a magnification box of the white arrow pointed; D: Detection of specific expression of EGFP-α-Tubulin in zebrafish图2 pzNestin-EGFP-α-Tubulin在斑马鱼胚胎中的表达Figure 2 Expression of pzNestin-EGFP-α-Tubulin in zebrafish embryo
2.4 pzNestin-EGFP-α-Tubulin在大鼠神经干细胞中的表达
考虑到nestin启动子序列在物种间的高度保守性,通过PROMO数据库(http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3/)预测大鼠Nestin启动子区上游 (-1 000 bp) 和斑马鱼nestin启动子区上游 (-925 bp) 序列是否具有相同的转录因子(TFs)结合位点。结果显示大鼠Nestin启动子区域预测有77个转录因子,斑马鱼nestin启动子区域预测有70个转录因子。经比较发现有36个相同的转录因子,其中包括转录因子Pax6和Nkx2.1,被认为是神经干细胞中重要的转录因子[14-15]。因此,斑马鱼nestin启动子可能在大鼠细胞中有相似的表达活性。采用电转方法尝试pzNestin-EGFP-α-Tubulin质粒在大鼠神经干细胞中表达。电转后培养48 h在荧光显微镜下观察,结果显示在干细胞球中有绿色荧光表达(图3)。
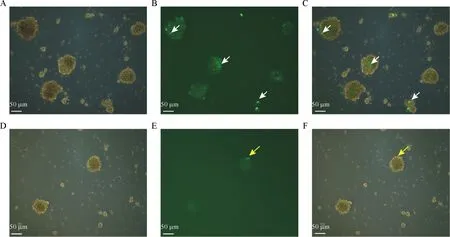
A、D:质粒电转48 h神经干细胞的明场;B、E:质粒电转48 h神经干细胞的荧光图;C、F:明场和荧光的叠加图。白色箭头为EGFP表达,黄色箭头为EGFP-α-Tubulin融合蛋白表达。A、D: brightfield images of neural stem cells 48 h after plasmid electroporation; B、E: fluorescence images of neural stem cells 48 h after plasmid electroporation; C、F: merge images of panel A-B and panel D-E. The white arrow indicates expression of GFP, while the yellow arrow indicates expression of EGFP-Tubulin protein.图3 质粒pEGFP-N1(A-C)和pzNestin-EGFP-α-Tubulin(D-F)在大鼠神经干细胞中的表达Figure 3 Expression of pEGFP-N1 (A-C) and pzNestin-EGFP-α-Tubulin (D-F) in rat neural stem cells
3 讨论
中枢神经系统的发育对于动物体早期发育至关重要,神经干细胞在增殖和迁移过程中涉及微管网络的变化,其呈高度动态性[16, 17]。微管在快速聚合与解聚阶段之间不断变换,这个过程称为“动态不稳定”[18]。微管依赖这种动态性不断地进行重塑,组装成各种微管阵列,来满足细胞的需求,使细胞发挥正常的功能[19]。
巢蛋白Nestin是一种中间丝蛋白,它在哺乳动物神经干细胞/前体细胞中高表达,已被广泛用作神经干细胞/前体细胞的标志分子。因此,Nestin的表达位置和强度对分析神经系统的发育具有重要作用。虽然成体神经系统的Nestin表达下降,但是中枢神经损伤后神经干细胞有一定的动员能力,Nestin表达又重新升高[20],因此Nestin也可以作为神经系统病变和损伤的快速敏感诊断指标之一。
本研究构建的pzNestin-EGFP-α-Tubulin质粒能在斑马鱼胚胎和大鼠来源的神经干细胞中表达,表明nestin启动子高度保守性,可以跨物种用于其他高表达Nestin细胞中的微管骨架标记,同时采用特异性引物对注射过pEGFP-N1以及pzNestin-EGFP-α-Tubulin且绿色荧光的斑马鱼胚胎的cDNA进行特异性扩增,确保了pzNestin-EGFP-α-Tubulin在斑马鱼胚胎中表达的特异性;为进一步探讨Nestin特异表达与细胞行为,如增殖、迁移等过程中的微管动态改变提供了一种新的研究工具。
作者贡献声明
卓润:实验研究、分析数据、撰写论文;屠琪峰:参与实验操作和数据分析;马超:参与实验操作和数据分析;林阁:参与实验操作和数据分析;刘梅:提出研究思路和框架,修改论文;董张及:提出研究思路和框架,修改论文。
利益冲突声明
本研究未受到企业、公司等第三方资助不存在潜在利益冲突。
——水芹主要害虫识别与为害症状

