基于lncRNA MALAT1/TGF-β通路调控EMT探讨白花蛇舌草抑制大肠癌细胞的迁移和侵袭
陈武进 ,黄 伟 ,陈 勇 ,陈旭征 ,4,华杭菊 ,林久茂 ,4*
(1.福建中医药大学附属人民医院,福建 福州 350004;2.福建中医药大学中西医结合研究院,福建 福州 350122;3.中西医结合基础福建省高等学校重点实验室,福建 福州 350122;4.福建省中西医结合老年性疾病重点实验室,福建福州350122)
大肠癌是世界范围内常见的消化道恶性肿瘤[1],转移是大肠癌治疗失败并导致死亡的主要因素[2-3],抑制肿瘤细胞转移是防治肿瘤的重要策略,其中上皮-间质转化(EMT)是大肠癌转移的主要因素和重要机制之一,调控EMT 对大肠癌转移至关重要[4]。长非编码RNA肺癌转移相关转录本1(lncRNA MALAT1)在多种肿瘤中表达异常,对肿瘤细胞转移有重要调控功能[5]。研究发现lncRNA MALAT1可上调TGF-β 的表达,提高EMT,促进癌细胞转移[6-9]。白花蛇舌草(Hedyotis diffusaWilld.,HDW)因其显著的抗肿瘤作用是目前国内外抗肿瘤研究的热点中药之一,临床应用研究显示其无明显的毒副作用[10-14]。本课题组前期研究表明HDW 可影响多条肿瘤相关信号通路,发挥抑制大肠癌细胞转移等作用[11,15-17]。但 HDW 对 lncRNA MALAT1 表达影响与其抑制大肠癌转移之间的关系尚不明确,因此,本实验从lncRNA MALAT1/TGF-β 通路调控EMT 角度探讨HDW 抑制大肠癌细胞迁移和侵袭的机制。
1 实验材料
1.1 实验细胞 人结肠癌SW620 细胞株购于南京凯基生物科技有限公司。
1.2 药物提取 白花蛇舌草全草用85%乙醇回流提取3次并过滤,合并提取液,浓缩至无醇味,提取液在旋转蒸发仪上蒸发得到浸膏,然后真空干燥得到干燥粉末,即HDW 提取物。
1.3 实验试剂 RPMI-1640 培养基、胎牛血清、胰蛋白酶、磷酸盐缓冲液PBS 均购自美国Life Tech‑nologies 公司;Transwell 小室、基质胶均购自美国Corning 公司;BCA 蛋白定量检测试剂盒、SYBRTM Select Master Mix 试剂均购自美国Thermo 公司;逆转录试剂盒(大连宝生物工程有限公司);SDSPAGE 配胶试剂盒(北京康为世纪生物科技有限公司);超敏化学发光检测试剂盒(苏州宇恒生物科技有限公司);RIPA 裂解液(武汉博士德生物工程有限公司);SDS-PAGE 配胶试剂盒(上海碧云天生物技术有限公司);TGF-β 抗体、Smad4 抗体、E-cad‑herin 抗体、N-cadherin 抗体、Vimentin 抗体、GAPDH一抗、HRP 二抗均购自美国CST 公司。
1.4 实验仪器 CO2培养箱、-80℃超低温冰箱均购自美国Thermo 公司;多功能酶标仪(奥地利Tecan公司);倒置显微镜(德国Leica 公司);全自动细胞计数仪(美国Life 公司);垂直电泳槽、化学发光成像系统ChemiDocXRS+均购自美国Bio-Rad 公司。
2 实验方法
2.1 HDW 药液的制备 称取200 mg HDW 提取物溶于1 mL PBS,制备成200 mg/mL HDW 药液,储存于-20℃冰箱中。
2.2 SW620 细胞培养及干预 SW620 细胞株培养于含有10%FBS、1%双抗(含100 U/mL 青霉素和100 µg/mL 链霉素)的 RPMI-1640 培养基中,于37℃、5%CO2及饱和湿度的细胞培养箱内培养。细胞汇合度达到80%左右时用0.25%胰酶消化、传代培养。取对数生长期的SW620 细胞分为0 mg/mL组、0.5 mg/mL组、1 mg/mL组、2 mg/mL组。
2.3 倒置显微镜观察SW620 细胞形态 取各组细胞,按2.5×105个/mL细胞密度接种于6孔板中,每孔2 mL,细胞贴壁后,各组分别加入0、0.5、1、2 mg/mL HDW 药液干预24 h。24 h 后在倒置显微镜下观察细胞数量、形态变化并拍照记录。
2.4 CCK-8 法检测细胞活力 取各组细胞,按1×105个/mL 细胞密度接种于96 孔培养板中,每孔100 µL,细胞贴壁后,各组分别加入0、0.5、1、2 mg/mL HDW 药液干预 24 h。24 h 后每孔加入含 10 µL 的CCK-8 溶液100 µL,37℃孵育2 h,于全自动酶标仪450 nm 测定各组吸光度值(即OD 值),并按下列公式计算细胞活力:
细胞活力/%=药物组OD 值/0 mg/L组OD 值×100%
2.5 划痕实验检测细胞迁移能力 取各组细胞,按2.5×105个/mL细胞密度接种于6孔板中,每孔2 mL,细胞贴壁后,汇合度达到80%~90%时,使用小规格移液枪头对6 孔板进行划痕,各组分别加入0、0.5、1、2 mg/mL HDW 药液干预24 h,于0、24 h 时分别在倒置显微镜下观察细胞迁移情况并拍照。
2.6 Transwell 实验检测细胞迁移、侵袭能力 取各组细胞,按 2.5×105个/mL 细胞密度接种于 6 孔板中,每孔2 mL,细胞贴壁后,各组分别加入0、0.5、1、2 mg/mL HDW 药液干预 24 h。24 h 后吸弃各孔溶液,分别进行消化。空白培养基重悬调整消化后的细胞密度为2.5×105个/mL,将200 µL 细胞悬液滴加于不含基质胶上室(迁移实验)和含基质胶上室(侵袭实验),下室加入700 µL 完全培养基,放入恒温箱培育12 h。12 h 后上室固定于4%多聚甲醛20 min,0.1%结晶紫染色15 min,超纯水漂洗3次,棉签擦拭多余液体后,倒置显微镜下观察被结晶紫染色的迁移细胞数和侵袭细胞数,并拍照。
2.7 RT-qPCR 法检测 SW620 细胞 lncRNA MALAT1相对表达量 取各组细胞,按2.5×105个/mL 细胞密度接种于6 孔板中,每孔2 mL,细胞贴壁后,各组分别加入 0、0.5、1、2 mg/mL HDW 药液干预 24 h。24 h 后使用Trizol 试剂提取总RNA。逆转录试剂盒进行逆转录反应,首先依次加入1 µg 总RNA、2 µL 5×gDNA Eraser Buffer、1 µL gDNA Eraser后,加DEPC水至10 µL,42℃反应2 min 以除去DNA;随后再加入 4 µL 5×prime Script buffer、1 µL Mix、1 µL Mix、4 µL DEPC 水,37℃反应15 min,85℃反应 5 s,逆转录为cDNA。PCR 反应体系:5 µL Mix、2.2 µL DEPC水、2 µL cDNA、0.4 µL 上游引物、0.4 µL 下游引物,95℃预变性30 s,95℃变性10 s,60℃退火35 s,循环40次。通过7500 FastPCR 仪测定lncRNA MALAT1相对表达量。
2.8 Western blot 检测 TGF-β、Smad4、E-cadherin、N-cadherin、Vimentin 蛋白表达 取各组细胞,按2.5×105个/mL细胞密度接种于6孔板中,每孔2 mL,细胞贴壁后,各组分别加入0、0.5、1、2 mg/mL HDW药液干预24 h。24 h 后弃上清,用PBS 清洗,收集细胞后加入蛋白裂解液,用BCA 法进行蛋白定量,取40 µg 上样量于聚丙烯酰胺凝胶中电泳;后进行转膜;用5%脱脂奶粉对目的膜进行封闭1 h;然后于含有0.25%Tween-20的TBST中漂洗15 min(5 min/次,共3次),最后孵育目的一抗(GAPDH、TGF-β、Smad4、E-cadherin、N-cadherin、Vimentin;一抗稀释比例为1∶1 000)4℃摇床过夜。TBST 洗 3次,5 min/次;用相对应HRP 二抗(稀释比例为1∶5 000)室温孵育1 h,TBST 洗 3次,5 min/次。最后用 ECL 试剂显影成像。
2.9 统计学方法 采用SPSS 23.0 统计软件进行数据分析。计量资料属于正态分布的以()表示,采用t检验和单因素方差分析,非正态分布的采用秩和检验;计数资料采用χ2检验。
3 结果
3.1 各组细胞数量、形态比较 见图1。图1 显示:随着药物浓度的增加,细胞数量减少,形态皱缩变圆。

图1 各组细胞数量、形态比较(×100)
3.2 各组细胞活力比较 见图2。图2 显示:HDW可以降低SW620细胞活力,呈现一定剂量依赖性。
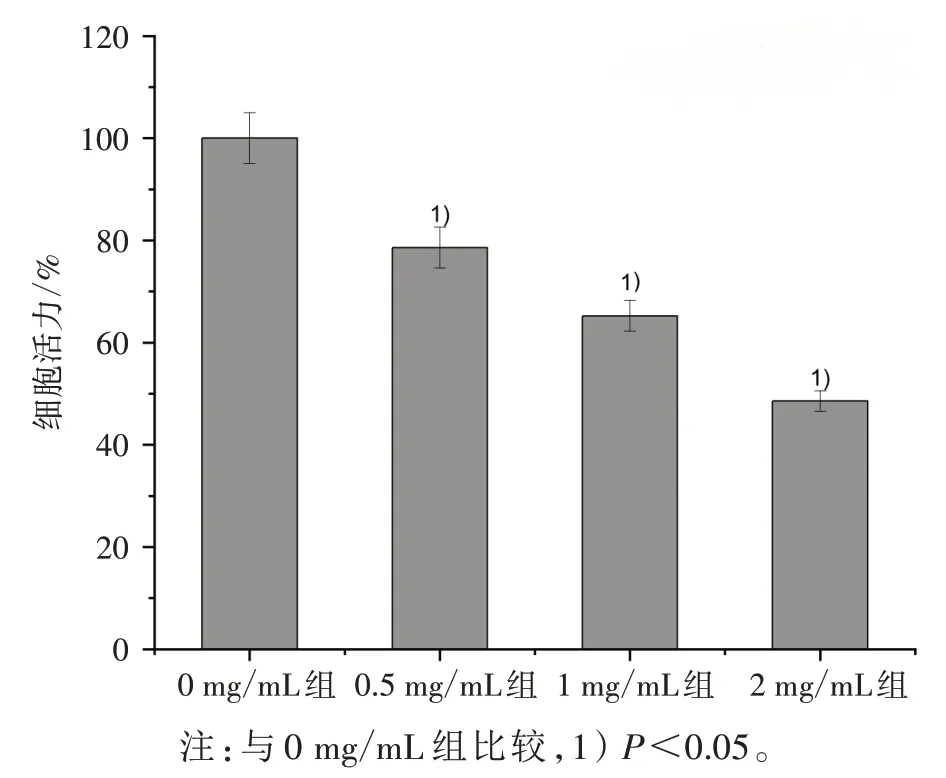
图2 各组细胞活力比较
3.3 各组迁移能力比较 划痕实验结果见图3。图3显示:与 0 mg/mL组比较,0.5 mg/mL组、1 mg/mL组划痕内细胞数量较少,2 mg/mL组划痕内几乎无细胞分布。Transwell 迁移实验结果见图4。图4 显示:与0 mg/mL组比较,随着HDW 药物浓度的增加,各组SW620 细胞迁移数逐渐减少。

图4 各组Transwell 迁移实验结果比较(×200)
3.4 各组侵袭能力比较 结果见图5。图5 显示:与0 mg/mL组比较,随着HDW 药物浓度的增加,各组SW620 细胞侵袭数逐渐减少。
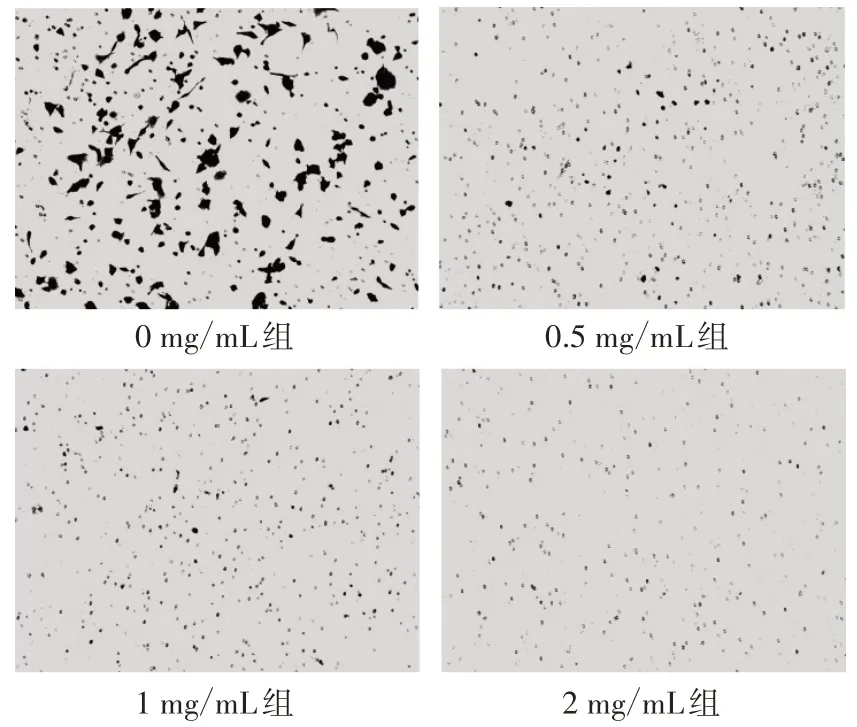
图5 各组Transwell 侵袭实验结果比较(×200)
3.5 各组lncRNA MALAT1 相对表达量比较 结果见图6。图6 显示:与0 mg/mL组比较,随着HDW药物浓度的增加,SW620 细胞lncRNA MALAT1 相对表达量逐渐下调(P<0.05)。

图6 各组lncRNA MALAT1 相对表达量比较
3.6 各组 TGF-β、Smad4、Vimentin、E-cadherin、N-cadherin 蛋白表达比较 见图7、表1。结果显示:与0 mg/mL组比较,随着HDW 药物浓度的增加,SW620细胞TGF-β、Smad4、Vimentin、N-cadherin 蛋白表达逐渐降低(P<0.05),E-cadherin 蛋白表达逐渐增高(P<0.05)。
表1 各组TGF-β、Smad4、Vimentin、E-cadherin、N-cadherin 蛋白表达比较()

表1 各组TGF-β、Smad4、Vimentin、E-cadherin、N-cadherin 蛋白表达比较()
注:与0 mg/mL组比较,1)P<0.05。
N-cadherin 0.57±0.06 0.54±0.041)0.44±0.051)0.35±0.071)组别0 mg/mL组0.5 mg/mL组1 mg/mL组2 mg/mL组TGF-β 0.78±0.07 0.72±0.031)0.62±0.091)0.53±0.051)Smad4 0.70±0.04 0.59±0.091)0.48±0.051)0.31±0.031)Vimentin 0.61±0.03 0.50±0.081)0.43±0.081)0.37±0.051)E-cadherin 0.31±0.07 0.45±0.031)0.48±0.051)0.57±0.061)
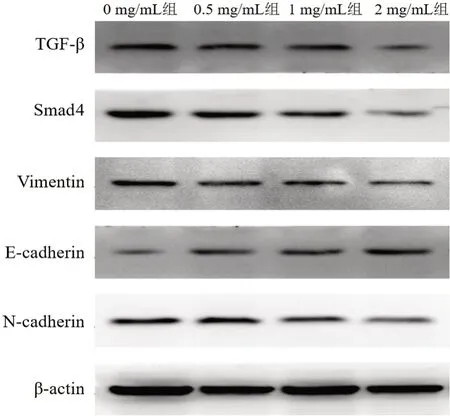
图7 各组TGF-β、Smad4、Vimentin、E-cadherin、N-cadherin 蛋白条带图
4 讨 论
目前虽然外科综合治疗大肠癌有了长足发展,但是临床大肠癌转移急剧增多,对抗肿瘤药物的研究也逐渐聚焦于抑制肿瘤转移。本研究通过CCK-8 检测发现HDW 具有抑制大肠癌SW620 细胞活力作用,同时通过划痕和Transwell 实验,发现随着HDW 药物浓度增加,HDW 抑制大肠癌SW620 细胞迁移、侵袭作用也逐渐增强。
研究显示肿瘤转移是个复杂过程,肿瘤细胞从原发灶增殖生长到远处转移灶要经过漫长行程和诸多生物学应变阶段[18]。长链非编码RNA(long noncoding RNA,lncRNA)在肿瘤转移中的作用被逐渐重视,被认为是可能的肿瘤转移标志物,并将应用于临床以预测肿瘤转移及预后。lncRNA MALAT1已经被证实与包括大肠癌在内的多种肿瘤细胞的转移密切相关,其可上调TGF-β 的表达。活化的TGF-β 进一步与下游转录因子Smad4 结合形成复合物转入细胞核内,并与其他转录因子或者辅助蛋白一起调控靶基因转录,使E-cadherin 表达下降,N-cadherin、Vimentin 表达增高,提高 EMT 能力,进而使肿瘤细胞的的转移能力增强[4,18-22],因此,阻断lncRNA MALAT1/TGF-β 通路调控 EMT 是有效的防治肿瘤转移的方式。本研究通过RT-qPCR 法检测发现HDW 可明显抑制lncRNA MALAT1 相对表达量,并通过Western blot 检测发现HDW 可抑制TGF-β、Smad4、Vimentin、N-cadherin 蛋白表达,促进E-cadherin 蛋白表达,且都呈剂量依赖模式。结果表明 HDW 可通过 lncRNA MALAT1/TGF-β 通路调控肿瘤细胞EMT,抑制大肠癌细胞迁移和侵袭,进而抑制大肠癌细胞转移。
本研究从lncRNA MALAT1/TGFβ 通路调控EMT 角度探讨HDW 对大肠癌SW620 细胞迁移和侵袭的抑制作用,为其临床治疗结直肠癌转移提供科学依据。但由于人体肿瘤转移过程受到众多机制的复杂调控,白花蛇舌草对人结肠癌细胞的转移是否涉及其他信号通路,有待进一步研究探讨。

